囊腔型肺癌的CT表现特点及病理基础探讨
谭洋,汪琼,沈晶,朱瑞萍,伍建林
囊腔型肺癌(thin-walled cystic lung cancer)通常为以薄壁为主要表现的孤立性囊性病灶(极少数多发),囊壁不伴壁结节,以肺腺癌多见,其发生率为2%~16%[1-2]。随着低剂量CT筛查肺癌日渐普及,囊腔型肺癌的检出率逐年上升,但国内外文献多缺乏大样本病例研究,对其特征性CT表现及相应的病理基础缺乏较深入地认识,临床放射诊断医师对囊腔型肺癌的影像特点认识不足,极易误诊及漏诊。为此,我们回顾性收集三级甲等综合医院30例囊腔型肺癌患者临床资料、影像资料、病理资料,着重分析总结其提示恶性的特殊CT征象及其相应的病理基础,提高囊腔型肺癌的认识及诊断水平。
材料与方法
1.临床资料
回顾性搜集大连大学附属中山医院2012年1月-2017年12月经组织病理学证实的30例囊腔型肺癌患者的临床和影像资料。其中男17例、女13例,年龄39~77岁,平均(60.77±10.12)岁。入组标准:①经手术切除或活检组织病理学证实;②手术前2周内行至少1次薄层CT扫描,且CT图像经PACS上传至工作站;③基线CT检查,病灶以囊腔表现为主,囊腔壁厚度≤4 mm。排除标准:①临床数据或影像资料不全;②囊壁有壁结节。
30例中7例(23.33%,7/30)有确切吸烟史。12例(40.00%,12/30)因出现临床症状就诊,18例(60.00%,18/30)因体检偶然发现。3例(10.00%,3/30)经支气管镜肺活检术确诊,4例(13.33%,4/30)经皮穿刺活检证实,23例(76.67%,23/30)经术后组织病理学证实。根据第8版国际抗癌联盟(Union for International Cancer Control,UICC)肺癌TNM分期标准[3],30例患者的临床分期:Ⅰ期22例(73.33%,22/30),包括ⅠA期16例(16/22),ⅠB期6例(6/22);ⅡA期3例(10.00%,3/30);ⅢB期1例(3.33%,1/30);Ⅳ期4例(13.33%,4/30),ⅣA期、ⅣB期各2例。
2.检查方法
使用Siemens Somatom Definition双源CT机(21例)或Somatom Definition AS 64 排CT机(9例)进行平扫。患者取仰卧位,扫描范围自胸腔入口至肋膈角下方层面,扫描参数:80~120 kV,200~280 mAs,矩阵512×512,层厚0.625~1.500 mm,螺距0.9~1.2,B70f及骨算法薄层重建(层厚0.625~1.500 mm)。图像观察:肺窗的窗宽1600~2000 HU,窗位-800~-600 HU;纵隔窗的窗宽250~350 HU,窗位30~50 HU;根据病灶大小和密度进行调整。
3.图像分析和病理观察
搜集所有患者的临床资料,包括性别、年龄、吸烟史和诊断方法等。所有CT图像均由2位胸部放射科高年资医师独立地通过PACS工作站进行阅片分析,同一患者均在同一天诊断,诊断结果不一致时通过进行协商,如未能达成共识则邀请一位主任医师通过会诊来确定。记录病灶的主要CT征象:病灶位置、囊腔形态(包括圆形、类圆形、不规则)、囊腔大小(测内壁,取囊腔最大轴径与其垂直径之和的平均值)、囊内是否有分隔(观察分隔有无纤维、血管)、囊壁厚度是否均匀、病灶是否含磨玻璃影、囊外壁有无紧邻的血管影、病灶周围有无血管集束征和胸膜凹陷征等。
23例经行手术切除的囊腔型患者,病灶标本经固定后,进行石蜡包埋、切片,然后行苏木精-伊红(hematoxylin-eosin,HE)染色。由一位高级职称病理学专家和一位经过培训合格的硕士研究生分别在显微镜下观察病灶的病理组织学,意见分歧时径协商达成一致意见。观察所有标本的病理组织学分类、囊腔的完整性、囊内分隔及其成分、囊壁特点及肿瘤细胞的生长方式等。
4.统计学方法
本研究中测量数据使用SPSS 20.0(IBM Statistics,Armonk,NY)软件进行统计学分析。呈正态分布的计量资料以均数±标准差表示,非正态分布的计量资料则采用中位数表示。计数资料则以频数及百分比表示。
结 果
1.囊腔型肺癌的CT特点
在发病部位上,30例中病灶位于双肺外周23例(76.67%),双肺中带5例(16.67%,5/30),内带2例(6.66%,2/30)。在两肺各肺叶分布上看,左肺上叶5例(16.67%,5/30),左肺下叶10例(33.33%,10/30),右肺上叶4例(13.33%,4/30),右肺中叶2例(6.67%,2/30),右肺下叶9例(30.00%,9/30)。本组中24例(80.00%)囊腔型肺癌的囊腔形态较规则(图1a),其中呈圆形18例(18/24)、类圆形6例(6/24);6例(20.00%,6/30)肺癌的囊腔形态不规则。本组中囊腔的大小变异较大,囊腔直径0.89~6.65 cm,平均(2.46±1.27) cm。27例(90.00%, 27/30)囊壁不均匀增厚(图2a),3例(10.00%,3/30)囊壁厚薄均匀。19例(63.33%,19/30)囊内见不完整或完整的分隔(图3a),分隔结构及组成成份不一,9例(9/19)分隔见血管,6例(6/19)可观察到支气管,4例(4/19)可同时观察到血管和支气管。30例患者中16例(53.33%)病灶含有磨玻璃影(图4a),其11例(11/16)为混合磨玻璃影,5例(5/16)见纯磨玻璃影。而多达21例(70.00%,21/30)病灶边缘形态不规则。在伴有囊壁外软组织成分病灶中,可见某些恶性征象,23例(76.67%,23/30)囊性病灶周围可见血管集束征,25例(83.33%,25/30)存在胸膜凹陷征,另外20例(66.67%,20/30)囊外壁见贴行的血管。
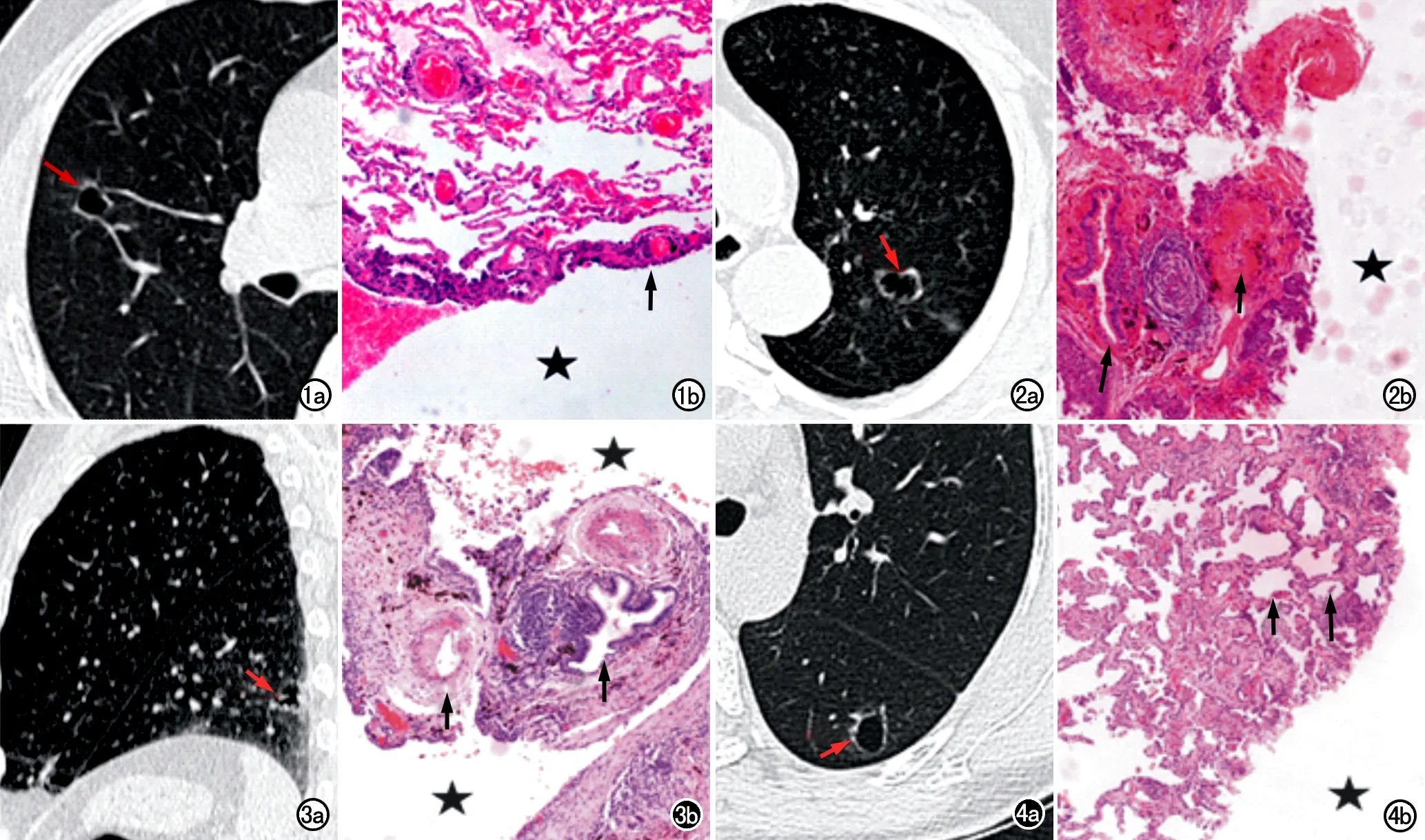
图1 女,53岁,右肺上叶肺腺癌。a)CT示右肺上叶囊腔灶,形态规则,囊外壁不规则(箭);b)对应的病理图片,镜下显示囊腔(星号)的内壁可见肿瘤细胞(箭)呈伏壁生长(×40,HE)。 图2 女,47岁,左肺上叶肺腺癌。a)CT示左肺上叶囊腔灶(箭),囊壁厚薄不均,囊壁及囊周可见数支血管;b) 对应的病理图片,镜下显示囊腔(星号)的壁内可见支气管(长箭)和血管(短箭)的形态完整,未被肿瘤细胞破坏(×40,HE)。 图3 男,65岁,左肺下叶肺腺癌。a)CT矢状面图像显示左肺下叶囊腔病灶,囊内可见分隔(箭),囊周有纤维条索;b)相对应的病理图片(×40,HE),镜下显示囊腔(星号)内可见分隔,其内可见小血管(短箭)、支气管(长箭)和红染的纤维组织。 图4 女,42岁,左肺下叶肺腺癌。a)CT示左肺下叶囊腔病灶,囊壁含磨玻璃影(箭),囊壁厚薄不均,囊外壁不规则。b) 与CT上的磨玻璃影相对应的病理图片(×40,HE),镜下显示肿瘤细胞紧贴肺泡壁生长(短箭),肺泡腔内有脱落的肿瘤细胞(长箭)。
2.囊腔型肺癌的病理基础
本组30例中腺癌26例(86.67%),鳞癌3例(10.00%),腺鳞癌1例(3.33%)。术后病理切片镜下观察:23例中10例(43.48)囊壁完整,本研究中对这10例的囊内及囊壁病理改变与影像学表现进行了对照分析。其中4例(40.00%,4/10)可见肿瘤细胞伏壁生长(图1b),3例(30.00%,3/10)肿瘤细胞以腺管样或乳头状分布为主,仅1例(10.00%,1/10)肿瘤细胞以微乳头样生长为主;2例(20.00%,2/10)镜下可观察到癌珠。CT图像与镜下病灶对照观察,10例(10.00%,10/10)囊壁均能观察到肿瘤细胞,6例(60.00%,6/10)显示肿瘤细胞的生长蔓延范围及方向不同,5例(50.00%,5/10)囊壁见纤维组织和(或)肺血管结构(图2b),与CT图像上病灶囊壁厚薄不均相对应。本组10例患者中4例(40%,4/10)可见囊内分隔(图3b),镜下观察到分隔内有增生的纤维组织和不同数量的肿瘤细胞成分,其中2例(2/4)分隔中可见小血管、1例(1/4)可见小支气管。而5例(50%,5/10)CT上显示病灶含磨玻璃影,对应镜下表现为肿瘤细胞呈伏壁样生长或呈乳头样向腔内生长,肺泡腔未被肿瘤细胞完全填充,部分肺泡腔内可见脱落的肿瘤细胞(图4b)。
讨 论
1.囊腔型肺癌的概述
囊腔型肺癌绝大部分无明显临床症状,因体检偶然发现。本研究中,男性患者略多于女性患者(男/女=17/13),平均年龄(60.77±10.12)岁,发病年龄趋于中老年,这与既往研究结果相似[4-6]。本研究中有吸烟史者仅7例(23.33%),可能与病例样本的选择及临床病史采集偏倚有关。但Fintelmann等[7]报道中多达97%有吸烟史,并表明囊性非小细胞肺癌更可能发生在吸烟者,而Guo等[6]研究中仅少数病例(33.33%,5/15)为吸烟者。笔者认为上述各研究中吸烟比例差异可能与研究对象选择不同及近年来低剂量CT筛查对象以吸烟者为高危人群有关。
既往推荐采用CT引导下经皮穿刺灌洗术(percutaneous needle washing, PNW)来诊断囊腔型肺癌[5],Nakahara等[8]报道的27例肺癌患者采用FNAB方法进行诊断,敏感度达91%。但临床实际工作中更多的患者是在基于CT表现临床初步疑诊的基础上经手术治疗而确诊,如Fintelmann等[7]报道的30例中仅4例经PNW诊断,本研究中大部分病例也是经手术证实(手术23例,PNW 4例)。笔者认为可能由于各研究中纳入标准不同所致。当囊腔型肺癌的实性成分较多且距离胸壁较近时,PNW的诊断敏感度较高,否则其假阴性率较高。本研究中囊腔型肺癌多为Ⅰ期(73.33%)或Ⅱ期(10.00%),此类患者以手术治疗为首选治疗方法,且预后良好[5,9]。术前提高对此类特殊肺癌的诊断准确性具有重要的临床意义。
2.囊腔型肺癌的病理基础
近年来,囊腔型肺癌的检出率、发病率明显增高[10]。综合既往报道及本研究,笔者总结认为孤立性囊腔类肺癌最常见的病理类型还是肺腺癌(86.67%,26/30),少数类型可为肺鳞癌、腺鳞癌,更少见者包括肉瘤样癌[4]、大细胞癌[6]、非典型类癌[11]和浸润性黏液腺癌[12-13]等。目前,肺囊腔型肺癌的形成机制学说较多。有研究证实,可能为炎性细胞或肿瘤细胞增殖致细支气管管腔形成“活瓣”效应[7,12,14],也可能为肺泡壁被肿瘤细胞壁破坏或融合而形成[7,11]。结合既往研究结果,笔者认为囊腔的形成可能为各种原因所致支气管管腔变窄而形成“活瓣”效应所致,猜测为细小支气管管腔变窄,阻碍部分气体与外界交换,致肺泡腔的残气量增加,随着呼吸性细支气管和/或肺泡壁的弹力纤维破坏,肺泡腔逐渐增大而形成囊腔。
囊腔型肺癌的特殊CT征象亦有其相应的病理基础。本研究中显微镜下观察显示,在CT图像上表现为厚薄不均的囊壁,是由于肺癌肿瘤细胞向周围生长蔓延的范围与程度不同所致,这与Fintelmann等[7]和Xue等[14]的观察结果一致,囊壁上还可见增生的纤维组织和/或血管结构。既往有研究证实CT上磨玻璃成分的镜下表现多为肿瘤细胞沿肺泡壁附壁生长所致,而肺泡腔并未完全被填塞[15]。本研究观察结果与文献报道一致。此外,国内有学者报道了囊腔内粗细不均的分隔为纤维血管组织及癌细胞成分[9]。本研究中也观察到类似的表现,并证实部分囊腔内分隔见到小血管和细支气管结构。笔者认为这些典型独特的病理表现及CT上相应的特殊征象与肿瘤细胞的生物学特点有关,同时也是与其它良性囊性病灶的重要鉴别要点。
3.囊腔型肺癌的CT特点及鉴别
本研究中囊腔型肺癌的CT表现具有一定特征型。病灶多位于双肺外周(76.67%),囊腔形态多规则(本组占80.00%),这与其他学者研究结果相似[5]。本组囊腔型肺癌的主要CT特点为囊壁不均匀增厚(占90.00%)、病灶边缘不规整(占70.00%)、血管贴边征(占66.67%)、囊内分隔(占63.33%)和磨玻璃影(占53.33%)。在Xue等[14]的报道中,囊腔肺癌的囊壁均呈不均匀增厚(100%),66.7%可见分隔,55.6%的病灶边缘不规则,但磨玻璃影仅占11.1%;在Fintelmann等[7]的报道中,含磨玻璃影者占33.33%;而在Farooqi等[11]的研究中仅占23.08%。本研究中出现磨玻璃影的比例较高(53.33%),可能是与肺腺癌所占比例较大有关,周围型肺腺癌中磨玻璃影的出现率相对较高。另外,于晶等[4]研究组中87.1%的肺癌囊腔内可见粗细不均的分隔影,而Qi等[16]报道的病例中仅18.7%可见囊内分隔,可能与不同研究中病例纳入标准不同有关。同时,大多数患者的病灶周边可见血管贴边征和支气管进入征,这2个征象也具有重要的提示诊断价值,可能与其形成机制有关。大多学者认为囊腔形成机制为“活瓣”效应,而肺动脉与支气管伴行,若支气管远端形成囊腔,可能推移伴行的血管导致两者紧密相邻[12,17,18]。另外,国内外学者文献也相继报道,若出现胸膜凹陷征和血管集束征,提示恶性病变的可能性较大[4,9,14,19]。在我们的研究中这2个征象的出现率较高(分别为83.33%和76.67%),但笔者认为两者均为恶性肺肿瘤的常见征象,而非囊腔型肺癌的特有征象。总之,通过临床上不断了解、认识并解读上述特征性的CT征象,有助于对此特殊类型的肺癌做出正确诊断。
Araki等[20]报道40岁以上患者中有8%可出现肺良性囊性病变。既往学者的研究报道多认为肺囊性良性病变为孤立性、囊壁菲薄且长时间随访多囊腔保持不变或略增大[7]。这与我们在病例收集过程中发现的囊性良性病变的演变相似。在回顾性收集病例过程中我们也常见到肺囊性良性病变,如硬化性肺细胞瘤、支气管扩张和肺大疱等,在CT图像上均可观察到病灶以薄壁囊腔为主,囊壁菲薄、对称,囊内极少见分隔,无壁结节,病灶周围未见磨玻璃灶,部分可见钙化灶,随访中病灶未见进展。
总之,囊腔型肺癌属囊腔类肺癌中的特殊亚型,中老年人多见,多无明显临床症状,以腺癌居多。CT上病灶多位于双肺外周,病灶囊壁厚薄不均、囊内分隔、囊壁含磨玻璃影、边缘不规则;其CT征象有其特殊的病理基础。熟悉和掌握囊腔型肺癌的CT特点及其病理基础有助于提高诊断水平,指导临床采用准确的治疗方案。同时,本回顾性研究也有一定局限性:样本量较少,同时部分病例随访数据不完整,这不利于评估囊腔型肺癌的总体发病率及随访中病灶的演变特点。希望今后通过较大样本量的CT与组织病理学对照观察和分析,更全面地了解和掌握囊腔型肺癌的特征。

