小金蝠蛾酚氧化酶原基因的克隆及表达分析
龙成燕,仝超群,陈若霓,陈仕江,卿玉玲,秦少容,周泽扬,李春峰
(1.西南大学,家蚕基因组生物学国家重点实验室,重庆 400715;2.重庆太极医药研究院有限公司,重庆 401147;3.重庆市中药研究院,重庆 400065)
冬虫夏草是中国传统的名贵中药材,是由冬虫夏草菌(Ophiocordycepssinensis)寄生于蝙蝠蛾属(Thitarodesspp.)昆虫幼虫后,形成菌核和子座的复合体[1-2]。目前,由于长期的过度采挖造成野生资源匮乏,环境破坏严重,因此快速规模化地人工培植冬虫夏草迫在眉睫[3]。而在整个人工培育冬虫夏草过程中,冬虫夏草寄主蝙蝠蛾幼虫是一种地栖昆虫,易受到天敌及土壤中的病原微生物侵袭而导致死亡,如粉棒束孢[4-5]、绿僵菌[6-7]等,寄主昆虫的存活率低下从而限制了冬虫夏草的产量。昆虫在病原侵染后会激活防御系统,如Toll通路、IMD通路及复杂的酚氧化酶原级联系统等[8]。其中,酚氧化酶原级联系统通过包囊[9]、结节及黑化等途径杀灭入侵的寄生物是昆虫普遍的一种免疫机制,在防御病原过程中发挥着关键作用[10]。
酚氧化酶(PO,EC1.14.18.1)又名酪氨酸酶,广泛分布于各种动植物及微生物机体中,是一种含铜的酶,其可将单酚羟化成二酚,再使二酚氧化为醌,醌在非酶促条件下,最终形成黑色素[11]。在昆虫发育过程中,PO以酚氧化酶原(Prophenoloxidase,PPO)的形式存在,PPO通过级联反应系统的酚氧化酶原激活蛋白酶(Prophenoloxidase activating proteinase,PAP),切割、激活为活性的PO,参与昆虫表皮的鞣化、黑化、硬化、伤口愈合等,构成昆虫免疫及防御反应系统[12]。
PPO作为酚氧化酶的前体,在亚洲玉米螟(Ostriniafurnacalis)[13]、冈比亚按蚊(Anophelesgambiae)[14]、烟草天蛾(Manducasexta)[15-17]与家蚕(Bombyxmori)[18]等昆虫的研究中,关于其结构、功能、特性等已有大量报道,对其在免疫防御反应中的作用也进行了广泛研究。而蝙蝠蛾作为冬虫夏草的寄主,其PPO基因的研究还未见相关报道。小金蝠蛾(ThitarodesxiaojinensisTu)是四川省阿坝藏族羌族自治州小金县及周边地区冬虫夏草的主要寄主昆虫[19],生长发育快,人工培育成虫的繁殖能力强,目前正在对这一虫种资源进行人工扩繁。因此,本研究从冬虫夏草寄主小金蝠蛾幼虫中克隆获得其酚氧化酶原基因,对其进行生物信息学分析,检测其组织表达谱,旨在为进一步揭示该基因的功能提供参考,同时为后续探究病原与昆虫互作具有重要意义。
1 材料与方法
1.1 试验材料
小金蝠蛾(Thitarodesxiaojinensis)幼虫由太极集团位于四川康定的冬虫夏草培育基地 提供。
RNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒购自OMEGA公司;HiFi DNA Polymerase、反转录试剂盒购自全式金公司;荧光定量PCR试剂盒购自Roche公司;pMDTM19-T Vector购自TaKaRa;GeneRacerTMKit购自Invitrogen公司;RIPA裂解液购自碧云天生物技术公司;IPTG、X-gal购自生工生物工程(上海)股份有限公司,引物合成、测序由上海生工完成;M.sextaPPO兔多克隆抗体由余小强教授惠赠。
1.2 试验方法
1.2.1 小金蝠蛾幼虫的RNA提取及cDNA合成 取4龄幼虫,分别收集幼虫头部、表皮、脂肪体、中肠、血淋巴等5 种组织,经液氮研磨后,按照RNA提取试剂盒中操作方法进行总RNA提取、浓度测定,经由反转录试剂盒的操作方法合成cDNA第一链,于-80 ℃保存。
1.2.2 小金蝠蛾幼虫PPO基因cDNA序列克隆 通过西南大学家蚕基因组生物学国家重点实验室前期对粉棒束孢侵染蝙蝠蛾幼虫转录组测序结果分析(未发表),发现一条注释为蝙蝠蛾幼虫酚氧化酶原的序列,以此设计引物来克隆蝙蝠蛾幼虫PPO基因cDNA片段,引物具体信息见表1。PCR扩增反应体系(50 μL)如下:正向引物和反向引物各1 μL,cDNA 1 μL,HiFi DNA Polymerase 1 μL,dNTPs(10 mmol/L) 1 μL, 10×Buffer 5 μL,ddH2O 40 μL,PCR反应条件为 95 ℃预变性 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 130 s,循环35 次;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳检测,切胶、回收PCR产物,与pMD19-T Vector于16 ℃连接过夜,转化至EscherichiacoliDH5α感受态细胞,涂布在含氨苄青霉素/IPTG/X-gal的LB平板,37 ℃过夜培养。从平板上挑选白色菌落培养,以菌液为模板,采用上述PCR程序鉴定,阳性克隆送至生工生物工程(上海)股份有限公司完成测序鉴定。
根据上述克隆所得的序列设计特异性引物3′-GSP-1,引物序列见表1。按照GeneRacerTMKit试剂盒说明书(InvitrogenTMLife technologies)进行3′RACE的PCR扩增。PCR产物的分离、纯化、连接、转化及测序均同上述操作。
1.2.3 生物信息学分析 采用NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析基因的预测读码框;使用ProtParam软件(http://us.expasy.org/tools/protparam.html)计算蛋白质的分子质量及等电点;信号肽预测用SignalPV 4.1(http://www.cbs.dtu.dk/services/SignalP/);通过NCBI上的Blastp(http://www.ncbi.nlm.nih.gov/blastp)及ClustalW进行TxPPO与其他物种PPO的同源性分析及多重序列比对;利用MEGA 7软件完成系统发育树的构建,并进行1 000次Bootstrap检验重复;采用MEME-CHIP分析蛋白的基序(Motif)结构(http://meme.nbcr.net/meme/intro.html);采用NCBI-CDD对目的蛋白保守结构域分析(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)。
1.2.4 荧光定量PCR 根据TxPPO基因 cDNA的ORF序列,利用引物设计软件Primer5.0设计特异引物,以蝙蝠蛾GAPDH作为内参基因(GenBank登录号为ANS59104.1),PPO和GAPDH基因引物序列见表1。以各组织的 cDNA为模板,通过荧光定量PCR技术,利用2-△Ct方法分析该基因在不同组织中mRNA的表达差异,△Ct=Ct(目的基因)-Ct(内参基因),调查TxPPO基因在小金蝠蛾幼虫各组织中的转录表达情况。
1.2.5 免疫印迹分析(Western blot) 取小金蝠蛾幼虫数头并解剖,得到头、脂肪体、中肠、表皮、血淋巴5 种组织,液氮研磨为粉末,然后添加适量RIPA裂解液,冰浴30 min,12 000 r/min, 4 ℃离心15 min,取上清即总蛋白,进行SDS-PAGE电泳,将蛋白转至PVDF膜,50 g/L脱脂奶粉溶液封闭,将膜置于含M.sextaPPO抗体 (1∶500)的封闭液中4 ℃孵育过夜,用TBS-Tween(0.05%)洗膜3 次,每次10 min,然后将膜转入含有羊抗兔二抗(1∶8 000)的封闭液中,室温轻摇1 h,洗膜3 次,膜置于ECL系统中,覆盖ECL显影液进行底物显色曝光。

表1 小金蝠蛾幼虫PPO基因克隆及荧光定量PCR引物Table 1 Primers used for PCR amplification and real-time PCR
2 结果与分析
2.1 小金蝠蛾幼虫酚氧化酶原基因cDNA序列克隆
对小金蝠蛾幼虫总RNA提取后进行电泳检测,结果如图1-A,后以RNA反转录得到的cDNA第一链为模板,利用PPO-F1/ PPO-R1引物经PCR扩增,获得与预期产物大小(约2 200 bp)一致的条带,测序、鉴定获得TxPPO的CDS全长序列及5′UTR部分序列(图1-B)。接着,以 3′RACE引物与3′GSP引物进行3′RACE扩增,获得一个约为750 bp的条带,经测序鉴定为TxPPO 部分编码序列和3′UTR序列(图1-C)。通过RT-PCR和3′RACE序列拼接,获得小金蝠蛾幼虫PPO基因序列,长度为2 654 bp,具体序列信息已上传到NCBI(GenBank:MK069990)。
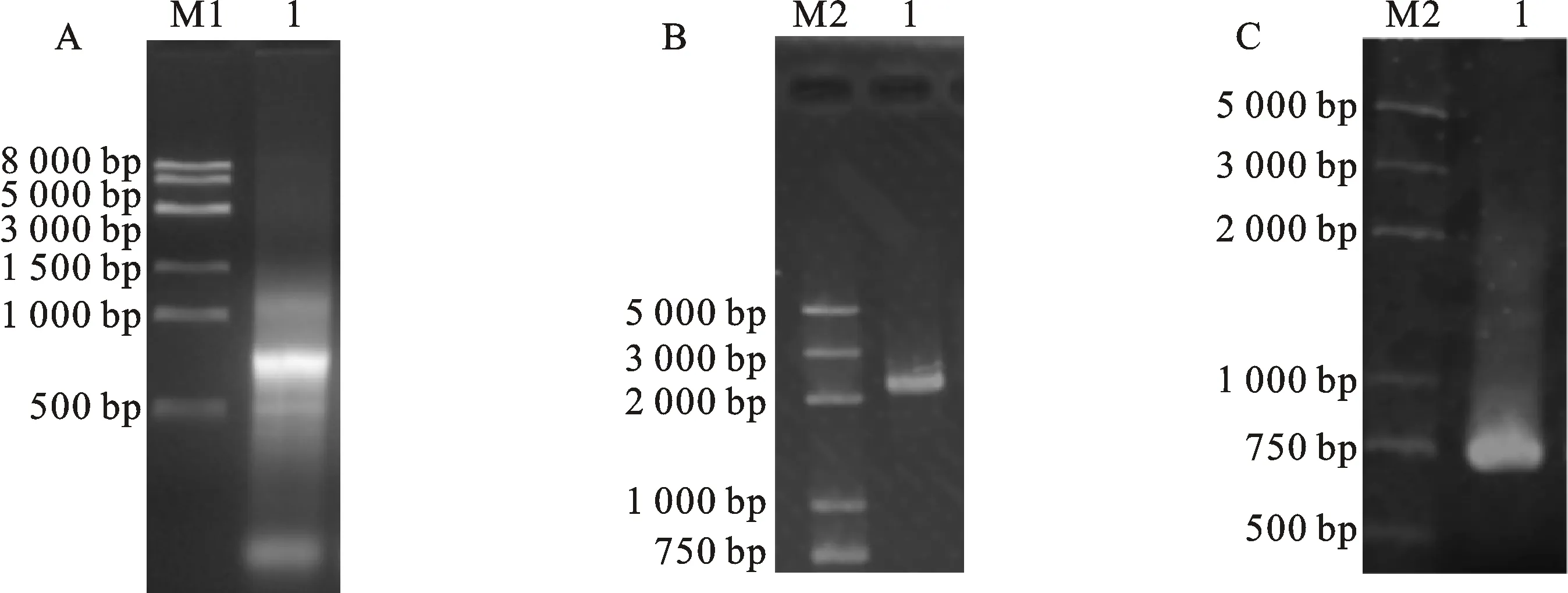
A. 总RNA电泳检测 Detection of total RNA;B. RT-PCR扩增 RT-PCR amplification;C. 3′RACE扩增 3′RACE amplification;M1.DNA分子量标准Trans8K DNA marker DNA marker Trans8K DNA marker;M2.DNA分子量标准2kPlus DNA marker 2kPlus;图A中1为小金蝠蛾总RNA Total RNA;图B中1为cDNA的扩增产物 Product of cDNA amplification;图C中1为 3′RACE扩增产物 Product of 3′RACE amplification
图1 小金蝠蛾酚氧化酶原基因克隆
Fig.1 Molecular cloning ofTxPPOgene
2.2 小金蝠蛾幼虫PPO基因生物信息学分析
通过NCBI ORF Finder对克隆所得的TxPPO进行开放阅读框分析,发现一个2 070 bp的开放阅读框,其位置在84~2 153 bp,编码一个由689 个氨基酸残基组成的蛋白质,经预测,该蛋白质分子质量约为79.31 ku,理论等电点 pI=5.91。该预测蛋白具有与其他鳞翅目昆虫PPO相似的丝氨酸蛋白酶酶切位点,处于N端第51和52位氨基酸残基之间(即PPO激活位点),切割后,产生一个分子质量为73.50 ku的活性酶。此外,该蛋白质含有2 个高度保守的铜离子结合位点,分别位于202~245、346~413处,有1个thiolester-like位点,位于582~589处(图2)。
在NCBI数据库中下载其他昆虫PPO氨基酸序列,采用MEGA 7软件构建系统发育树(图3-A)。结果表明,小金蝠蛾幼虫PPO与S.serrataPPO亲缘关系相距较远,同源性较低,但和其他鳞翅目昆虫酚氧化酶原-2(PPO2)聚为一支,尤其是与云杉芽卷蛾(Choristoneurafumiferana) PPO2、草地贪夜蛾(Spodopterafrugiperda) PPO2、甜菜夜蛾(Spodopteraexigua)PPO、大蜡螟(Galleriamellonella)PPO2及棉铃虫(Helicoverpaarmigera)PPO2同源性较高,相似度分别为63.61%、63.03%、62.59%、 62.50%、62.45%。通过将TxPPO蛋白与其他昆虫PPO蛋白的结构域进行比对分析,发现TxPPO蛋白具有与其他昆虫一致的3个保守结构域,即Hemocyanin-N/M/C(图3-B)。同时,运用ClustalW软件对与小金蝠蛾幼虫PPO相距较近的其他昆虫PPO进行保守结构域的多重序列比对,发现Hemocyanin-M结构域中CuA及CuB两个铜结合位点的氨基酸序列及其内部的6 个组氨酸残基均高度保守(图4)。此外,利用MEME-CHIP工具分析了上述下载的PPO蛋白序列的基序组成,共预测出20 个Motif(表2),结果表明,在同一个目内,大多数成员的Motif组成基本相同,不同目内Motif组成有一定差异。TxPPO蛋白的Motif分布模式与亚洲玉米螟、烟草天蛾、家蚕等昆虫的PPO2高度相似,基序组成也比较保守,但与锯缘青蟹(Scyllaserrata)的PPO亲缘关系相距较远,基序组成的保守程度较低(图3-C)。

图中箭头表示推测的Tx-PPO激活位点,下划线标示的是两个铜离子结合位点,矩形框表示thiolester-like位点 Arrow showed a predicted cleavage site for proteolytic activation of the TxPPO; two copper binding sites were underlined; thiolester-like site was boxed
图2 小金蝠蛾PPO基因cDNA推导的氨基酸序列
Fig.2 cDNA sequence and deduced amino sequence ofPPOgene ofThitarodesxiaojinensis
2.3 小金蝠蛾幼虫TxPPO基因表达分析
通过荧光定量PCR分析TxPPO基因在小金蝠蛾幼虫多个组织中的mRNA表达情况,结果如图5-A所示,TxPPO基因在所检测幼虫的各个组织中呈差异表达,血淋巴中检测到最高的转录水平,在中肠中检测到最低的转录表达,且血细胞中mRNA表达水平分别相对于头部、脂肪体、表皮、中肠中转录表达的719 倍、1 144 倍、 2 772倍、15 852倍。
2.4 小金蝠蛾幼虫PPO蛋白分布
通过对小金蝠蛾幼虫多个组织的总蛋白提取,后分别将总蛋白通过SDS-PAGE进行分离(图5-B),Western blot分析TxPPO在幼虫上述不同组织中的蛋白水平分布情况,结果显示,TxPPO主要在血淋巴和头部分布,在表皮和中肠组织中也有分布,而在脂肪体中仅检测到微弱的条带(如图5-C)。
3 讨 论
酚氧化酶原(PPO)是一种含铜金属酶,通常以无活性形式存在昆虫体内,主要通过特异性丝氨酸蛋白酶的级联反应活化为酚氧化酶(PO)[20]。各个物种的PPO基因有不同数量的亚型,多至10 个,但鳞翅目昆虫如家蚕、烟草天蛾、小菜蛾(Plutellaxylostella)、大蜡螟的PPO都有2 个亚型,即PPO1和PPO2[18,21-24]。同源性分析表明,本研究克隆的蝙蝠蛾幼虫PPO基因可能为PPO2。在蝙蝠蛾幼虫中是否也存在PPO1基因,还有待进一步研究。
在PPO基因组织表达方面,PPO主要表达于昆虫的血细胞、血浆中。有研究报道,冈比亚按蚊的中肠、斯氏按蚊(Anophelesstephensi)的脂肪体及亚洲玉米螟的体壁中都有PPO的分布,但在亚洲玉米螟(O.furnacalis)的脂肪体和体壁中未检测到PPO基因转录水平的表达[14,25-26]。通过对蝗虫(Locustamigratoria)、棉铃虫、亚洲玉米螟等昆虫研究发现,PPO不但分布于血细胞中,也存在于血浆中;而蟑螂(Periplanetaamericana)的PPO主要存在于血细胞中,家蚕和烟草天蛾的PPO多存在于血浆中[27-29]。此外,家蚕PPO1基因仅在家蚕的血液中有表达,而PPO2基因在家蚕所有组织中均有表达,表达量从高至低顺序为血液、头部、中肠、表皮、精巢、卵巢和脂肪体[30]。本研究结果发现,蝙蝠蛾幼虫PPO基因主要在血淋巴转录表达,在头、脂肪体、表皮及中肠组织中也都有少量mRNA水平的表达,但在蛋白分布方面,蝙蝠蛾幼虫PPO主要在头、血淋巴中分布,在表皮和中肠组织中也检测到其分布,但丰度比头部及血淋巴中要低,而在脂肪体中蛋白分布最少,仅检测到微弱的条带。因此,本研究为进一步解析PPO基因在蝙蝠蛾幼虫免疫反应特别是黑化包被病原过程中的作用奠定基础,也为后续研究冬虫夏草菌在蝙蝠蛾幼虫体内长期增殖的互作机理提供参考。
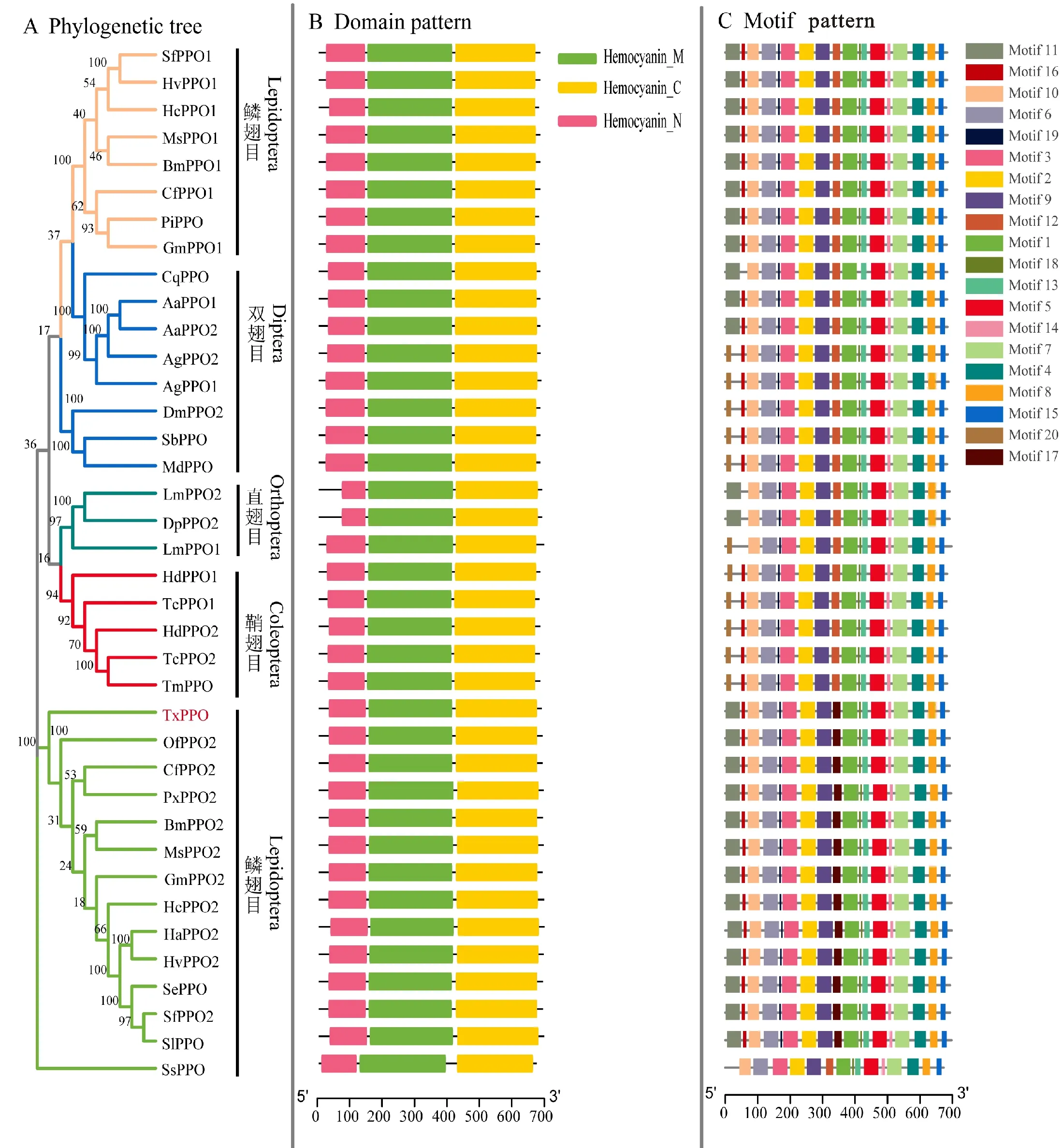
A.系统发育树 Phylogenetic tree;B.PPO蛋白保守结构域 Conserved domains of PPO proteins;C.小金蝠蛾幼虫及其他昆虫PPO蛋白的保守基序分析(不同基序分别由20 个不同颜色的盒子表示,Motif具体序列见表2 Comparison of the conserved motifs ofThitarodesxiaojinensisPPO with those of other insects (The motifs,numbers 1-20,are displayed in different colored boxes. The sequence information for each motif is provided in Table 2.其他物种昆虫PPO蛋白登录号如下 PPO sequences of other insects are deposited in GenBank:Aedesaegypti(AaPPO1:AAG02219; AaPPO2:AAG02218),Anophelesgambiae(AgPPO1: AAB94671; AgPPO2: AAB94672),Bombyxmori(BmPPO1:AAG09304; BmPPO2:AAG09303),Choristoneurafumiferana(CfPPO1: ABW16859; CfPPO2:ABW16862),Culexquinquefasciatus(CqPPO:EDS44936),Drosophilamelanogaster(DmPPO2:NP610443),Doratiferapinguis(DpPPO2:ACM41728),Galleriamellonella(GmPPO1:AAK64363; GmPPO2:AAQ75026),Scyllaserrata(SsPPO: ABD90511),Helicoverpaarmigera(HaPPO2:AAZ52554),Heliothisvirescens(HvPPO1:ABH10016; HvPPO2: ABM65701),Holotrichiadiomphalia(HdPPO1: BAC15602; HdPPO2: BAC15603),Hyphantriacunea(HcPPO1: AAC34251; HcPPO2:AAC34256),Locustamigratoria(LmPPO1:ACN81830;LmPPO2:ACN81829),Manducasexta(MsPPO1: AAC05796;MsPPO2: AAC37243),Muscadomestica(MdPPO:AAR84669),Ostriniafurnacalis(OfPPO2: ABC59699),Plodiainterpunctella(PiPPO: AAU29555),Plutellaxylostella(PxPPO2:ACS36209),Spodopteraexigua(SePPO: ABS59653),Spodopterafrugiperda(SfPPO1: ABB92834; SfPPO2:ABB92835),Spodopteralitura(SlPPO: AAW22859),Tenebriomolitor(TmPPO: BAA75470),Triboliumcastaneum(TcPPO1: AAX84204; TcPPO2: AAX84205),Sarcophagabullata(SbPPO:AAD45526)
图3 基于PPO氨基酸序列相似性构建系统发育树及PPO蛋白保守结构域和保守基序分析
Fig.3 Construction of phylogenetic tree and analysis on conserved protein domains and motifs in insect PPO

3个保守结构域分别为Hemocyanin-N/M/C,CuA及CuB代表两个铜结合位点,红色的“*”表示铜结合位点内的6个保守组氨酸残基 Three conserved domains are Hemocyanin-N/M/C,respectively. The two copper binding sites are CuA and CuB,and red asterisks “*” mark six conserved histidine residues.

图4 PPO蛋白的3个保守结构域氨基酸序列的多重序列比对Fig.4 Multiple sequence alignment of the three conserved domains of PPO proteins
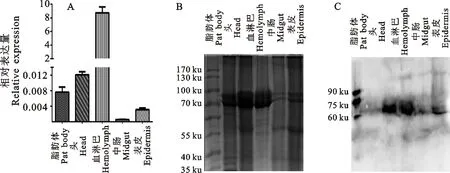
A.荧光定量PCR Real-time quantitative PCR analysis of TxPPO transcripts;B.蝙蝠蛾幼虫各组织总蛋白SDS-PAGE分析 SDS-PAGE analysis of total protein inT.xiaojinensis; C.Western Blot
图5 小金蝠蛾幼虫TxPPO基因的组织表达谱
Fig.5 Tissue expression analysis ofTxPPOgene fromThitarodesxiaojinensis

