拟南芥 AtNHX5基因启动子的克隆和组织定位分析
李静雯,厚毅清,陈 军,朱天地
(甘肃省农业科学院 生物技术研究所,兰州 730070)
维持胞内离子和pH稳态对细胞的活动和功能至关重要[1-2]。已有研究表明,植物Na+、 K+/H+反向转运体(NHX)对维持细胞内离子平衡和调节pH平衡具有重要作用,并在各种细胞过程中扮演重要角色,包括逆境响应、膜微囊运输、蛋白存贮、细胞生长、渗透调节、Na+和 K+离子运输及生长与发育等生理生化过程[3-7]。NHX是一类跨膜反向转运蛋白,属于一价阳离子/H+反向转运体(cation/proton antiporter,CPA)基因家族中的CPA1亚家族,生化活性是将Na+或K+与质子(H+)进行跨膜反向转运,在酵母、细菌、植物和动物等生物体内广泛存在[8-9]。
植物NHX基因家族分为三类,即质膜NHXs,液胞NHXs和内膜NHXs。模式植物拟南芥中NHX基因家族包含8个成员,其中质膜NHXs(AtNHX7/SOS1、AtNHX8)、液胞NHXs(AtNHX1-4)研究的相对较早,且对AtNHX7/SOS1的调节机制研究最为清楚[10-15]。拟南芥内膜AtNHX5和AtNHX6基因编码的反向转运体定位在高尔基、反面高尔基体管网状结构(TGN)、内质网(ER)和液胞前体(PVC)[4,16-17]。有研究表明,AtNHX5既能抑制酵母突变体nhx1对潮霉素和盐胁迫的敏感性,又能增加对Li+的耐受性,在拟南芥中内膜NHXs调节胞内和内膜系统内的pH及离子平衡[16],影响囊泡运输和蛋白存贮[18-20],并通过调节生长素影响植株生长和发育[3-4],这些结果说明,与拟南芥质膜和液胞NHXs而言,内膜NHXs具有独立功能,是NHX家族的重要组成部分。目前对拟南芥AtNHX5的亚细胞定位、功能已进行初步研究,但对其启动子及组织表达模式的研究较少,基于此,本研究克隆AtNHX5基因启动子并进行序列分析,通过农杆菌介导的花序浸染法转化拟南芥,并利用GUS染色检测研究AtNHX5基因在植株不同组织中的表达特性。 以期探明AtNHX5在拟南芥幼苗和成株各组织内的表达强弱情况,为进一步探寻AtNHX5在离子转运和pH调节中的作用和调控机制提供依据。
1 材料与方法
1.1 植物材料及生长条件
野生型拟南芥(Arabidopsisthaliana)为Col-0 。所用植物材料生长室温21 ℃,光强100 μmol/(m2·s),光周期为16 h/8 h(光照/黑暗),相对湿度50 %± 10 %。无菌材料培养,先用φ=20 %的次氯酸钠将种子表面消毒13 min,再用无菌蒸馏水漂洗6次,然后点种在含有10 g/L琼脂,pH 5.8的MS固体培养基中,置于4 ℃冷藏箱中暗处春化3 d后转入温室萌发生长。需完成整个生长周期的材料,在萌发生长7 d后移入营养土内,置于温室内培养。
1.2 菌株、载体
所用大肠杆菌DH5α和农杆菌GV3101,均由甘肃省农业科学院生物技术研究所遗传工程实验室保存提供。所用植物表达载体为pCAMBIA1391。
1.3 引 物
试验所用各引物序列见表1,引物序列利用软件Primer Premier 5设计。

表1 试验所用引物序列Table 1 Primers used in experiment
注:引物PRNHX5-F和PRNH5-R下划线序列分别为SalⅠ和EcoRⅠ酶切位点。
Note:Underline sequences of PRNHX5-F and PRNH5-R wereSalⅠ andEcoRⅠrestricyion sites,respectively.
1.4 DNA提取及 AtNHX5基因启动子克隆
以野生型拟南芥Col-0为材料,用生工植物基因组提取试剂盒从中提取拟南芥基因组DNA。根据TAIR网站公布的拟南芥基因组数据,选取AtNHX5基因开放阅读框(ORF)上游1 807 bp启动子序列,运用引物设计软件Primer Premier 5设计特异性引物PRNHX5-F和PRNHX5-R,并根据表达载体和启动子序列内酶切位点在引物5′端分别添加SalⅠ和EcoRⅠ酶切位点及保护碱基,引物序列由华大基因公司合成。以获得的拟南芥基因组DNA为模板,用高保真酶进行PCR扩增,扩增后的PCR产物经10 g/L琼脂糖凝胶电泳检测后切胶回收并纯化。
1.5 AtNHX5基因启动子序列分析
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件对AtNHX5基因转录起始位点前1 807 bp的启动子序列进行分析,预测顺式作用元件。
1.6 载体构建及植株转化、筛选
用NEB的SalⅠ和EcoRⅠ限制性内切酶分别双酶切表达载体pCAMBIA1391质粒和PCR产物,并回收目的片段。利用promage公司T4连接酶将回收的PCR目的产物构建到表达载体pCAMBIA1391上并转入大肠杆菌扩增,获得GUS(β-半乳糖苷酶)表达载体pCAMBIA1391-proNHX5-GUS。经PCR扩增、酶切及测序鉴定正确的表达载体转入农杆菌GV3101。农杆菌在YEP固体培养基培养,YEP培养基成分为: 5 g/L牛肉膏,1 g/L酵母提取物,5 g/L蛋白胨,5 g/L蔗糖,4 g/L MgSO4·7H2O,15 g/L琼脂,pH 7.4。通过PCR鉴定获得转入成功的农杆菌菌株,并通过花序浸染法转染到野生型拟南芥中[21]。转基因材料在含有50 mg/L的潮霉素(Hygromycin B)的MS培养板上进行筛选,选用启动子测序所用正向引物C-PRNHX5-F2和GUS基因内特异反向引物GUS-R对抗性筛选获得株系进行PCR鉴定,以便确定所选株系中存在融合目的基因序列。获得的第3代转基因植株的3个独立的纯合体株系用于GUS染色分析。
1.7 GUS染色分析
选用生长在MS培养基上的整株幼苗和盆栽成熟植株的不同组织进行GUS组织化学检测分析。选取的材料浸透在染色液(100 mmol/L 磷酸缓冲液, pH 7.0,1.9 mmol/L 5-溴-4-氯-3-吲哚-β-D-葡萄糖苷酸, 0.5 mmol/L 铁氰化钾, 0.5 mmol/L亚铁氰化钾,φ=0.1% Triton X-100,10 mmol/L EDTA 和φ=20 %甲醇)中,于37 ℃过夜染色后去掉染色液,加入φ=70 %乙醇用于脱去叶绿素。去净叶绿素的材料在体视显微镜下观察照相。
2 结果与分析
2.1 拟南芥 AtNHX5基因启动子的克隆及顺式作用元件分析
根据已知拟南芥基因组序列信息,设计带有特异酶切位点和保护碱基的引物,正向扩增引物PRNHX5-F含有SalⅠ酶切位点,反向扩增引物PRNHX5-R含有EcoRⅠ酶切位点,以拟南芥Col-0基因组DNA为模板,采用高保真酶进行PCR扩增,PCR产物大小为1 825 bp。将扩增产物进行核酸电泳检测,结果表明扩增条带符合预期大小(图1)。
对proNHX5分析发现,序列中除了包含启动子典型的核心元件TATA-box和CAAT-box等外,还包含AE-box、Box 4、GA-motif、GT1-motif、TCT-motif光响应元件;ABA响应元件ABRE;茉莉酸甲酯响应元件CGTGA-motif和TGACG-motif;生长素响应元件TGA-element;分生组织表达调控元件CAT-box;厌氧诱导的必须调控元件ARE和防御与应激相关元件TC-rich repeats(表2)。

M.DNA marker D2000; proNHX5.AtNHX5启动子序列AtNHX5promoter sequence
图1AtNHX5基因启动子的克隆
Fig.1 Clone ofAtNHX5gene promoter

表2 AtNHX5启动子区域顺式作用元件预测Table 2 Prediction of cis-acting elements in promoter of AtNHX5
2.2 pCAMBIA1391-proNHX5-GUS启动子表达载体的构建及鉴定
如图2-A,为了研究AtNHX5基因启动子的活性和组织表达模式,将启动子扩增产物proNHX5和植物表达载体pCAMBIA1391分别用NEB的SalⅠ和EcoRⅠ双酶切后连接,经菌落PCR和质粒酶切验证获得正确的重组质粒pCAMBIA1391-proNHX5-GUS。DH5α菌落PCR扩增产物大小为1 825 bp,与预期结果相一致(图2-B)。由于在构建中连接部位为SalⅠ和EcoRⅠ酶切位点,重组成功的质粒单酶切后电泳应有一条大小为12 454 bp的目的条带,而双酶切后电泳应有一条大小分别为10 641 bp的线性质粒条带和一条1 813 bp与proNHX5几乎一致的序列条带,酶切试验结果符合预期,说明AtNHX5启动子成功克隆到pCAMBIA1391载体中(图2-C)。通过进一步测序验证,证实测序序列结果与数据库序列一致。
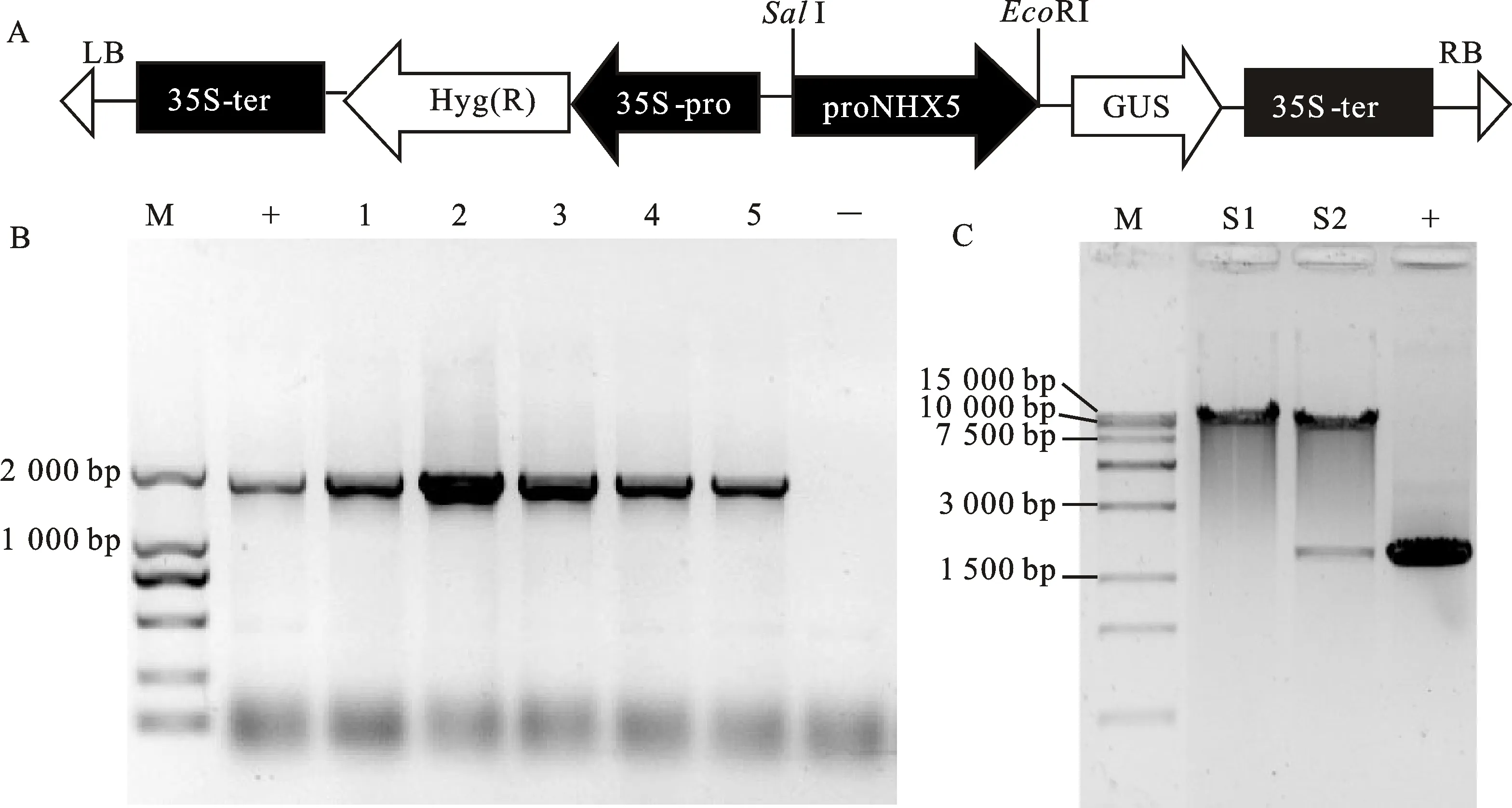
A:pCAMBIA1391-proNHX5-GUS表达载体构建示意图 Map of construction of pCAMBIA1391-proNHX5-GUS expression vector;B:pCAMBIA1391-proNHX5-GUS表达载体的PCR分析 PCR analysis of pCAMBIA1391-proNHX5-GUS vector;M.DNA marker D2000;+.proNHX5启动子序列AtNHX5promoter sequence; 1~5.载体转化大肠杆菌菌液PCR产物 PCR product of fusion expression vector transformed intoE.coliDH5α;-.阴性对照 Negative control;C:pCAMBIA1391-proNHX5-GUS表达载体酶切鉴定 Identification of promoter analysis vector pCAMBIA1391-proNHX5-GUS by digestion;M.DNA marker D15000;S1.EcoRI单酶切 Single-digestion products byEcoRI;S2.SalI和EcoRI双酶切 Double-digestion products byEcoRI andSalⅠ;+.proNHX5启动子序列AtNHX5promoter sequence
图2AtNHX5启动子载体构建
Fig.2 Vector construction ofAtNHX5promoter
2.3 拟南芥转基因植株的获得
将测序正确的重组质粒转化农杆菌GV3101,在含有Rif和Kan抗生素的YEP固体培养基上筛选,挑取单菌落,通过菌落PCR筛选,能够扩增出与proNHX5启动子克隆序列大小一致的条带为成功导入表达载体的阳性菌株 (图3)。获得的阳性农杆菌通过花序浸染法转化拟南芥Col-0,将得到的T0代种子经消毒后播种于含有潮霉素的MS培养基中进行筛选,具有抗性的植株经PCR检测为阳性的单株收获种子并加代,获得T3代纯合转基因株系(图4)。
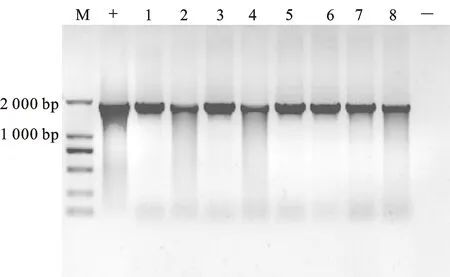
M.DNA marker D2000;+.阳性对照 Positive control;1~8.载体转化农杆菌菌液PCR产物 PCR product of expression vector transformed intoE.coliDH5α; -.阴性对照 Negative control
图3 农杆菌菌液PCR鉴定
Fig.3 PCR detection of agrobacterium tumefaciens
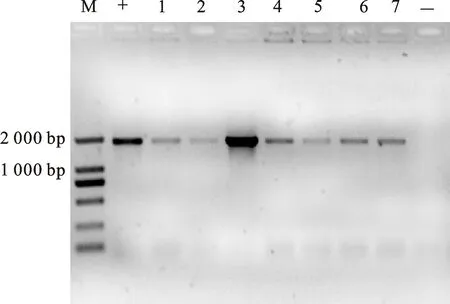
M.DNA marker D2000;+.阳性质粒对照 Positive control; 1~7.转基因植株 Transgenic fusionArabidopsis; -.野生型对照 Wild type
图4 转基因拟南芥植株的PCR
Fig.4 PCR analysis of transgenicArabidopsis
2.4 AtNHX5启动子在拟南芥中的表达分析
为检测基因的组织表达模式,分别选取培养基上萌发生长1 d、2 d、3 d、6 d、9 d、12 d的整株转基因拟南芥幼苗和盆栽生长45 d植株的茎、叶、花和果荚进行GUS组织化学染色。试验证明,3个独立的纯合转基因株系有着相似的表达模式。结果显示,由AtNHX5基因的启动子控制的GUS表达活性,在植株整个发育过程中一直都有表达(图5和图6)。萌发1 d到3 d的幼苗中,GUS活性在子叶和下胚轴中广泛表达,而种皮和胚根中未见表达(图5-A-图5-C)。随着幼苗生长,子叶和茎中GUS仍广泛表达,且子叶和茎中微管系统的GUS表达最为显著,真叶中仅局部检测到GUS表达,生长6 d、9 d和12 d 的转基因植株根中也只有局部区域检测到微弱GUS表达(图5-D-图5-F)。成熟植株中,茎中有明显的GUS表达(图6-A和图6-D)。在成熟叶片中,有的检测不到GUS的表达,有的仅叶尖局部检测到GUS表达(图6-B)。在花中,柱头、花柱、花柄和花瓣的微管中检测到GUS明显表达,花瓣部分区域微弱表达,而在花序顶端花苞未见GUS表达(图6-D)。在未成熟果荚中,GUS主要表达在果柄、果荚顶端和基部,早期幼嫩果荚表皮也有弱的表达,随着果荚发育,果荚表皮将检测不到GUS表达(图6-C和图6-D)。接近成熟果荚中,只有果柄有很微弱的GUS表达,果荚顶端和基部未见GUS表达(图6-C)。
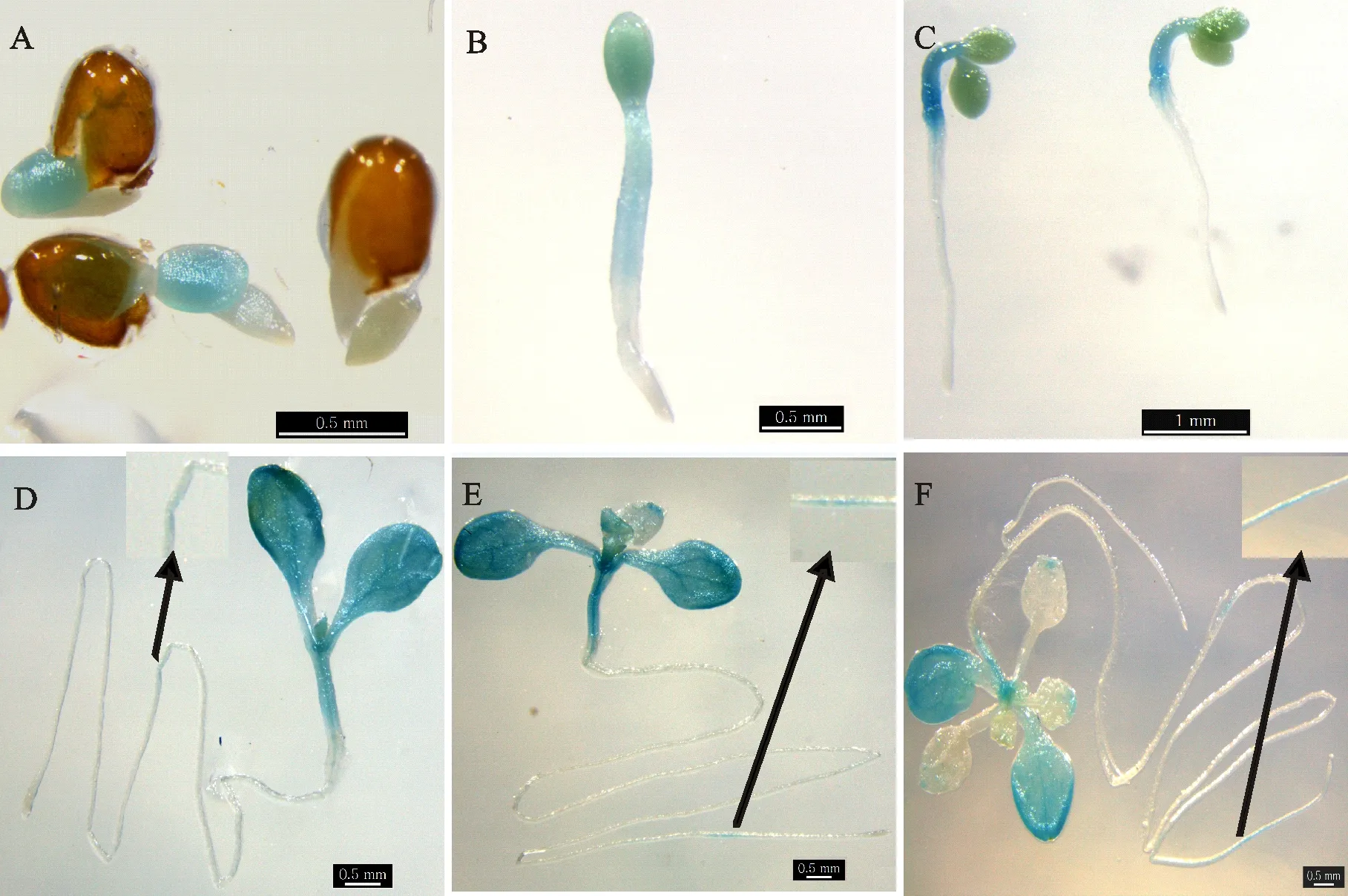
A~F.生长1 d、2 d、3 d、6 d、9 d、12 d的转基因植株 Arabidopsis seedlings of 1 d 2 d,3 d,6 d,9 d,12 d
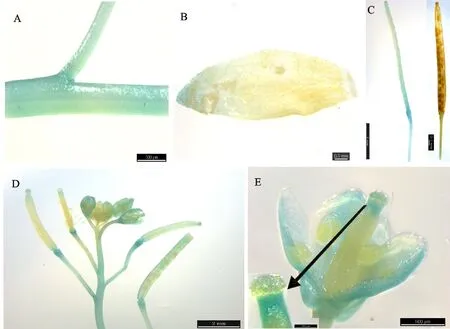
A.茎 Stem;B.叶 Leaf;C.果荚 Silique;D.花序与果荚 Inflorescences and sulique;E.花 Flower
3 讨 论
植物基因表达调控过程主要有DNA水平调控、染色体水平调控、转录调控、转录后调控、翻译调控和翻译后调控,在这些调控方式中,转录水平调控是最为主要的。启动子是位于结构基因上游的DNA序列,不仅决定基因转录方向和RNA聚合酶类型,还是转录水平上基因表达调控的中心[22]。在启动子区域,有很多在转录水平调控过程中具有重要作用的顺式作用元件,参与调控下游基因表达,从而调节生长发育和抵抗外界环境胁迫[23]。在启动子的核心启动子区域通常包含TATA-box和CAAT-box元件,也是启动子的特征序列。通过对AtNHX5基因开放阅读框上游序列分析,发现该序列中具有多个TATA-box和CAAT-box核心启动子元件,说明其具有典型启动子特征。
启动子除了具有典型的核心启动子元件外,还有众多与基因功能相关的调节元件或结合位点。因此,在相近基因的启动子序列中,应该存在很多一致的顺式作用元件。李红婷等[24]克隆分析醋栗番茄NHX4基因启动子发现,在启动子序列内含有多个与激素、逆境诱导相关元件和光反应相关元件。邹兰等[25]克隆的盐生草HgNHX1基因启动子中包含多个与非生物胁迫、植物激素诱导及光应答元件。本研究也得到类似结果,在AtNHX5基因启动子序列内发现多个光响应元件和激素、逆境诱导相关元件,另外,还发现分生组织表达调控元件(表2)。这些结果预示着AtNHX5基因的表达可能受到逆境胁迫、激素及光等信号的调控。有研究表明,AtNHX5作为重要的内膜Na+,K+/H+反向转运体,在应对盐胁迫、水分胁迫和钾营养代谢中具有重要作用[16,26-28],同时,最新研究显示拟南芥内膜反向转运体参与生长素介导的生长与发育[3-4],这都与启动子分析结果中的调节元件功能相一致,也预示着AtNHX5很可能在光响应、分生组织表达和茉莉酸调控中的作用还未被发现,值得进一步研究。
利用农杆菌介导法转化拟南芥,对获得的纯合体株系进行GUS组织化学染色,发现proNHX5正确启动GUS基因表达,说明克隆的proNHX5序列具有启动子活性。Bassil等[17]用荧光实时定量PCR(RT-qPCR)分析表明,AtNHX5和AtNHX6基因在拟南芥生长发育的各个阶段的很多组织内均有表达,包括花、花芽、茎、莲座叶、根和果荚,且不同组织存在表达差异,有报道对AtNHX6基因启动子进行分析,也得到类似结果[29]。本研究通过对幼苗期不同生长时间的植株GUS染色发现,proNHX5不仅正确启动GUS基因表达,而且使GUS在不同生长时间幼苗各个部位的表达强弱存在差异。在幼苗期,子叶和茎中从萌发第1天开始就有GUS表达,而根中早期并未检测到GUS表达,直到生长到的第6天,根中有些部位才开始检测到GUS表达(图5)。生长6 d、9 d、12 d的幼苗中发现,在茎顶端分生组织处有较强的GUS表达,且在第6天左右真叶开始长出,随着植株生长,真叶中GUS表达区域和强度逐渐变小和减弱,到成株时只在叶尖检测到微弱的GUS表达。前面启动子分析也发现,在proNHX5序列里内有分生组织表达调控元件存在,这正好与GUS在茎顶端分生组织强表达相一致,这也暗示根中出现GUS表达的部位很可能也与分生组织有关。虽然在根尖和侧根中未检测到GUS表达,但有报道显示,与AtNHX5高度同源且功能冗余的内膜反向转运体的另一个成员AtNHX6的启动子在根尖和侧根原基部位驱动GUS强表达[3,29- 30],这可能是导致proNHX5驱动GUS表达在根中一些分生组织极不明显的原因。在成株中,茎中仍具有明显的GUS表达,而花中GUS表达随着生长发育发生变化,花序顶端花中未检测到GUS表达,而发育成熟花中具有明显的GUS表达,尤其雌蕊柱头、花柱和花瓣微管组织中。果荚中GUS也随果荚生长发育表现表达部位和强度差异,随着果荚发育从开始的果柄、果皮、果荚顶端和基部中明显GUS表达到仅在果柄有微弱表达。整个GUS染色结果显示,在拟南芥整个生长过程中,proNHX5驱动的GUS表达具有明显的时空特异性,预示着AtNHX5基因在拟南芥中也具有相同的表达模式,表明AtNHX5在拟南芥生长发育各个阶段都发挥着重要作用。

