小麦再生相关基因 TaDCC1-2B的克隆与功能验证
贾冬冬,王京宏,崔桂宾,张舒梦,张 超,孙风丽,王竹林,奚亚军
(1. 西北农林科技大学 农学院, 陕西杨凌 712100;2. 农业农村部西北地区小麦生物学与遗传育种重点实验室, 陕西杨凌 712100)
现阶段小麦再生效率低,遗传转化相对困难,已经成为制约小麦功能基因组研究的主要障碍之一。高效的组织培养再生体系对于推进运用转基因和基因编辑技术改良小麦品种具有重要意义。植物离体组织培养是一个复杂的无性繁殖过程, 通常包括愈伤组织的诱导和分化再生[1]。离体再生过程受到内外多种因素的影响,来自外部的诱导因子主要有外源激素、环境胁迫(包括氧化胁迫、渗透胁迫等)、培养基生化添加物等[2],而基因型是影响组织培养的重要内部因素,其与再生能力及遗传转化率密切相关[3-4]。因此,挖掘并克隆、转化小麦再生相关基因,不但有助于提高小麦优良基因型的再生能力和小麦组织培养再生率及转化效率,极大地减少组织培养工作量,而且利用来自小麦自身的再生相关基因作为筛选标记,可以获得无抗生素等筛选标记的安全型转基因植株, 有利于转基因小麦的安全性评价和商业化种植, 是一个极具价值的研究方向[5]。
小麦属于异源六倍体作物,遗传组成异常复杂,因此要筛选并克隆出控制小麦组织培养再生的主效基因极其困难。在模式物种拟南芥中已克隆了一些与体细胞胚发生相关基因,主要分为两类:(1)控制胚胎发育特征相关基因主要包括LEC1、LEC2、FUS3、AGL15等[6-12]和WOXs家族基因WOX5、WOX 11、WOX 12等[13-14],以及AP2/ERF型转录因子BBM、EMK、WIND1、ESR1、PLT、ARRS等[15-20];(2)与芽顶端分生组织相关的基因有STM、CLV3、WUS等[21-27]。在其他作物中也有与体外再生和胚胎发育相关的基因报道。Schmidt等[28]在胡萝卜中首次发现调控体细胞向胚性细胞转变的体细胞胚胎发生相关类受体蛋白激酶关键基因SERK;Nishimura等[29]从高再生水稻Kasalath品种成功分离到控制其再生相关的主效基因铁氧还蛋白-亚硝酸还原酶基因(Ferredoxin-nitrite reductase,NiR)。研究表明通过异位表达再生相关基因在某种程度上可以启动体细胞胚胎发生及提高植物再生能力[30-31]。杜邦先锋公司利用磷脂转移酶蛋白基因启动子PLTP和生长素诱导启动子Axig1分别驱动玉米转录因子BBM和WUS2,可使农杆菌侵染后的玉米幼胚快速形成大量体细胞胚,这些体胚可以直接被转化并长成植株而不需要经过愈伤诱导阶段,从而将遗传转化的时间缩短至1个月且不依赖玉米基因型[32],说明启动子和再生基因有效相结合为解决顽拗型植物困难再生的问题提供了一条新的途径。
目前已通过同源克隆技术得到一些与小麦再生相关的候选基因,如小麦体细胞胚胎受体类激酶基因TaSERKs[33]、亚硝酸还原酶基因TaNiR[2]、过氧化氢酶基因TaCATs及TaWOX5[3]等,并对其再生功能进行了初步鉴定。然而,目前克隆得到的小麦再生相关基因均未被确定是控制小麦再生的主效基因。值得注意的是,中国农业科学院作物科学研究所报道其从小麦品系CB037中鉴定出再生相关基因TaCB1,该基因与日本烟草公司PureWheat技术结合可以显著提高小麦再生能力及转化效率,而且TaCB1基因共转化小麦幼胚基本上克服了对小麦基因型的依赖性,但此专利在小麦组织培养实践应用中的实用性及广泛性有待验证。
Zhang等[34]首次在拟南芥自然变异种中发现决定其再生能力的一种新的硫氧还蛋白DCC1。DCC1与线粒体呼吸链中NADH脱氢酶复合体(复合体I)的一个重要亚基CA2直接相互作用,通过对CA2的氧化还原修饰调控复合体I活性,DCC1的突变将导致复合体I的活性降低,诱发线粒体ROS水平增加,而ROS含量的激增将影响芽分生组织形成相关基因WUS、STM、CLV3等的表达,进而抑制芽的再生,因此鉴定出硫氧还蛋白DCC1是决定拟南芥再生能力的关键蛋白[25,35]。本试验以小麦品种‘中国春’为试验材料,采用同源克隆法获得小麦硫氧还蛋白TaDCC1-2B基因的全长序列,对其进行分子生物学特性分析,并利用农杆菌介导法对该基因的功能进行初步鉴定,以期为挖掘小麦再生相关基因和研究再生作用的分子机制奠定基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料及种植条件 试验中用到的拟南芥材料有野生型Columbia-0(Col-0)、拟南芥硫氧还蛋白突变体dcc1 (SALK_051222C),由山东农业大学张宪省课题组馈赠。Col-0和dcc1种子在4 ℃条件春化3 d后点播于基质中,然后将其转移至人工气候室,培养条件为:温度设置为 25 ℃,光周期为16 h光照/8 h黑暗,光照强度为150 μmol·m-2·s-1,相对湿度为70%。基因克隆所用的小麦模板为普通小麦‘中国春’三叶一心期叶片的cDNA。
1.1.2 菌株与载体 试验中所用的大肠杆菌菌株为EscherichiacoliDH5α,根癌农杆菌(Agrobacteriumtumefaciens)菌株为GV3101。载体构建时所用的克隆载体为pLB零背景快速克隆试剂盒提供的克隆载体pLB Vector,用于拟南芥转化的过表达载体为pGreenⅡ-OE。
1.1.3 主要化学试剂与仪器 基因扩增及菌落PCR过程中用到的KOD高保真酶、Taq酶及pLB零背景快速克隆试剂盒、DNA凝胶回收试剂盒、质粒提取试剂盒等购于天根生化科技(北京)有限公司(德国)。限制性内切酶购自Thermo Fisher Scientific公司(马萨诸塞州,美国),一步克隆试剂盒(ClonExpress○RII One Step Cloning Kit)和Magen RNA提取试剂盒分别购自南京诺唯赞生物科技有限公司(南京,中国)和广州美基生物科技有限公司(广州,中国)。RNA反转录及实时荧光定量PCR试剂盒购自Takara公司(日本),引物合成及测序由杨凌天润奥科生物科技有限公司(杨凌,中国)完成。使用QuantStudio○R5 Real-Time PCR仪(Thermo Scientific,马萨诸塞州,美国)进行qRT-PCR扩增。
1.2 方 法
1.2.1TaDCC1基因克隆和表达载体构建 以拟南芥硫氧还蛋白DCC1(AT5G50100)的氨基酸序列为探针在Ensemble Plants小麦数据库(http://plants.ensembl.org/Triticum_aestivum/Info/Index)进行比对,得到3条高度相似且定位在小麦2A、2B、2D长臂上的序列,对应的序列号分别为TraesCS2A01G540200.1、TraesCS2B01G570 600.1 和TraesCS2D01G541900.1。根据小麦3条同源序列的保守区域利用Primer 6.0软件设计扩增同源基因引物。引物序列信息见表1。以‘中国春’cDNA为模板,使用KOD高保真酶进行目的基因序列的PCR扩增。利用DNA凝胶回收试剂盒对PCR产物进行回收后,利用紫外分光光度计检测目的PCR片段浓度,参照pLB零背景快速克隆试剂盒说明计算插入目的片段的使用量,并按照说明书粘性末端连接方法连接载克隆体和目的片段,并将连接产物转化到大肠杆菌感受态DH5α,挑选12个经PCR鉴定条带正确的阳性克隆送至杨凌奥科测序公司进行测序。利用一步克隆试剂盒构建表达载体时登录诺唯赞官网(http://www.vazyme.com)下载引物设计软件 CE Design,根据说明引物设计总原则,选择XhoⅠ和XbaⅠ作为酶切位点,对插入目的片段设计带有载体末端同源序列 + 酶切位点(可保留或删除) + 基因特异性扩增引物序列的上下游引物,以连接成功的克隆载体为模板,扩增插入表达载体的目的片段,并用XhoⅠ和XbaⅠ对表达载体pGreenⅡ-OE质粒线性化,凝胶电泳检测并回收扩增和酶切产物,按照说明进行重组反应,重组产物转化,利用表达用载体测序引物进行PCR鉴定阳性克隆,将阳性克隆转化农杆菌感受态,进一步PCR鉴定,保存转化成功的农杆菌 菌液。
1.2.2TaDCC1基因的表达量分析TaDCC1基因具有3个序列高度相似的基因拷贝,利用NCBI在线引物设计工具在TaDCC1-2A、TaDCC1-2B和TaDCC1-2D序列保守区域设计引物对(表1),检测3个TaDCC1基因在小麦中的相对表达量;以Actin为小麦内参基因,设计引物Actin-F/Actin-R序列见表1。qRT-PCR体系参照参照TaKaRa定量PCR试剂盒说明书,循环数为40,退火温度为60 ℃,延伸时间35 s。采用2-ΔΔCT法进行基因表达分析,数据以“平均值±标准误”表示,采用ANOVA分析方法进行Duncan’s test测验,并利用GraphPad Prism7软件(加州大学圣地亚哥分校,美国)进行作图。
1.2.3TaDCC1-2B基因编码蛋白的理化性质分析 运用ProtParam(https://web.expasy.org/protparam/)对TaDCC1-2B基因编码蛋白质的理化性质进行分析,利用ExPASyhttp://web.expasy.org/protparam/在线预测蛋白亲水性,利用PredictProtein(https://www.predictprotein.org/home)和SWISS MODEL服务器(http://swissmodel.expasy.org)对蛋白质的二级和三级结构进行预测。以TaDCC1-2B蛋白序列为探针,在NCBI网站搜索不同物种的同源蛋白,利用DNAMAN 6.0(LynnonBiosoft公司,美国)和MEGA 7.0软件(宾夕法尼亚大学,美国)进行蛋白序列的同源性分析和进化分析。系统进化分析采用邻接法 (neighor-joining) 作图, 重复次数设置为1 000。
1.2.4TaDCC1-2B基因启动子区域分析 选取TaDCC1-2B基因起始密码子ATG上游2 000 bp的潜在启动子区域,在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中预测启动子区域顺式作用元件。
1.2.5 农杆菌介导转化拟南芥 在拟南芥突变体dcc1开花初期,将过表达载体转导农杆菌(GV3101)感受态细胞,利用花序蘸染法侵染dcc1花序,将收获的转基因T0代种子种植后用除草剂草铵膦筛选,不受除草剂影响的初步认定为阳性植株,提取其基因组DNA,设计草铵膦Bar基因引物(表1)进行PCR鉴定。
1.2.6 拟南芥根尖诱导芽的再生 芽再生试验参照Li等[36]并稍加修改,将野生型Col-0、突变体dcc1和转基因T3代种子经过70%(V/V)乙醇消毒1 min,8%(V/V)的次氯酸钠涡旋10 min,并用灭菌水冲洗5~8遍,然后用牙签将种子点播在萌发培养基(1/2 MS培养基中添加质量分数为1%蔗糖、0.5 g·L-1MES和质量分数为0.8%琼脂糖,pH 5.8),4 ℃春化3 d后,放置在设置条件为温度22 ℃、光照18 h/黑暗6 h的光照培养箱培养,培养12 d至根长约5~10 mm,切除根尖并转入愈伤组织诱导培养基(CIM,MS培养基中添加质量分数为2%蔗糖、0.5 g·L-1MES 、质量分数为0.8%琼脂糖、0.5 mg·L-12,4-D和 0.05 mg·L-1激动素,pH 5.8),愈伤连续培养15 d后转入再生芽分化培养基(SIM,MS培养基中添加质量分数为2%蔗糖、0.5 g·L-1MES,质量分数为0.8%琼脂糖、0.5 mg·L-12,4-D和0.05 mg·L-12,4-D,pH 5.8),SIM培养基每 6 d更换1次。由于突变体dcc1在SIM培养基培养第20天时才诱导分化出再生芽,选择在分化第25天统计Col-0、dcc1和T3代的芽再生率。分别进行3次生物学重复,每组统计50个愈伤。芽再生率=至少分化出一个芽的愈伤数目/总愈伤数×100%。同时,将此时期Col-0、dcc1和T3的再生芽冻存在-80 ℃冰箱,用于qRT-PCR检测。
1.2.7 实时荧光定量PCR(qRT-PCR)检测 再生芽总RNA的提取使用Magen RNA提取试剂盒,方法参照试剂盒说明书。cDNA第一链的合成方法参照Takara公司的反转录试剂盒说明书。使用QuantStudio○R5 Real-Time PCR实时荧光定量PCR仪进行qRT-PCR扩增。设置3次生物学重复和3次技术重复,PCR反应体系(表2)和反应程序参照TaKaRa定量PCR试剂盒说明书。以WUS(gene ID, At2g17950)作为再生芽标记基因,TUB2(gene ID,At5g62690)为内参基因,设计定量PCR引物(表1),分析TaDCC1-2B基因及WUS基因在野生型、突变体及转基因拟南芥在SIM诱导分化培养第25天的再生芽的表达水平。PCR反应程序:95 ℃ 5 s,95 ℃ 30 s, 60 ℃ 30 s,72 ℃ 10 s,30个循环;95 ℃ 5 s,95 ℃ 15 s,60 ℃ 60 s,72 ℃ 10 s ,40个循环。数据分析同“1.2.2”。

表1 试验所用引物Table 1 Primers used in this study

表2 qRT-PCR反应体系Table 2 The system of qRT-PCR reaction
2 结果与分析
2.1 基因克隆及过表达载体连接凝胶电泳分析
从‘中国春’cDNA中扩增到大小为650 bp左右的条带(图1),对该条带进行胶回收、连接、转化、挑菌、测序后发现同时扩增得到来自小麦2A、2B、2D基因组上的3个同源基因序列,分别命名为TaDCC1-2A、TaDCC1-2B和TaDCC1-2D,其CDS序列全长均为645 bp,三者CDS相似度达到98.40%,氨基酸序列相似度达98.44%,其中TaDCC1-2B的氨基酸序列和TaDCC1-2A、TaDCC1-2D同源性均达到97.20%,TaDCC1-2A的氨基酸序列和TaDCC1-2D同源性达到 96.26%。

M.D2000 Maker;1.目的条带 Target band
对利用一步克隆试剂盒构建的过表达载体进行PCR鉴定,测序引物为表达载体测序引物,扩增得到约为850 bp的条带(图2),符合目的条带大小,表明插入的目的片段和线性化载体连接 成功。
2.2 TaDCC1基因的表达量分析
由图3可知,以‘中国春’三叶一心期叶片的cDNA为模板,检测TaDCC1-2A、TaDCC1-2B、TaDCC1-2D基因在小麦叶片中的表达量,发现三者表达量未表现出显著差异,说明三者在小麦中表达相对稳定。

M.D2000 Maker;1.目的条带 Target band;2.阴性对照 Negative control
图2 PCR鉴定表达载体阳性克隆
Fig.2 PCR identification of positive
clones in expression vector
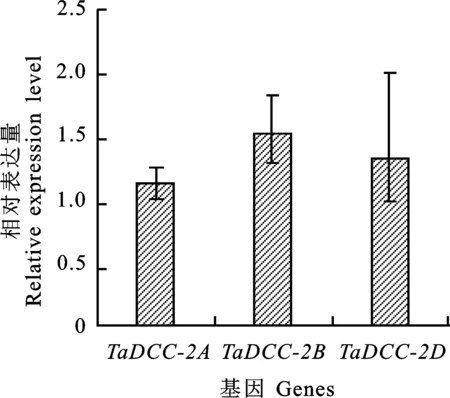
图3 TaDCC1基因表达量分析Fig.3 Expression analysis of TaDCC1 genes
2.3 TaDCC1-2B基因编码蛋白的生物信息学 分析
2.3.1 基本理化性质分析TaDCC1-2B基因开放阅读框全长为645 bp,编码214个氨基酸,ProtParam预测显示所编码的蛋白分子式为C1031H1634N302O307S13,分子质量为23.59 ku,理论等电点(pI)为8.94,脂肪系数71.31,亲水性总平均值-0.409,不稳定系数为56.74(>40),为不稳定蛋白。
2.3.2 蛋白的结构预测 蛋白质二级结构预测工具PredictProtein预测该蛋白二级结构中无规则卷曲占59.35%,螺旋结构有32.24%,片层结构有8.41%,无规则卷曲是其主要结构元件。利用ProtScale对该蛋白进行亲水/疏水性分析,ProtScale Score<0,推测此蛋白是亲水性蛋白(图4)。利用SWISS-MODEL数据库采用同源建模的方法析此蛋白,得到三维结构图(图5)。
2.3.3TaDCC1-2B基因的氨基酸序列多重比对及进化分析 利用DNAMAN6.0将小麦TaDCC1-2A、TaDCC1-2B、TaDCC1-2D蛋白的氨基酸序列与拟南芥(AT5G50100)、粗山羊草(AET2Gv21183600)、乌拉尔图小麦(TRIUR3_12911)、大麦(HORVU2Hr1G118360)、野生二粒小麦(TRIDC2BG082500)、二穗短柄草(BRADI_5g25506v3)、玉米(Zm00001d001910)、水稻(Os04t0668800)的氨基酸序列进行多重比对。结果表明小麦TaDCC1蛋白序列与其他物种序列类似,氨基酸N端列都包含有一个保守的DxxCxxC基序和一个完整的DUF393结构域(图6)。说明DCC1蛋白在不同物种进化过程中具有一定的保守性。
为进一步研究DCC1基因的进化关系,根据小麦TaDCC1基因的氨基酸序列,在NCBI网站比对得到其他物种的DCC1基因的氨基酸序列,与小麦TaDCC1氨基酸序列一起用MEGA7.0构建进化树(图7),可以看出小麦基因TaDCC1-2A与TaDCC1-2B聚为一支,且与乌拉尔图小麦及二粒小麦同源度相对较高;而小麦基因TaDCC1-2D与小麦基因TaDCC1-2A及TaDCC1-2B发生分化,并与粗山羊草聚在一支。这与小麦A基因组来自于乌拉尔图小麦,D染色体组来源于粗山羊草的研究结果相吻合。进化分析表明,普通小麦TaDCC13个基因拷贝和野生二粒小麦、乌拉尔图小麦、粗山羊草在进化上相对保守;而与玉米、水稻、短柄草等单子叶作物属于遗传较远的分支;与拟南芥等双子叶植物遗传距离最远。普通小麦TaDCC13个基因拷贝与亲缘关系近的物种间同源性最高,即使亲缘关系较远的物种间也具有一定的同源性。

横坐标表示编码蛋白的氨基酸位置顺序 The abscissa represents the sequence of amino acid position of coding protein;纵坐标代表亲水性得分 The vertical axis represents the score of hydrophilicity
图4 TaDCC1-2B蛋白的亲水性分析
Fig.4 Hydrophility analysis of TaDCC1-2B protein
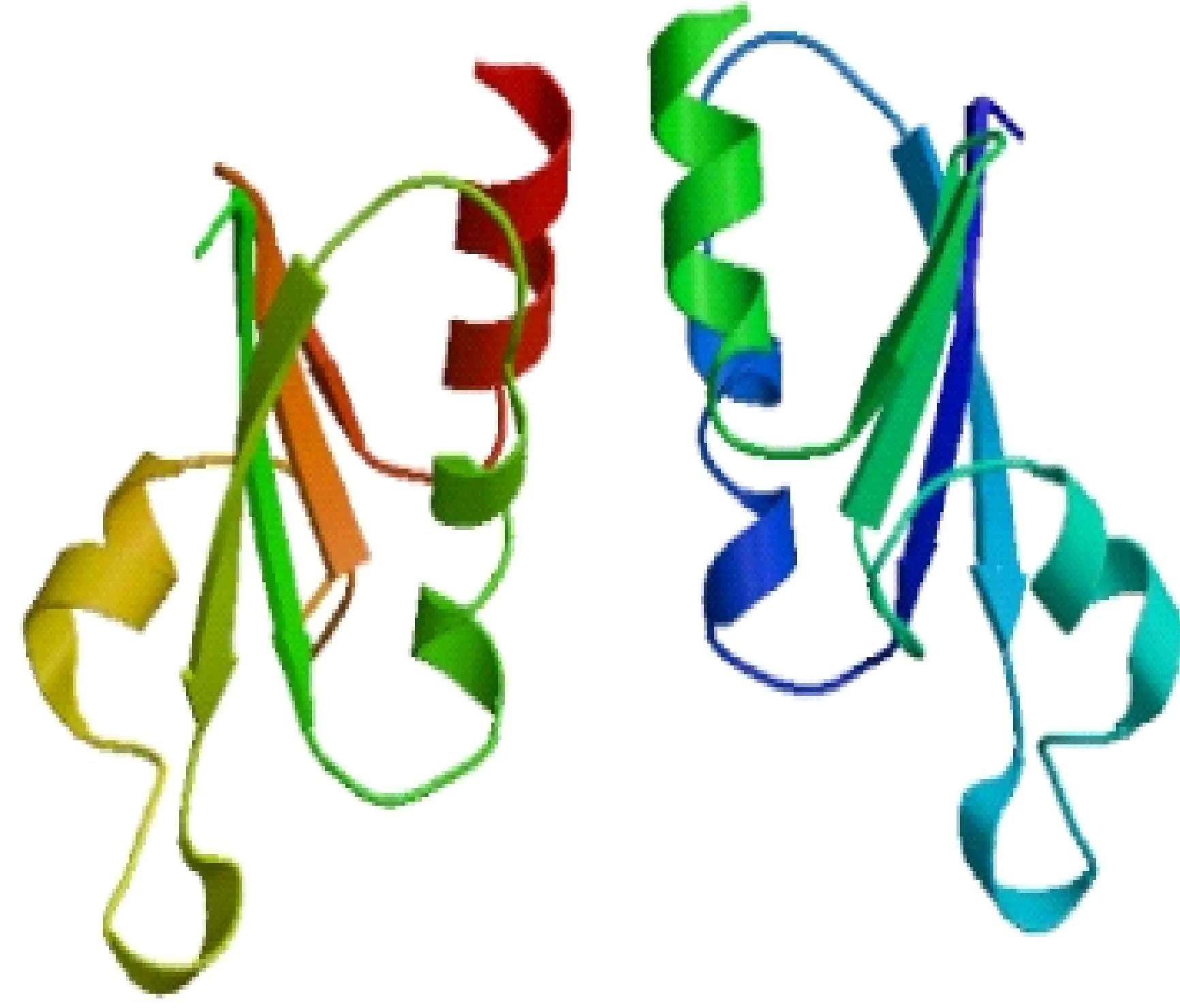
图5 TaDCC1-2B蛋白的三维结构预测Fig.5 Predicted three-dimensional structure of TaDCC1-2B protein

图6 TaDCC1与其他物种同源蛋白的多重序列比对Fig.6 Multi-alignment of TaDCC1 amin oacid sequences with other DCC1s
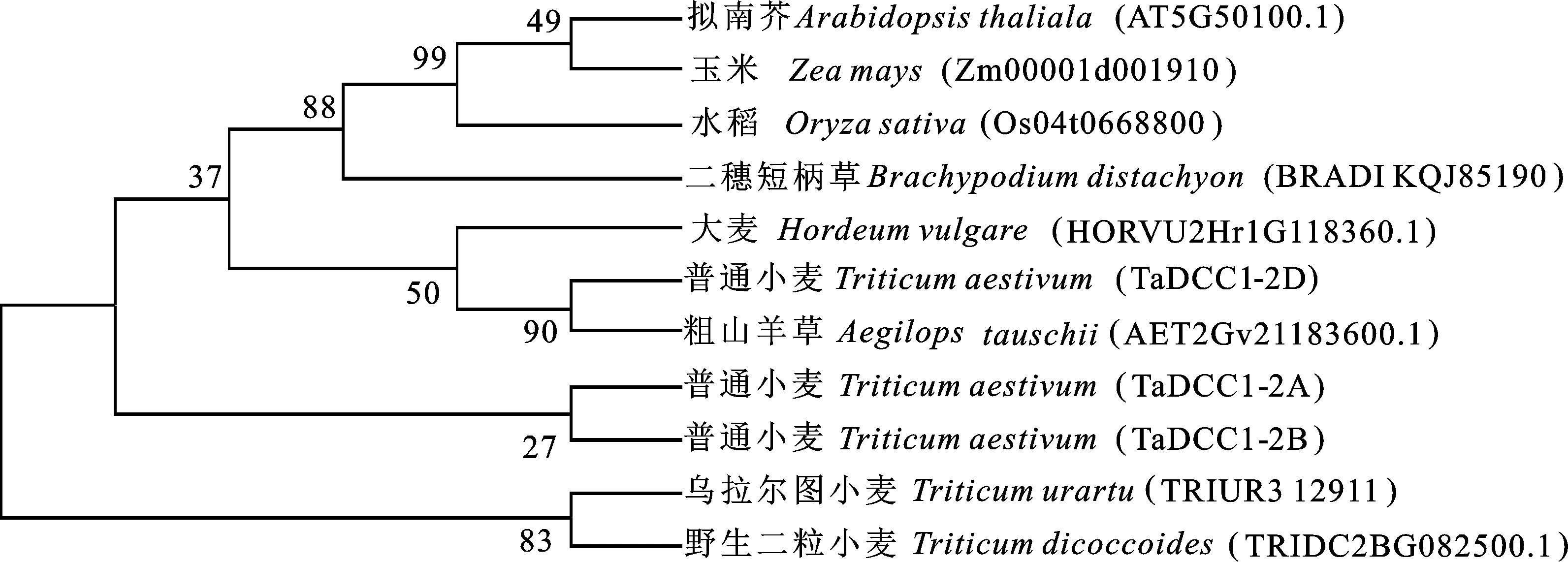
图7 小麦与其他物种DCC1蛋白的进化分析Fig.7 Phylogene trees of DCC1 proteins from wheat and other species
2.4 启动子区域分析
启动子分析结果表明(表3):启动子序列中含有大量与启动子增强转录效率相关TATA-box和CAAT-box启动子基本元件,此外还含有许多参与光响应、茉莉酸甲酯应答以及功能未知的顺式作用调节元件。从响应植物激素的顺式作用元件来看,推测该基因可与赤霉素信号调节有关,同时也预测该基因启动子参与分生组织的 表达。
2.5 转 TaDCC1-2B基因拟南芥植株的筛选及鉴定
为了研究TaDCC1-2B基因的功能,将过表达载体转化拟南芥突变体dcc1,对收获的转基因T0代种子继续种植、筛选及鉴定(图8),得到转基因T3代株系并收获种子,用于后续试验。
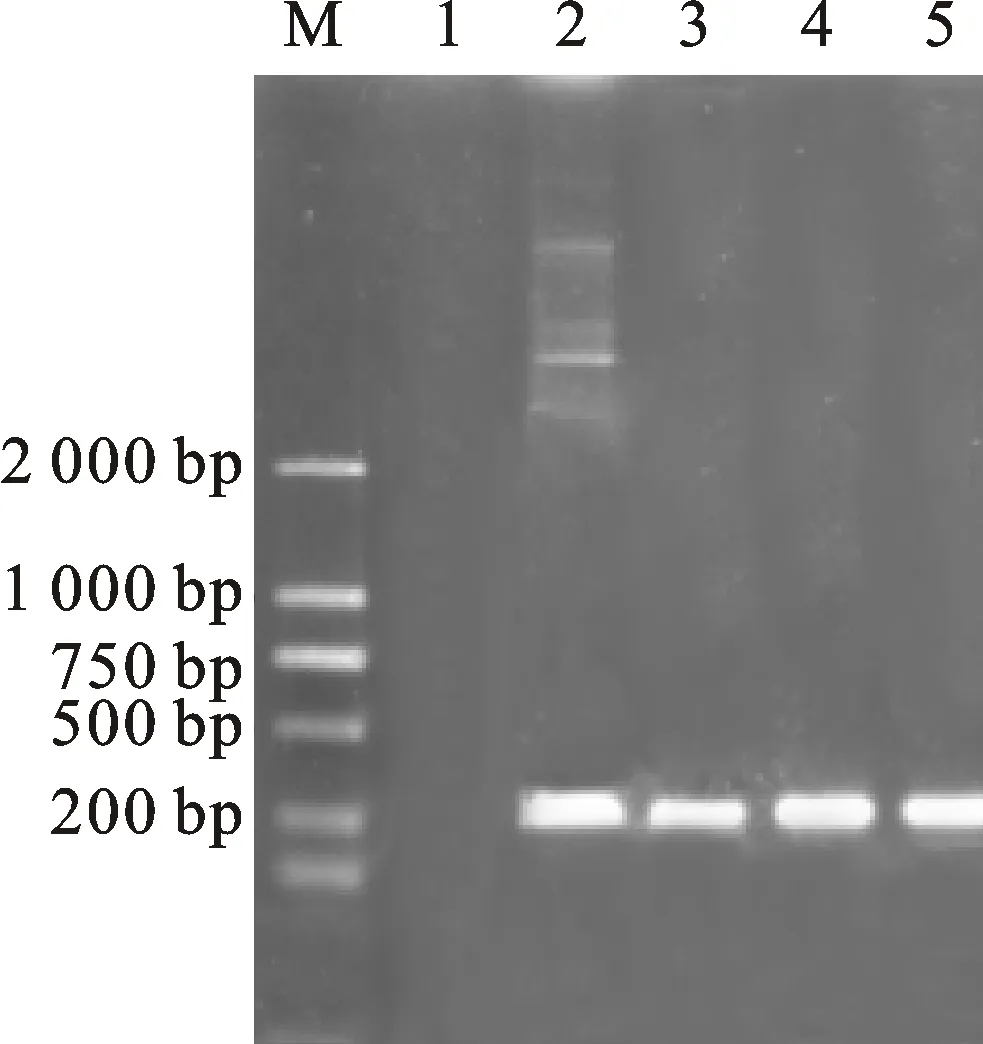
M.D2000 Marker;1.阴性对照 Negative control;2.阳性对照 Positive control;3-5.转基因拟南芥 TransgenicArabidopsis
图8 转基因拟南芥的PCR鉴定
Fig.8 PCR detection of transgenicArabidopsisthaliana
2.6 TaDCC1-2B基因以及WUS基因的表达分析
为了检测TaDCC1-2B基因在转基因拟南芥中的表达水平,提取转基因T3代在SIM培养25 d的再生芽RNA,以TUB2为内参基因,进行实时定量PCR(qRT-PCR)。结果显示(图9)转基因T3代株系的再生芽中TaDCC1-2B基因呈现较高的表达量水平。同时,采取同样的方法对Col-0、dcc1和T3代转基因株系的再生芽标记基因WUS的表达量进行测定,结果表明(图10)Col及T3的WUS表达量极显著高于dcc1(P< 0.01),且T3的WUS表达量接近于Col-0。
2.7 转 TaDCC1-2B基因拟南芥表型鉴定
由图11观察到转基因株系再生芽表型得到了一定程度的恢复,接近于野生型。统计 Col-0、dcc1、T3代株系根尖诱导的愈伤组织在SIM培养第25天的芽再生率(图12),dcc1只有31.3%,而野生型Col-0 的芽再生率达到86.7%,显著高于dcc1(P<0.01),转基因T3代植株的芽再生能力达到57.6%,显著高于dcc1(P<0.05)。
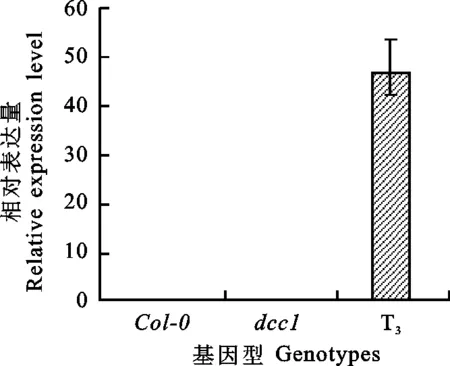
图9 TaDCC1-2B基因表达分析Fig.9 Quantitative real time analysis of TaDCC1-2B expression

不同字母表示在0.05水平上显著:下同 Different letters indicate significant differencesat the 0.05 level;The same below.
图10WUS基因表达分析
Fig.10 Quantitative real time analysis
ofWUSexpression
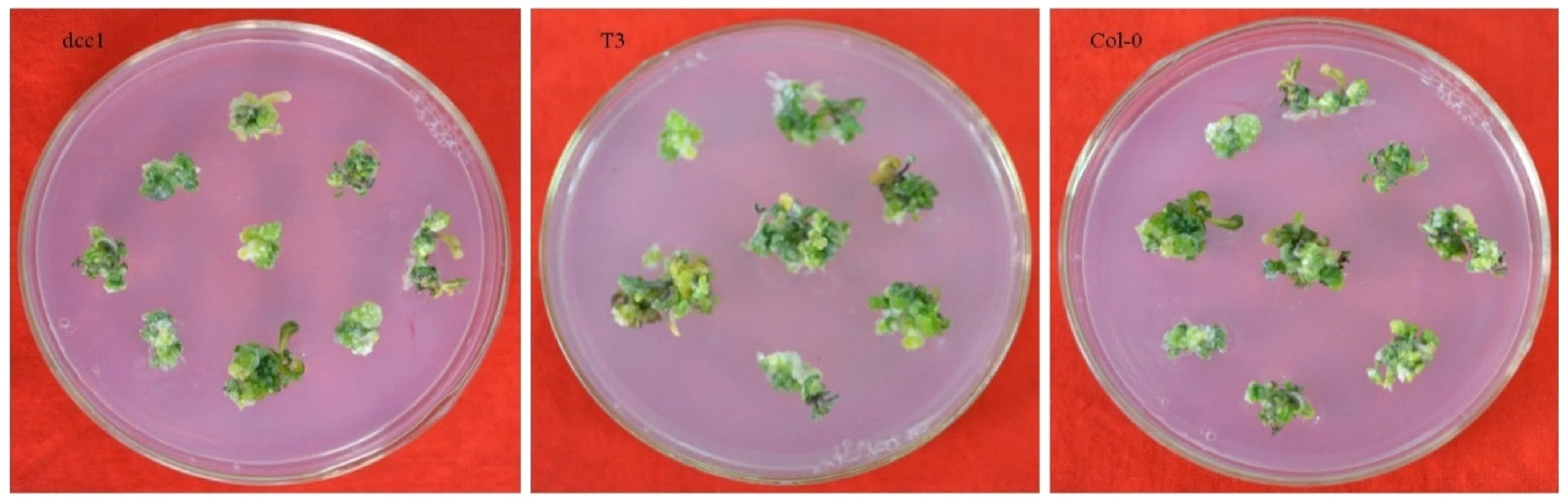
图11 在SIM培养第25天的再生芽Fig.11 The regeneration buds cultured in SIM medium for 25 days
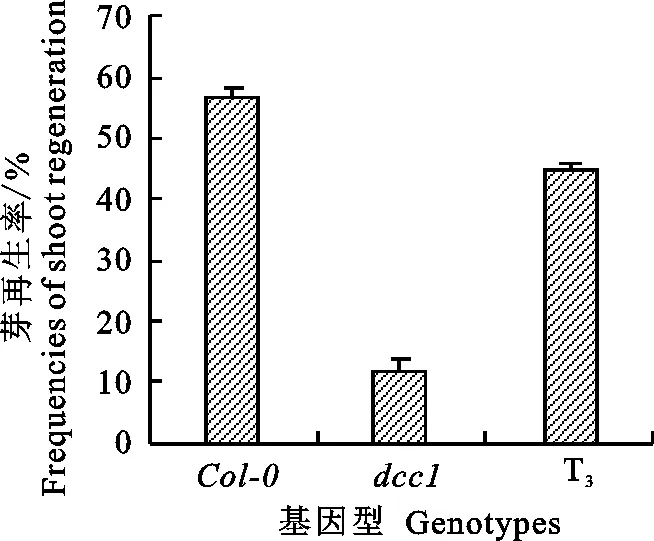
图12 芽再生频率统计分析Fig.12 Statistical analysis of shoot regeneration frequencies
3 讨 论
目前,在多种植物中已发现和克隆了许多对体外培养再生过程有重要影响的基因,并通过在模式物种中的研究,确定了这些候选基因的功能,并对目标物种进行转基因从而提高这些物种的再生能力[2]。小麦是中国第三大粮食作物,但在提高小麦体外再生能力的研究上,尚处于对体外再生培养方法的优化和控制再生性状基因的QTL定位上[37]。普通小麦是一个异源六倍体物种,基因组庞大且复杂,由A、B、D 3个序列高度同源的亚基因组组成[38]。本研究用拟南芥硫氧还蛋白DCC1基因同源克隆到小麦中3条高度同源基因序列,通过检测TaDCC1基因在小麦组织中的的表达量分析3个拷贝基因表达量未表现出显著差异(图3),说明3个基因功能相对保守。由于TaDCC1-2B基因氨基酸序列与拟南芥硫氧还蛋白DCC1同源度最高,因此选取TaDCC1-2B目的基因作为研究对象。通过对TaDCC1-2B基因进行生物信息学分析,发现TaDCC1-2B蛋白N端的DxxCxxC基序中具有2个Cys残基,推测此蛋白具有调节硫醇-二硫键交换方面的功能,这与前人报道的拟南芥DCC1蛋白结构相似[39-40]。通过进化分析发现该蛋白与粗山羊草、乌拉尔图小麦、野生二粒小麦、大麦等单子叶植物的DCC1蛋白同源性较高,但与模式植物拟南芥相比,同源性相对较低,说明二者蛋白之间差异较大,推测它们在功能上也可能因此存在差异,需要进一步鉴定TaDCC1-2B基因的再生功能。
硫氧还蛋白作为抗氧化系统的新型抗氧化酶,在线粒体抵抗氧化胁迫过程中起关键作用[41-42]。在大麦中转入外源硫氧还蛋白基因可提高大麦的抗氧化酶活性,对清除多余的ROS具有积极作用[43]。已有研究报道拟南芥硫氧还蛋白DCC1通过氧化还原修饰调节愈伤组织线粒体内ROS的稳态从而调控植物再生[34],这预示着TaDCC1-2B基因在小麦再生能力方面可能也起着相似的作用。鉴于小麦的遗传转化周期较长,本研究首先利用模式植物拟南芥对TaDCC1-2B基因的功能进行了初步研究。在拟南芥突变体 dcc1中过量表达小麦TaDCC1-2B基因后,转基因株系T3代中TaDCC1-2B基因的表达水平显著高于Col-0和dcc1植株(图9)。此外,通过组织培养发现,转基因T3植株的再生性状得到一定恢复(图11)。Col-0和转基因T3芽的再生率相对dcc1分别达到极显著(P<0.01)和显著水平(P<0.05)(图12),表明TaDCC1-2B基因在拟南芥根尖再生成芽的过程中发挥着重要作用。
基因WUS是WOX转录因子家族中研究最为清楚地一个基因,该基因在拟南芥茎顶端分生组织中特异表达,负责调控茎端分生组织干细胞的形成和维持,并通过与CLV3基因形成一个反馈调节环来调控茎顶端分生组织中器官的启动与分生细胞的维持[44],因此WUS可作为再生芽的标记基因。对比在SIM培养25 d的再生芽体内WUS基因的表达水平发现,WUS的表达量在Col-0 和T3体内显著高于dcc1,在Col-0 和T3两者之间差异不显著(图10)。研究报道拟南芥硫氧还蛋白DCC1的突变会导致线粒体内ROS含量增加,激增的ROS导致愈伤组织和芽分生组织形成的主基因表达受到抑制,而将拟南芥DCC1过表达载体转入突变体中,其再生率显著提高,接近野生型再生水平[34]。因此推测试验中转基因T3株系由于TaDCC1-2B基因的过量表达,使ROS水平保持稳态,WUS基因得以正常表达,从而保持了正常的再生能力。
本研究通过同源克隆得到一个小麦硫氧还蛋白基因TaDCC1-2B,并对其进行生物信息学分析和初步的功能验证,结果表明TaDCC1-2B基因能够提高转基因拟南芥的再生能力。同时应注意到,小麦遗传背景复杂,调控体外体细胞胚胎发生的主效基因可能不同,从与亲缘关系较远的拟南芥中克隆的再生基因并不一定能提高小麦的再生能力,需要对其在小麦组织培养实践中进一步验证。
4 结 论
本研究用同源克隆的方法从小麦品种‘中国春’中克隆得到一个小麦硫氧还蛋白基因TaDCC1-2B,对其进行了生物信息学分析和初步的功能验证。结果发现该基因含645 bp的开放阅读框,编码214个氨基酸,氨基酸序列存在一个包含DxxCxxC基序的DUF393结构域,系统进化分析表明发该基因具有较强的保守性。另外,将TaDCC1-2B基因转入拟南芥突变体dcc1中,获得的转基因株系的再生能力得到显著提高,接近恢复到野生型水平,表明该基因在拟南芥根尖再生成芽的过程中发挥着重要作用,可能在小麦的再生过程中也将发挥相似作用。

