天祝白牦牛 IGF-1基因克隆、生物信息学及差异表达分析
常永芳,包鹏甲,张永峰,付东海,吴晓云,褚 敏,阎 萍,
(1.西北民族大学 生命科学与工程学院,兰州 730030;2.中国农业科学院兰州畜牧与兽药研究所,甘肃省牦牛繁育工程重点实验室,兰州 730050)
牦牛是生活在高寒低氧地区、具有重要文化和生产意义的放牧动物,是高原上的生命之舟。其毛、肉、奶等副产品为藏牧民提供了有效的生活保障和经济来源[1]。天祝白牦牛产自甘肃省天祝藏族自治县,是中国乃至世界的珍稀牦牛种质资源,其被毛纯白、厚密,颈部、肩部、背部多绒毛,体侧部多长毛并与尾毛共同形成裙毛[1-2],兼具利用价值和观赏价值[2]。它的皮毛不仅具有抵御环境侵害(寒冷、强辐射和沙尘暴)、感觉、新陈代谢和调节体温的作用,而且是制革和衬垫织物的高级原材料。毛囊是产生毛发的基本单位,由上皮细胞和真皮细胞之间相互作用形成。哺乳动物毛囊生长具有周期性,循环一般经历生长期、退行期和休止期。但受环境、季节以及个体差异影响,不同物种间毛囊生长周期存在一定差异,如内蒙古绒山羊次级毛囊5-12月为生长期,1月份进入退行期,2-4月份为休止期;而兔子毛囊生长期经历两轮,分别在每年1-4月和9-12月;藏绵羊毛囊生长期处于5-8月,11月份进入退行期,2月处于休止期[3-6]。毛囊的周期性活动伴随着毛纤维的新生与脱落,且毛囊的这种循环生长受众多生长促进和抑制因子之间严格控制的平衡调节[7-10]。因此,研究毛囊发育和周期性生长活动中的调控因子对改善牦牛毛品质和产量具有重要意义。
胰岛素样生长因子(IGF),是一种具有与胰岛素相似结构的同源单链多肽,通常与胰岛素样生长因子结合蛋白(IGFBP)相结合,以复合物的形式存在于机体组织或血液中。IGF包括IGF-1和IGF-2,均是由肝脏响应垂体分泌的生长激素(GH)所产生的蛋白质。IGF-1作为一种内分泌激素,负责机体组织的生长和发育,例如肌肉、骨骼、肾脏、皮肤、肺和肝脏等,同时IGF-1作为一个强劲的有丝分裂原,可促进细胞生长、增殖、分化,同时可抑制细胞凋亡[11]。研究表明[12-13],IGF-1可通过刺激毛囊的表皮和真皮成分,促进毛囊代谢,增加产毛量等。其受体IGF-1R大量存在于动物皮肤毛囊的毛球和外根鞘中,在间充质细胞和表皮细胞中表达[11,14]。IGF-1通过与其受体(IGF-1R)相互作用来调节毛囊的生长周期,并刺激毛母质和毛乳头细胞的增殖和分化,同时抑制细胞的凋亡,对维持毛囊的生长周期至关重要[15-16]。研究表明,沉默与过表达IGF-1基因都会影响毛囊的发生及形态结构变化,外源性IGF-1会加快角质细胞增殖,可有效促进体外培养毛囊的生长[17-18]。魏玉青[12]研究发现,IGF-1能够通过调节IGF-1家族基因的表达来促进绒山羊毛囊发育并维持其毛囊形态结构。此外,IGF-1基因还可促进白鹅次级毛囊的发育[19];Trueb等[20]研究表明,IGF-1影响毛囊增殖、头发生长周期以及毛囊分化,对人头发的生长和防止脱发具有重要作用。目前,IGF-1对牦牛毛囊发育的分子调控机制尚不明确,其在物种进化过程中相对保守,但也存在一定的种间差异。因此,本研究以天祝白牦牛皮肤组织为试验材料,克隆天祝白牦牛IGF-1基因序列,分析其分子结构及功能,并探究IGF-1基因在天祝白牦牛毛囊发育不同时期的表达特征,以期为该因子对毛囊发育和毛发纤维生长的调控及其功能研究提供理论依据。
1 材料与方法
1.1 试验材料
白牦牛均来自于甘肃省天祝县白牦牛养殖场,选取同一养殖场年龄相近(2~3岁)、饲养条件相同且相互之间无遗传相关的3头雌性空怀天祝白牦牛,分别在1、3、10月份采集这3头牦牛的体侧皮肤组织,用生理盐水和PBS处理组织样品表面异物,分装标记并迅速投入液氮罐中,备用。
1.2 试验试剂
DNA纯化试剂盒、反转录试剂盒、大肠杆菌DH5α 感受态细胞、pMD 19-T克隆载体、DL 2 000DNA marker、2×TaqPCR Master Mix、胶回收试剂盒,均购自TaKaRa公司;Amp(氨苄青霉素)、Trizol均购自Solarbio公司。
1.3 试验方法
1.3.1 总RNA提取及cDNA合成 通过TrizoI法提取皮肤组织总RNA,并通过NanoDrop仪器检测RNA的质量浓度和纯度,10 g/L琼脂糖凝胶电泳检测其完整性。以皮肤组织RNA为模板,使用TakaRa反转录试剂盒进行cDNA合成, -20 ℃保存,备用。
1.3.2 引物设计与合成 根据GenBank中黄牛IGF-1基因mRNA序列 (登录号: NM_001077828.1) ,利用NCBI在线工具Pick Primer设计引物,详见表1。
1.3.3 目的片段的TA克隆与测序 以天祝白牦牛皮肤组织cDNA为模板进行PCR扩增,引物见表1,总反应体系20 μL:上下游引物各1 μL(10 μmo/L),cDNA 1 μL, RNase-Free ddH2O 7 μL,2×TaqPCR Master Mix 10 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,共35 个循环;72 ℃终延伸10 min,4 ℃保存;用10 g/L的琼脂糖凝胶电泳检测PCR产物。回收目的片段,将适量PCR产物连接到pMD19-T克隆载体(16 ℃,30 min),将连接产物转化至DH5α 感受态细胞中,挑取白色阳性单克隆菌落至LB (Amp+)液体培养基中扩大培养(37 ℃),最后进行菌液PCR鉴定,选择 PCR鉴定正确的阳性单克隆送至北京奥科鼎盛生物科技有限公司进行 测序。
1.3.4 生物信息学分析 利用ORF Finder在线程序对白牦牛IGF-1基因序列进行开放阅读框分析,并用BLAST进行序列同源性比对分析;使用ExPASy中的在线工具ProtParam和ProtScale分别分析IGF-1氨基酸序列的理化性质和亲疏水性;使用ExPASy中的SOPMA、SWISS-MODEL工具预测IGF-1蛋白的二、三级结构;使用SignalP 4.1和TMHMM在线工具预测牦牛IGF-1蛋白的信号肽和跨膜结构;利用SMART和PSORT Ⅱ Prediction分析IGF-1蛋白的结构域和亚细胞定位;利用Mega 7.0软件构建IGF-1基因的系统生物进化树[21]。
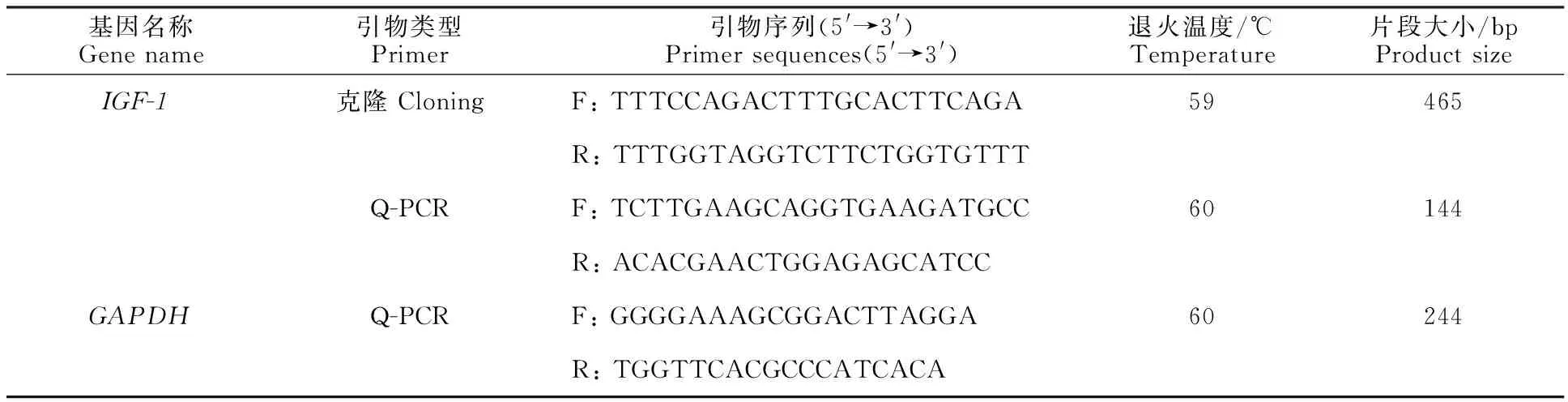
表1 IGF-1基因引物序列Table 1 Primer sequences of IGF-1 gene
1.3.5 qRT-PCR技术检测IGF-1基因的相对表达量 以皮肤组织的cDNA为模板进行qRT-PCR反应,反应体系(总体积为20 μL):SYBRGreenⅡ 10 μL,上、下游引物各1 μL(10 μmol/L),模板cDNA 1 μL,ddH2O 7 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60℃退火30 s,72 ℃延伸5 s,共39个循环。每个样品3个重复,以GAPDH为内参基因。
1.3.6 数据处理 利用2-△△Ct法计算毛囊发育3个时期的相对表达量,并使用SPSS 22.0软件对IGF-1基因在牦牛毛囊发育不同时期的表达量进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 IGF-1基因PCR扩增检测结果
如图1 所示,扩增产物电泳条带清晰明亮,特异性良好,且扩增片段的大小与预期一致。
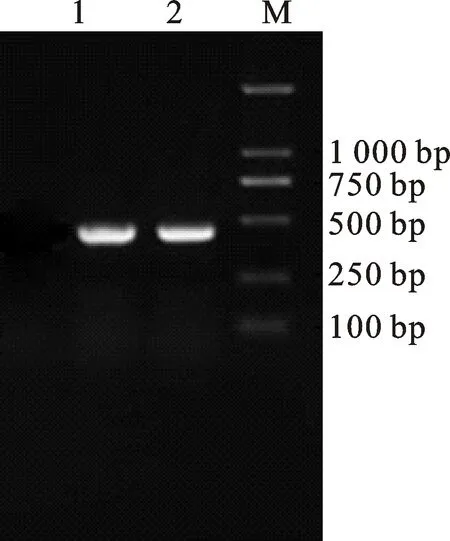
1~2.IGF-1基因PCR产物 PCR products ofIGF-1gene;M.DL2000 DNA marker
图1IGF-1基因PCR扩增产物电泳检测
Fig.1 The electrophoresis of PCR
amplification products ofIGF-1gene
2.2 IGF-1基因克隆测序与序列分析
将克隆测序得到的序列与GenBank上黄牛IGF-1基因(NM_001077828.1)序列比对发现,第316位存在一个碱基差异(T→C),为同义突变。序列分析表明,该序列包含一个长度为465 bp的完整开放阅读框(图2),编码154个氨基酸;76 bp处为起始密码子(ATG),540 bp处为终止密码子(TAG),碱基组成为A=22.58%、G= 28.60%、T=21.29%、C=27.53%,C+G (56.13%)高于A+T(43.87%),说明IGF-1基因编码区的DNA双链比较稳定。
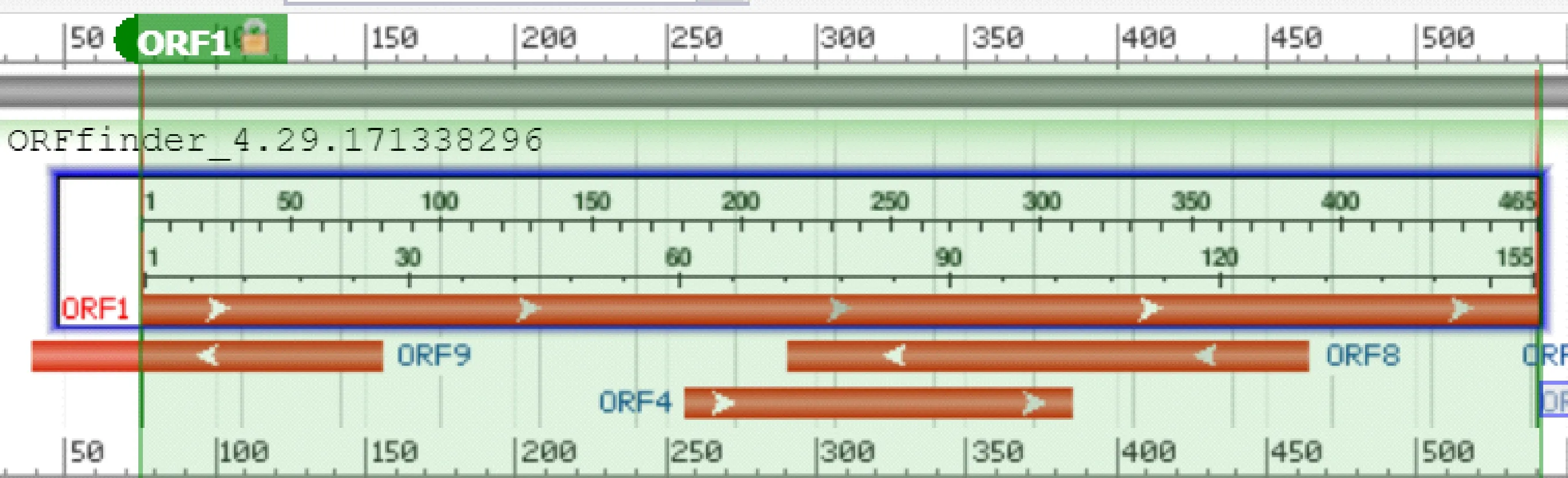
图2 IGF-1基因开放阅读框分析Fig.2 The open reading frame analysis of IGF-1 gene
2.3 IGF-1蛋白基本理化性质分析
基本理化性质分析表明,天祝白牦牛IGF-1蛋白分子式为C744H1186N214O216S15,分子质量为17 065.81 ku,理论等电点为9.36;含20种氨基酸(表2),其中亮氨酸Leu (9.7%)、丙氨酸Ala (9.7%)的频率最高,其水溶液在280 nm处的消光系数为8 075,半衰期为30 h,不稳定系数为55.06,属于不稳定蛋白。亲/疏水性预测结果显示(图3),该基因编码的蛋白质疏水性最大值为 2.756(第37位),最小值为-1.978(第127位),总平均亲水性为-0.249,为亲水性蛋白。
2.4 IGF-1蛋白信号肽与跨膜结构预测
天祝白牦牛IGF-1蛋白信号肽预测分析结果如图4所示 ,Y-max为0.671、C-max为0.631、S-max为0.903,均大于阈值0.5,表明该蛋白存在信号肽区域,为分泌蛋白,氨基酸序列在1~49区域的S值较高,预测为信号肽区域;IGF-1蛋白跨膜结构预测结果如图5所示,该蛋白存在一个跨膜结构。
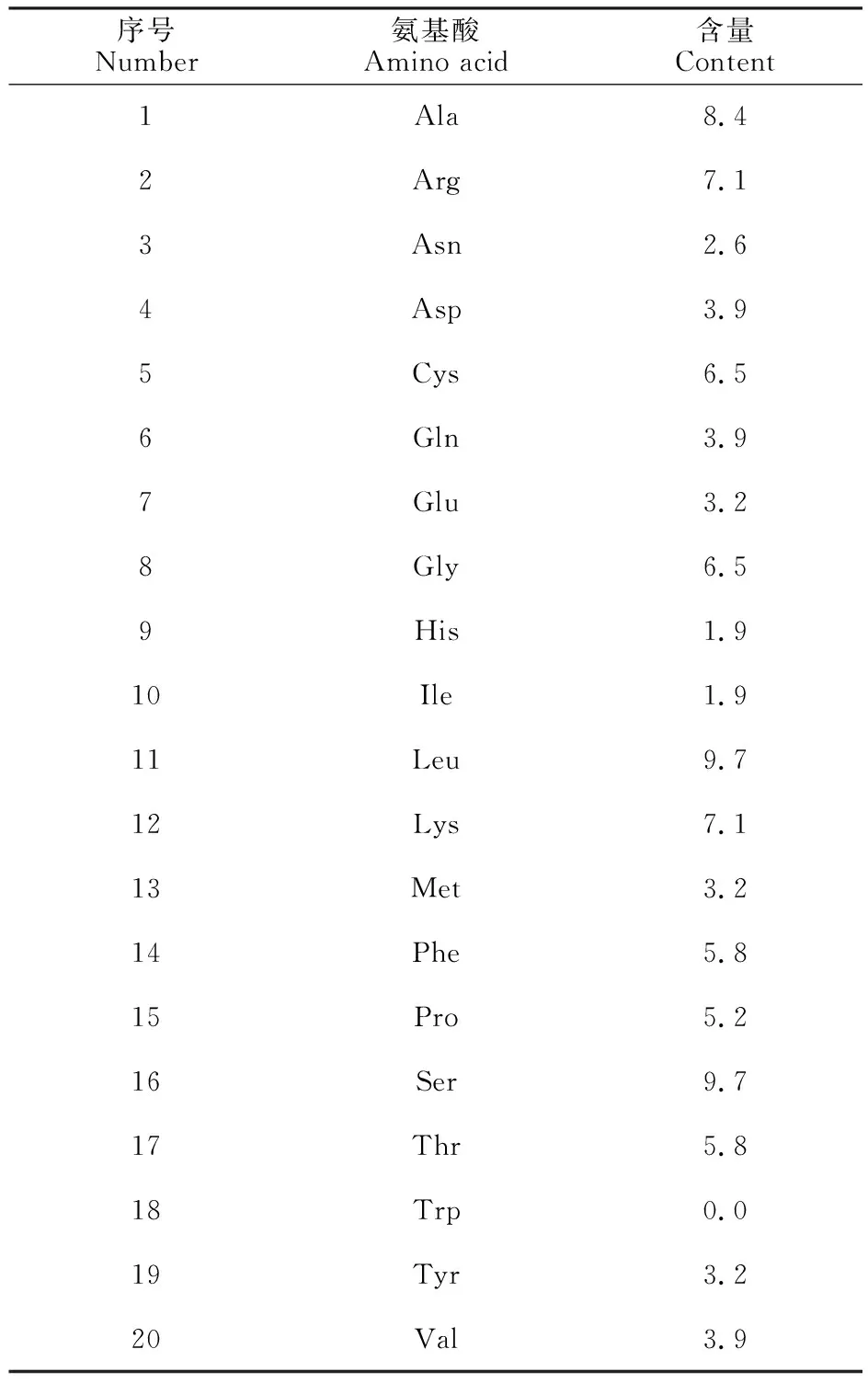
表2 IGF-1编码蛋白中氨基酸的含量Table 2 Amino acid content of protein encoded by IGF-1 gene %
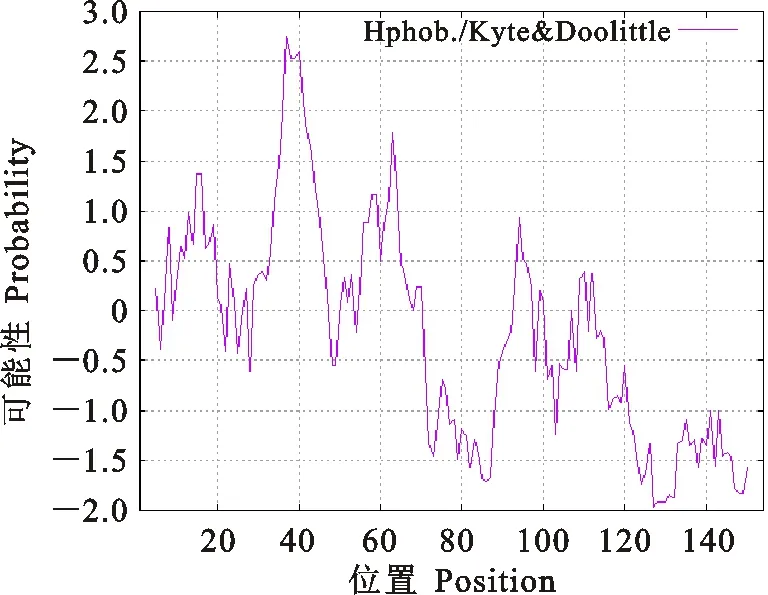
正值表示疏水,负值表示亲水 Positive values indicate hydrophobic and negative values indicate hydrophilic
图3 白牦牛IGF-1蛋白水亲/疏水性预测
Fig.3 Prediction of hydrophilicity/hy
drophobicity of white yak IGF-1 protein
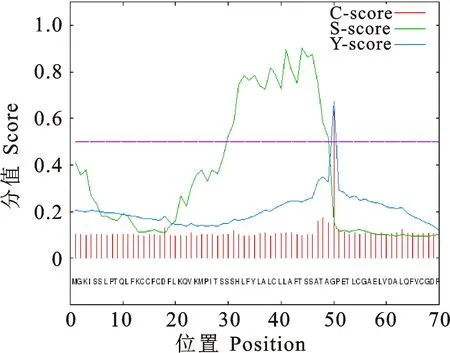
图4 白牦牛IGF-1蛋白信号肽预测Fig.4 Prediction of signal peptide of white yak IGF-1 protein
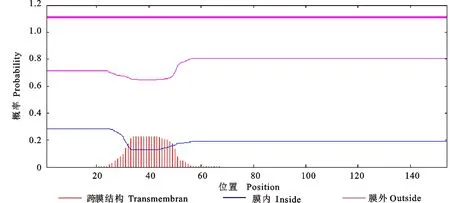
图5 白牦牛IGF-1蛋白跨膜结构预测Fig.5 Prediction of transmembrane structure of white yak IGF-1 protein
2.5 IGF-1蛋白二、三级结构分析
天祝白牦牛IGF-1蛋白二级结构预测结果显示,主要由α-螺旋(27.27%)、β-转角(3.25%)、无规则卷曲(57.79 %)和11.69%的延伸链组成(图6);三级结构预测结果与二级结构预测结果基本一致(图7)。三级结构以3Iri.1.A为模板,序列相似度为87.34%,符合同源建模法中序列相似度大于35%的要求。
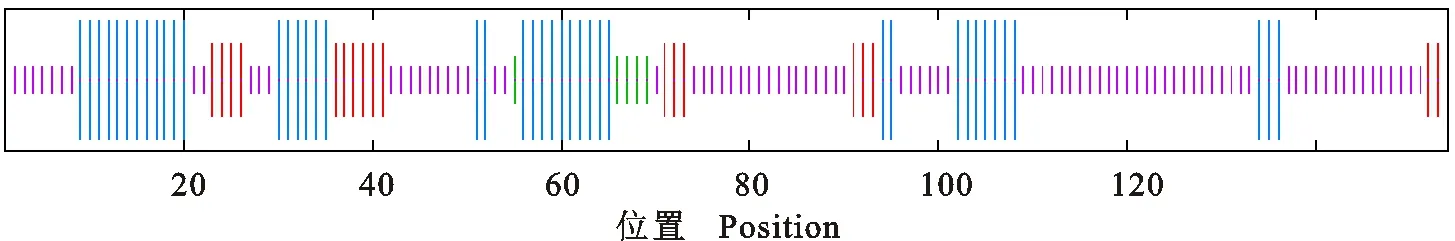
图中竖线按照由长到短递减依次表示α-螺旋、延伸链、β-转角、无规则卷曲 The vertical lines in the graph according to descending order indicated alpha helix,extended strand,beta turn and random coil,respectively
图6 白牦牛IGF-1蛋白二级结构预测
Fig.6 Prediction of secondary structure of white yak IGF-1 protein

图7 IGF-1蛋白三级结构预测Fig.7 Prediction of tertiary structure of white yak IGF-1 protein
2.6 IGF-1蛋白结构域及亚细胞定位分析
天祝白牦牛IGF-1蛋白包含一个结构域,第52(Glu)至第110(Cys)位氨基酸为Insulin / insulin-like growth factor / relaxin family( IIGF)家族典型的保守结构功能域(图8);IGF-1亚细胞定位预测结果表明:IGF-1蛋白在细胞核、线粒体、细胞外、细胞质、内质网、分泌系统囊泡中分别占65.2%、17.4%、4.3%、4.3%、4.3%和4.3%,在细胞核中分布最多。
2.7 IGF-1基因同源性分析
利用MEGA 7.0软件对天祝白牦牛、黄牛、梅花鹿、马鹿、山羊、绵羊、野猪、仓鼠、田鼠、鼠兔等物种的IGF-1氨基酸序列进行同源性分析,并构建系统发育树 (图9) 。结果显示:天祝白牦牛与黄牛亲缘关系最近,同源性为100%;其他依次为绵羊98%、梅花鹿98%、马鹿97%、野猪97%、山羊96%、仓鼠92%、田鼠90%、鼠兔90%,表明IGF-1基因在哺乳动物进化过程中比较保守。
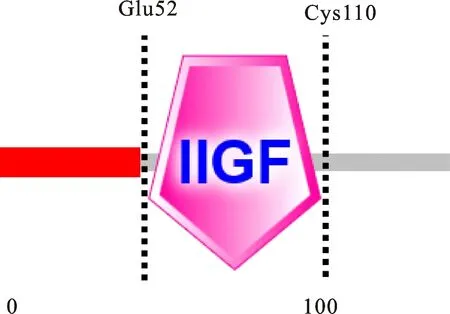
图8 白牦牛IGF-1蛋白结构域Fig.8 Protein domains of white yak IGF-1

图9 IGF-1基因系统发育树Fig.9 Phylogenetic tree of IGF-1 gene
2.8 qRT-PCR技术检测 IGF-1基因相对表达量
qRT-PCR技术检测IGF-1基因在牦牛毛囊发育不同时期的表达水平,结果表明(图10),在3 个时期均能检测到IGF-1基因的表达,并且在生长期表达量最高,休止期表达量最低,生长期和退行期的表达量显著高于休止期(P<0.05),退行期表达量与生长期无显著差异(P>0.05)。
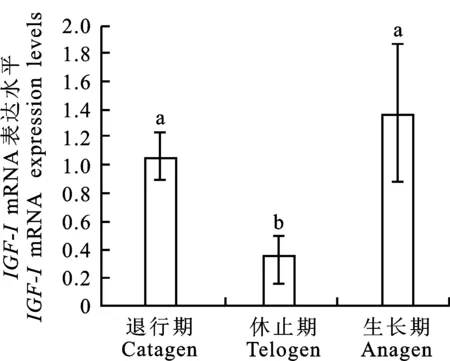
上标不同字母表示差异显著(P<0.05) Different letter on the bar indicates statistical difference(P<0.05)
图10 毛囊发育周中期皮肤组织
IGF-1基因的mRNA表达水平
Fig.10 mRNA expression level ofIGF-1
in the skin of during hair cycle
3 讨 论
本研究通过克隆白牦牛IGF-1基因CDS区,分析其序列特征,探究IGF-1基因在毛囊周期性发育中的功能。将获得的天祝白牦牛IGF-1基因的编码区序列与黄牛的序列比对,发现第316位发生1个碱基突变(TAT→TAC),为同义突变。以往基因同义突变被认为不会引起功能性的变化,但近年来研究发现在密码子高度保守的区域内存在一种同义突变,影响基因表达、翻译效率或蛋白质折叠速率及蛋白质构象,甚至是蛋白质功能[22]。对IGF-1氨基酸序列预测显示,其编码154个氨基酸,是不稳定蛋白质;贾浩等[23]研究表明,蛋白质的半衰期与其稳定性呈正相关,而在本研究中IGF-1蛋白半衰期较长为30 h,却不是稳定性蛋白,这一研究结果与贾浩等[23]的研究报道不符,天祝白牦牛IGF-1基因出现这种不一致的特性,可能与其特殊的作用方式及与IGFS家族内相关受体作用有关,需进一步研究和探讨。各物种氨基酸序列同源性分析发现,天祝白牦牛与黄牛IGF-1氨基酸序列同源性为100%,相似度最高,不同物种之间IGF-1基因存在较高保守性,这意味着该基因在人、小鼠、绒山羊、牦牛等多种哺乳动物皮肤毛囊中的作用具有相似性;天祝白牦牛IGF-1蛋白结构域预测结果表明,该蛋白在第52~110位氨基酸含有一个Insulin / insulin-like growth factor / relaxin family( IIGF)家族典型的保守结构功能域,为该基因功能的深入研究提供理论参考。
毛发的生长主要受毛囊和其他表皮细胞间的相互作用影响,毛囊周期性循环过程中毛囊细胞的激活以及新旧毛干的交替受多个生长因子和信号通路的共同调控。IGF-1通过与其受体结合促进 IGF-1R 酪氨酸残基磷酸化,也可通过MAPK、ERK1/2信号通路,激活IGF-1的生物学效应,从而触发下游反应,最终刺激细胞分裂,调控动物的生长发育[24-26]。研究IGF-1基因在天祝白牦牛皮肤组织中的表达趋势发现,该基因在毛囊发育不同时期均有表达,但毛囊发育生长期IGF-1表达量显著高于休止期,这与魏玉青[12]和刘逍等[19]的研究结果基本一致。由于生长期毛囊生长处于最活跃的状态,此时毛乳头持续增大且毛囊隆突部的干细胞迅速增殖,毛母质细胞的增殖分化能力不断增强,使得毛囊和毛干不断生长[27-28],推测IGF-1可能在毛囊生长期刺激毛囊增殖分化中发挥重要作用。此外,IGF-1能够通过激活RNA聚合酶等活性,来促进非组蛋白的磷酸化,同时增加mRNA水平[29]。近年来研究发现在毛囊发育过程中IGF-1被认为具有调节细胞增殖和迁移的作用,需通过与特定的细胞表面受体结合来激活细胞,进而发挥其生物学作用[24,30],同时IGF-1在许多细胞类型中被认为是一种抗凋亡的生存因子,可能在毛囊周期的生长期抑制细胞调亡,从而维持毛囊生长期[31]。由此推断IGF-1基因可能通过刺激毛囊细胞的生长活动参与调控白牦牛毛囊发育及其周期性变化。由于毛囊的周期性活动是由众多生长促进和抑制因子之间严格控制的平衡和相互作用来调节的,是一个复杂的调节网络,因此IGF-1自身以及与其他因子的相互作用对哺乳动物毛囊发育及其毛发生长的调控机理还需进一步探索。
4 结 论
通过RT-PCR技术成功克隆天祝白牦牛IGF-1基因CDS序列,并研究发现IGF-1基因在白牦牛毛囊发育不同时期皮肤组织中呈规律性表达。表明IGF-1基因参与调控白牦牛毛囊的生长及毛囊的周期性循环,为解析白牦牛毛囊发育及被毛生长提供理论依据,同时也为研究IGF-1基因在白牦牛毛囊生长发育中的作用机制提供理论基础。
——以天祝藏族自治县扶贫实践为例

