基于高通量测序分析肺炎支原体感染姜曲海猪肺组织miRNA表达谱
倪黎纲,赵旭庭,王宵燕,宋成义,吴信生,甘 源
(1.扬州大学 动物科学与技术学院,江苏 扬州 225009; 2.江苏农牧科技职业学院,江苏 泰州 225300; 3.江苏省农业科学院 兽医研究所,江苏 南京 210004)
猪支原体肺炎(Mycoplasmalpneumoniaof swine, MPS)又称为猪气喘病,是养猪生产中主要呼吸系统疾病之一,当猪感染该病时,其临床症状表现为咳嗽、气喘、食欲减退、呼吸困难等,影响猪的生长速度和饲料转化率,给养猪业造成经济损失[1]。生产实践中发现,不同品种对该病的感染率不同,中国地方猪种的易感性比外来品种强,尤其是中国高繁殖力的地方品种,如梅山猪、二花脸猪对猪气喘病均具有较高的易感性[2]。近年来的研究发现,不同猪种对猪气喘病的易感性存在分子遗传机制的差异,如猪TLR2、TLR4、IL-1β、CXCL8等免疫相关基因的变异及其表达差异与猪气喘病的易感性/抗性可能存在关联[3-7]。但是,关于候选基因的表达差异对猪气喘病易感性/抗性的调控机制目前尚不清楚,特别是地方猪种对猪气喘病易感性的分子基础和感染机理还需要进一步研究。
microRNAs(miRNAs)广泛存在于动植物中,属于一种长度22 nt左右的内源性非编码单链小RNA,miRNA可通过转录后调控基因的表达,参与细胞组织的增殖、凋亡、免疫等功能[8]。近些年研究表明,miRNA对基因功能研究和疾病防治有重要意义,如miR-let-7 家族通过调控NF-KB通路,促进各种细胞因子释放,调控机体对病原免疫应答反应[9];miR-223调控抑制CXCL2、CXCL8、CCL3等中性粒细胞趋化因子的表达,从而减少中性粒细胞趋化到肺部组织,减少肺组织的病理损伤,起到对肺组织的保护作用[10-11]。因此,对免疫反应中机体组织miRNA表达谱的研究,可探讨特定miRNA及其靶基因在抗病免疫反应过程中的作用,全面揭示免疫反应的遗传基础及抗病机制。
姜曲海猪是我国江海型地方猪种,分布在江苏苏中地区,与梅山猪、二花脸猪等均属于高繁殖力地方猪种,对猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)非常敏感[12]。本研究以姜曲海猪为实验对象,通过人工感染猪肺炎支原体后,利用深度高通量测序技术研究姜曲海猪肺组织在肺炎支原体感染后miRNA的表达谱,差异分析miRNA的种类及其靶基因,并进一步分析预测靶基因的GO(gene ontology)和KEGG(Kyoto encyclopedia of genes and genomes)功能,为研究姜曲海猪对肺炎支原体的感染机制提供理论基础。
1 材料与方法
1.1 实验动物及样本采集
50日龄纯种姜曲海猪20头由江苏姜曲海种猪场(江苏泰州)提供,未注射肺炎支原体疫苗,猪繁殖与呼吸综合征病毒及肺炎支原体病原检测均为阴性。实验猪随机分成2组(感染组和对照组),人工感染肺炎支原体试验剂量参考文献[13-15],感染组气管注射5 mL肺炎支原体强毒冻干物(1∶100)稀释液(Mhp Js强毒株由江苏省农业科学院兽医研究所提供),对照组气管注射5 mL无菌生理盐水,试验期为28 d[14]。然后,随机选择3头感染猪和3头健康无症状的对照组猪,屠宰分离肺部组织,无菌采集肺组织样品,采集样本后立即放到液氮中。 PCR检测确定感染猪的肺组织为肺炎支原体病原阳性,对照组为阴性,然后转移到冰箱冷冻保存,备用。
1.2 试验试剂
RNA提取试剂盒、miRNA反转录试剂盒、荧光定量PCR试剂盒均购自天根生化科技(北京)有限公司;琼脂糖为Biowest分装产品;乙醇、氯仿、异丙醇等均为国产分析纯。
1.3 样本总RNA的提取及测序
将所采集的肺组织样本在液氮中充分磨碎,采用Trizol法,提取样本总RNA,总RNA的纯度和质量经Agilent2100检测,RNA完整指数>107可用作miRNA的分离与鉴定,RNA完整指数>108可用作miRNA的测序与分析。提取的猪肺组织RNA样品委托上海欧易生物医学科技有限公司进行高通量测序,构建文库,并在Illumina Hiseq 2000平台进行测序。
1.4 数据处理与分析
由Illumina Hiseq 2000平台测序所得数据经过引物与接头序列去除,并经过对测序片段碱基的质量检验和长度筛选,最终得到质量可靠的测序纯净序列(clean reads)。然后,对纯净序列的长度分布进行统计,以初步评估样本小RNA分布情况。并根据该物种的参考基因组序列(ftp://ftp.ensembl.org/pub/release-83/fasta/sus_scrofa/dna/Sus_scrofa.Sscrofa10.2.dna.toplevel.fa.gz),将纯净序列与基因组比对,统计序列比对到基因组的百分比。过滤去除rRNA、snRNA、snoRNA、tRNA等序列,使用RepeatMasker软件,过滤去除重复序列,鉴定已知的成熟体miRNA序列以及新预测的miRNA序列,采用差异表达基因(differentially expressed genes, DEGs)软件筛选出P<0.05的差异表达miRNA。采用Miranda预测miRNA的靶基因。预测靶基因的KEGG和GO功能分析采用DAVID软件分析。
1.5 qRT-PCR验证差异表达miRNA
根据高通量测序得到miRNA序列,随机选择4个成熟的miRNA进行定量PCR验证。采用茎-环RT-PCR法设计miRNA的定量引物,U6作为内参基因(表1)。试验样本提取的总RNA采用miRNA反转录试剂盒进行cDNA的合成(加尾法),使用CFX384 TouchTM荧光定量PCR进行检测验证。定量 PCR数据采用2-ΔΔCt法进行分析处理,利用SPSS 17.0软件分析差异表达情况,用T-test检验差异显著性。
2 结果与分析
2.1 miRNA表达基本数据分析
采集的肺组织样本,经提取总RNA和质控后,进行Illumina Hiseq高通量测序,成功获得了感染组和对照组2个肺组织sRNA文库。文库筛选分别获得14 985 014和14 357 415条序列,经过滤后分别获得14 265 786和14 000 588条纯净序列,与参考基因组序列的比对率分别为92.23%和91.83%(表2)。选取纯净序列长度为15~41 bp的序列进行长度分布及拷贝数统计,结果显示,大部分纯净序列集中在20~24 nt(图1),最多的集中在22 nt,感染组中22 nt的序列占43.72%,对照组中22 nt的序列占47.88%。
2.2 差异表达miRNA分析
对感染组和对照组筛选出来的差异miRNA进行统计分析,相对于对照组,感染组中共筛选到73个显著差异表达的miRNAs(图2),其中,39个表达上调miRNAs,34个表达下调miRNAs。随机选取4个miRNAs进行定量PCR分析,定量结果与miRNA测序的结果基本一致(图3),表明miRNA测序的准确性和可靠性。
表1miRNA的定量PCR引物序列
Table1miRNA primers of qRT-PCR

miRNA名称Name of miRNA引物Primerssc-miR-2225′-GGCTACATCTGGCTACTG-3′ssc-miR-221-3p5′-GCTACATTGTCTGCTGGG-3′ssc-miR-27b-3p5′-TTCACAGTGGCTAAGTTC-3′ssc-miR-30c-5p5′-GGTAAACATCCTACACTCTC-3′下游通用引物Reverse universal primer5′-CTCAACTGGTGTCGTGGAGTC-3′U6上游引物Forward primer5′-GCTTCGGCAGCACATATACTAAAAT-3′U6下游引物Reverse primer5′-CGCTTCACGAATTTGCGTGTCAT-3′
表2 小RNA高通量测序数据统计
Table2High-throughput sequencing data statistics of small RNAs

组别Groups序列总数Total reads过滤纯净序列Clean reads过滤百分比Clean ratio/%比对上基因组的序列数Aligned reads比对上基因组的序列数比例Aligned ratio/%感染组Infected group149850141426578695.201315730292.23对照组Control group143574151400058897.511285665691.83
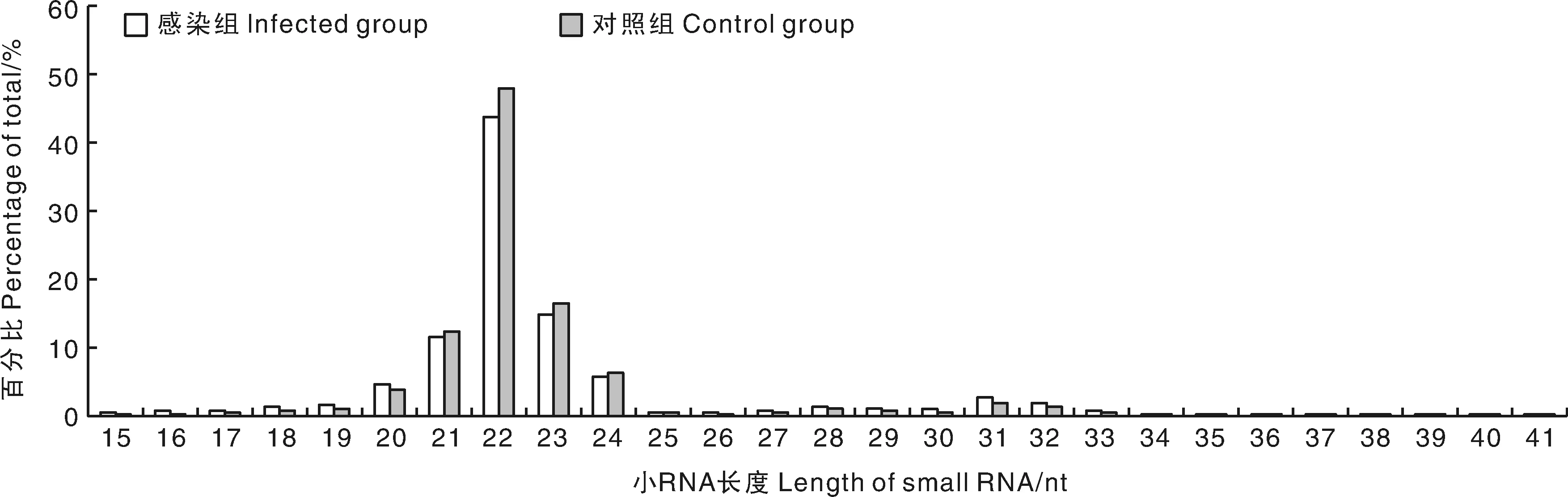
图1 小RNA片段的长度分布Fig.1 The length distribution of small RNA sequences
2.3 miRNA调控靶基因预测与分析
使用Miranda软件对感染组中显著差异表达的miRNA进行靶基因预测,73个差异miRNAs预测到1 685个靶基因和4 220个靶位点。根据靶向基因预测结果,筛选到8个与免疫调控相关的miRNAs(表3),包括ssc-miR-30c-5p、ssc-miR-128、ssc-miR-125b、ssc-let-7c、ssc-miR-221-3p、ssc-miR-221-5p、ssc-miR-20b和ssc-miR-4332,预测到与免疫相关的靶向基因包括TLR6、CD6、CCDC180、CCDC120、HHLA2、IL12RB2、WNT2等。
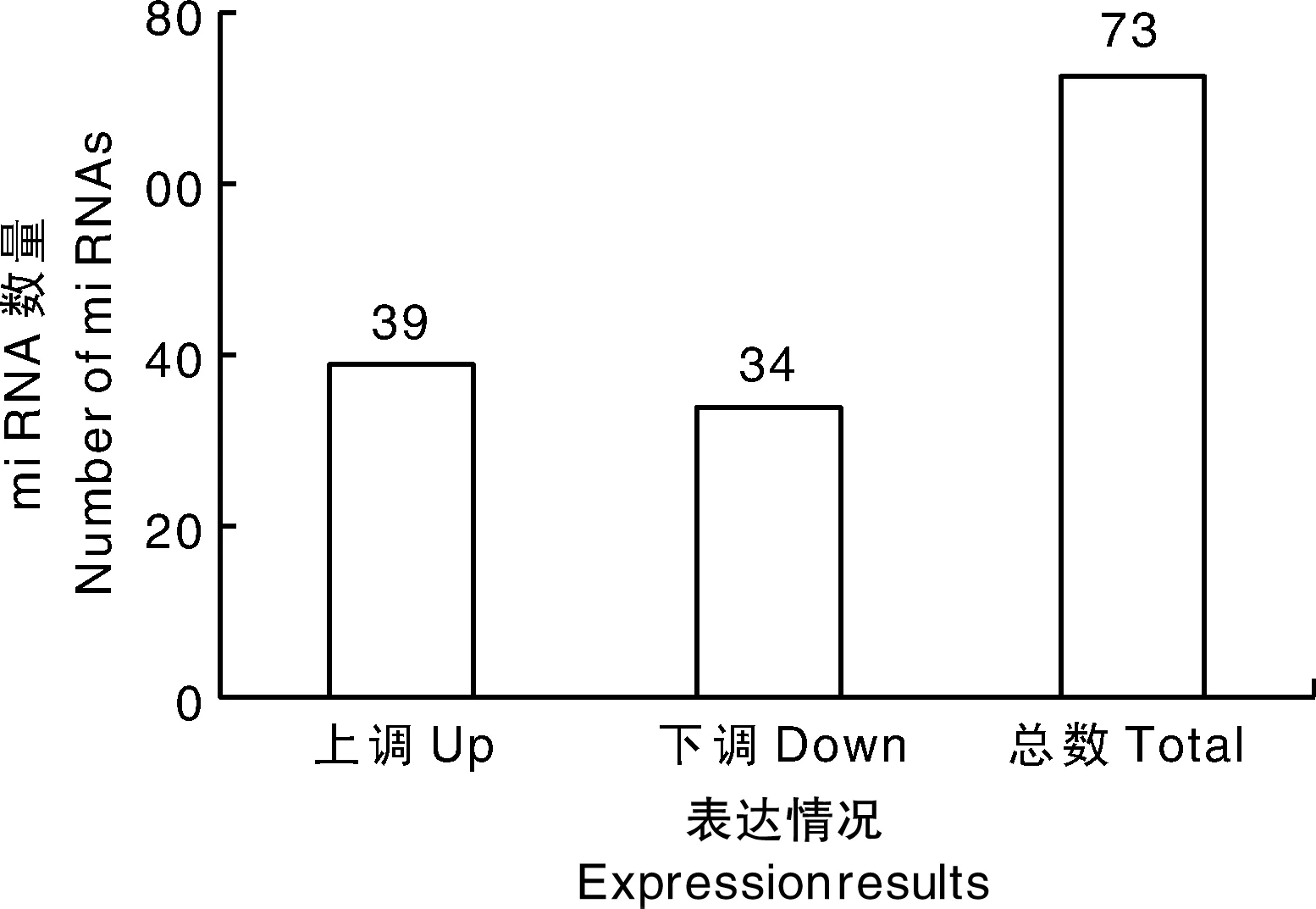
图2 感染组中差异表达miRNA数量Fig.2 Number of differentially expressed miRNAs in the infected group
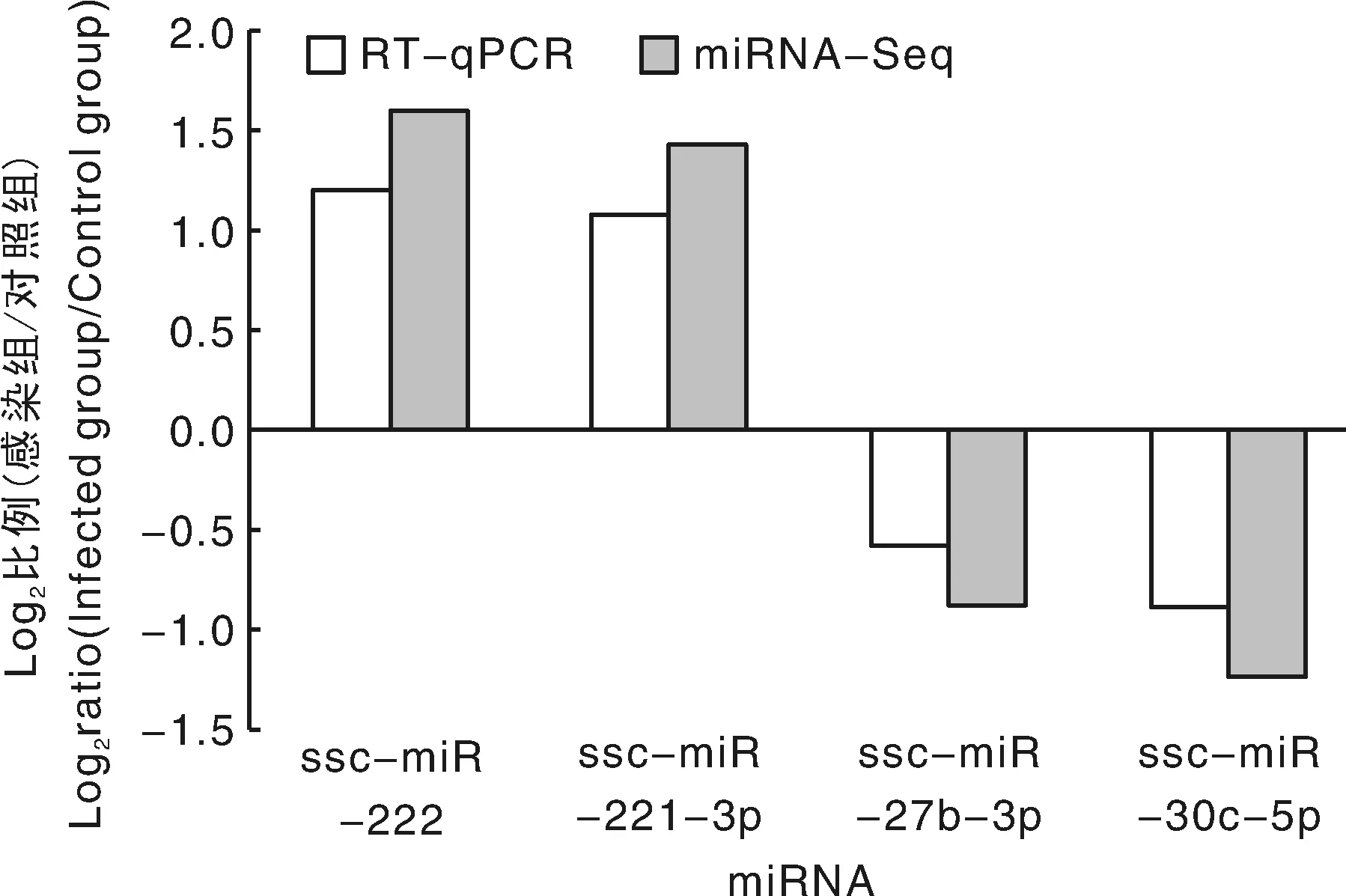
图3 miRNA测序结果的定量PCR验证Fig.3 The result of qPCR compared with miRNA-Seq
2.4 靶基因GO和KEGG分析
差异表达miRNA预测的靶基因进行GO和KEGG分析。GO分析结果见图4,预测靶基因注释到组蛋白H3-K27去甲基化、MAPKKK活性激活、细胞凋亡的执行等生物过程;组蛋白乙酰转移酶复合物、Ada2Gcn5Ada3转录激活复合物等细胞成分;P53结合、信号适配活性、C-X-C趋化因子受体活性等分子功能。KEGG分析结果见表4,预测靶基因主要参与细胞凋亡、ECM受体相互作用、粘附斑通路等信号通路。
表3 感染组中与免疫调控相关的差异表达miRNAs
Table3Differentially expressed miRNAs related to immuneregulation in the infected group
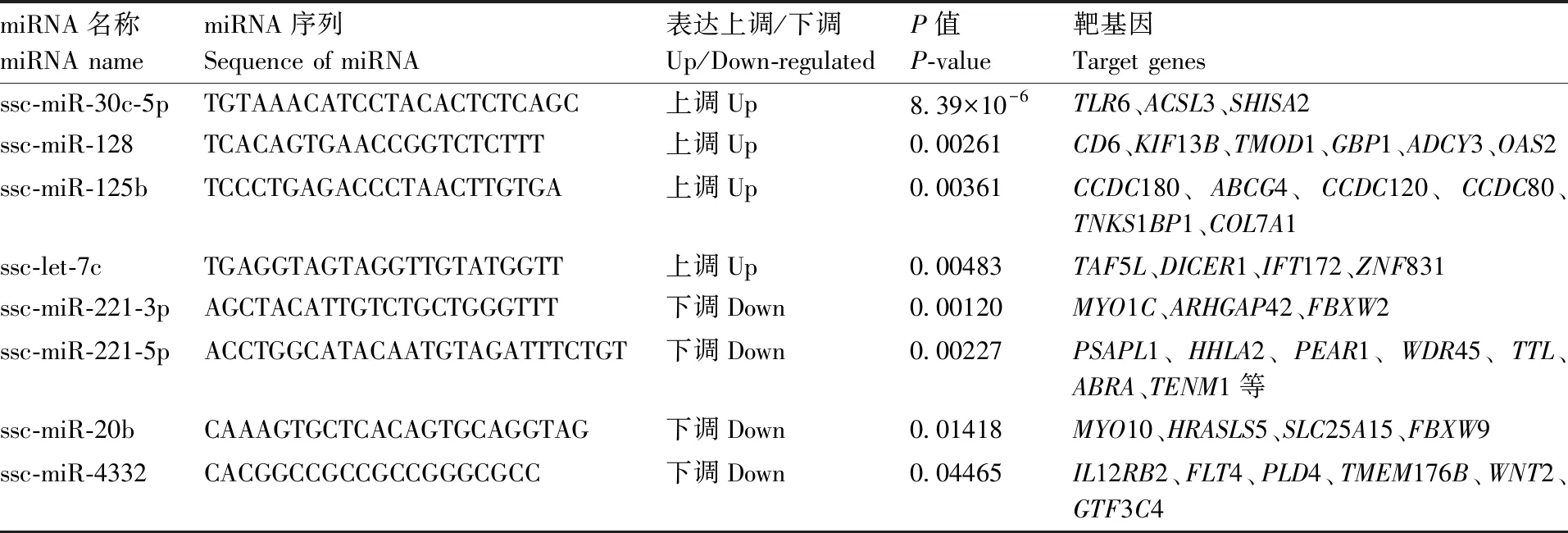
miRNA名称miRNA namemiRNA序列Sequence of miRNA表达上调/下调Up/Down-regulatedP值P-value靶基因Target genesssc-miR-30c-5pTGTAAACATCCTACACTCTCAGC上调Up8.39×10-6TLR6、ACSL3、SHISA2ssc-miR-128TCACAGTGAACCGGTCTCTTT上调Up0.00261CD6、KIF13B、TMOD1、GBP1、ADCY3、OAS2ssc-miR-125bTCCCTGAGACCCTAACTTGTGA上调Up0.00361CCDC180、ABCG4、CCDC120、CCDC80、TNKS1BP1、COL7A1ssc-let-7cTGAGGTAGTAGGTTGTATGGTT上调Up0.00483TAF5L、DICER1、IFT172、ZNF831ssc-miR-221-3pAGCTACATTGTCTGCTGGGTTT下调Down0.00120MYO1C、ARHGAP42、FBXW2ssc-miR-221-5pACCTGGCATACAATGTAGATTTCTGT下调Down0.00227PSAPL1、HHLA2、PEAR1、WDR45、TTL、ABRA、TENM1等ssc-miR-20bCAAAGTGCTCACAGTGCAGGTAG下调Down0.01418MYO10、HRASLS5、SLC25A15、FBXW9ssc-miR-4332CACGGCCGCCGCCGGGCGCC下调Down0.04465IL12RB2、FLT4、PLD4、TMEM176B、WNT2、GTF3C4
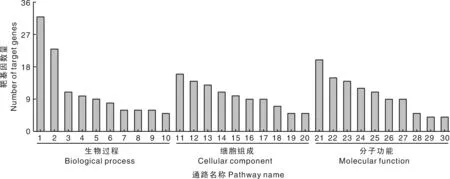
1,蛋白质稳定化;2,肺发育;3,中胚层细胞分化;4,JUN激酶的激活;5,组蛋白H3-K27去甲基化;6,膜蛋白水解;7,蛋白质异源三聚体化;8,细胞内雌激素受体信号通路的阳性调节;9,MAPKKK活性激活;10,细胞凋亡的执行阶段;11,网格蛋白包衣核;12,组蛋白甲基转移酶复合物;13,应激纤维;14,皮质细胞骨架;15,肌球蛋白复合物;16,组蛋白乙酰转移酶复合物;17,BAT3复合物;18,Ada2Gcn5Ada3转录激活复合物;19,核包膜腔;20,MLL5-L复合物;21,p53结合;22,细胞外基质结构成分;23,RNA聚合酶Ⅱ转录辅因子活性;24,肌动活动;25,蛋白质错折叠结合;26,组蛋白脱甲基酶活性(H3-K27特异性);27,转录激活物活性,RNA聚合酶Ⅱ远端增强子序列特异性结合;28,信号适配活性;29,微管负端结合;30,C-X-C趋化因子受体活性。1, Protein stabilization; 2, Lung development; 3, Mesodermal cell differentiation; 4, Activation of JUN kinase activity; 5, Histone H3-K27 demethylation; 6, Membrane protein proteolysis; 7, Protein heterotrimerization; 8, Positive regulation of intracellular estrogen receptor signaling pathway; 9, Activation of MAPKKK activity; 10, Execution phase of apoptosis; 11, Clathrin-coated pit; 12, Histone methyltransferase complex; 13, Stress fiber; 14, Cortical cytoskeleton; 15, Myosin complex; 16, Histone acetyltransferase complex; 17, BAT3 complex; 18, Ada2Gcn5Ada3 transcription activator complex; 19, Nuclear envelope lumen; 20, MLL5-L complex; 21, p53 binding; 22, Extracellular matrix structural constituent; 23, RNA polymerase II transcription cofactor activity; 24, Motor activity; 25, Misfolded protein binding; 26, Histone demethylase activity (H3-K27 specific); 27, Transcriptional activator activity, RNA polymerase II distal enhancer sequence-specific binding; 28, Signaling adaptor activity; 29, Microtubule minus-end binding; 30, C-X-C chemokine receptor activity.图4 差异表达miRNA靶基因的GO分析Fig.4 GO analysis of differentially expressed miRNA target genes
3 讨论
miRNA广泛存在于动植物中,属于一种长度22 nt左右的内源性非编码单链小RNA,miRNA可通过转录后调控基因的表达,在动物免疫反应中发挥着重要作用[8],因此,对感染动物免疫组织miRNA表达谱的研究可揭示动物进行免疫反应的遗传基础。本实验重点研究地方猪种姜曲海猪感染肺炎支原体后,分析其病原的靶向组织肺组织中miRNA表达谱,探讨miRNA及其预测的靶基因在姜曲海猪抗肺炎支原体感染中表达情况,揭示其免疫应答反应的遗传基础,为进一步研究miRNA在抗病过程中的作用机理奠定基础。
表4 差异表达miRNA靶基因的KEGG分析
Table4KEGG analysis of differentially expressed miRNA target genes

序号No.通路编码Pathway ID通路名称Name of pathway基因数量Number of genesP值P-value1path:ssc00514O-聚糖生物合成的其他类型 Other types of O-glycan biosynthesis141.11×10-62path:ssc04911胰岛素分泌 Insulin secretion220.0012953path:ssc04210细胞凋亡 Apoptosis340.0016644path:ssc04925醛固酮的合成和分泌 Aldosterone synthesis and secretion200.0017335path:ssc04915雌激素信号通路 Estrogen signaling pathway240.002626path:ssc04122硫磺中继系统 Sulfur relay system40.002797path:ssc04512ECM受体相互作用 ECM-receptor interaction250.0030278path:ssc04913卵巢类固醇生成 Ovarian steroidogenesis170.0039119path:ssc04022cGMP-PKG信号通路 cGMP-PKG signaling pathway330.00406810path:ssc04918甲状腺激素合成 Thyroid hormone synthesis190.00412811path:ssc04510粘着斑 Focal adhesion470.00507712path:ssc04921催产素信号通路 Oxytocin signaling pathway330.00511413path:ssc04740嗅觉传导 Olfactory transduction120.00515314path:ssc05216甲状腺癌 Thyroid cancer100.0064615path:ssc00061脂肪酸生物合成 Fatty acid biosynthesis50.00734416path:ssc05211肾细胞癌 Renal cell carcinoma190.00786217path:ssc04974蛋白质消化吸收 Protein digestion and absorption180.00923118path:ssc00524布地罗辛与新霉素生物合成 Butirosin and neomycin biosynthesis40.00967219path:ssc05206癌症microRNAs microRNAs in cancer320.01128320path:ssc00534糖胺聚糖生物合成 Glycosaminoglycan biosynthesis60.011488
高通量测序发现,姜曲海猪感染肺炎支原体28 d后,感染组肺组织获得14 265 786条纯净序列,对照组肺组织获得14 000 588条纯净序列,感染组相对于对照组筛选出73个显著差异表达的miRNAs,其中,8个与免疫相关的miRNAs,包括ssc-miR-30c-5p、ssc-miR-128、ssc-miR-125b、ssc-let-7c、ssc-miR-221-3p、ssc-miR-221-5p、ssc-miR-20b、ssc-miR-20b、ssc-miR-4332等。现有研究发现,miR-let-7家族可以参与调控机体对病原免疫应答反应[9],其中,miR-let-7c通过靶向调控STAT3基因从而可调控肺泡巨噬细胞的炎症反应[16]。miR-125b通过结合B淋巴细胞,调节IFN基因表达,从而调控细胞凋亡和分化[17]。miR-128在呼吸道上皮细胞中可以调控靶向基因IL-6的表达,影响呼吸道疾病的免疫反应[18]。免疫相关miRNAs的筛选结果提示,miRNA在猪感染肺炎支原体后的机体免疫反应中发挥重要的调控作用。
感染组中筛选到与免疫相关的miRNA进行靶基因预测,结果预测到TLR6、CD6、CCDC180、CCDC120、HHLA2、IL12RB2、WNT2等免疫相关的基因。TLR6、CD6、HHLA2是动物机体免疫反应的关键基因,TLR6是Toll样受体家族的重要成员,定位于细胞表面,可识别机体病原,并激活跨膜信号分子,激活传递机体免疫及炎症级联反应[3,19]。方晓敏等[14]利用基因芯片技术分析人工感染肺炎支原体后的猪肺组织mRNA表达谱,发现Toll样受体在肺炎支原体感染的炎症反应调控过程中发挥重要作用。CD6是T淋巴细胞外膜上的一种蛋白质,对T细胞激活的持续起重要作用,与炎症性疾病相关[20]。HHLA2是单核细胞表面的蛋白质配体,通过结合T淋巴细胞上的受体并抑制这些细胞的增殖来调节细胞介导的免疫反应[21]。因此,靶基因预测结果提示miRNA可以通过调控靶向免疫基因的表达来调控机体的免疫反应。
通过预测靶基因的GO分析,发现miRNA广泛参与生物过程、细胞组成和分子功能的调控,其中,细胞凋亡的执行、MAPKKK活性的激活、C-X-C趋化因子受体活性等表现活跃。通过对靶基因的KEGG分析,发现细胞凋亡、ECM受体相互作用、粘附斑通路等信号通路呈现活跃状态。相关研究报道,ECM受体相互作用、粘附斑通路是病原识别过程,抗原递呈加工过程和免疫应答过程中的重要信号通路[22-23]。因此,差异表达miRNA在猪感染肺炎支原体过程中,很可能参与调控机体病原识别、抗原递呈、免疫应答等免疫反应过程。另外,病原感染机体后,细胞凋亡通路的启动是机体自我保护的功能,能有效阻止病原的繁殖和增殖[24]。已有实验证实,肺炎支原体感染猪的组织或细胞后,细胞凋亡、粘附斑通路等信号通路表现活跃,并参与调控免疫反应[14,25]。因此,通过对预测靶基因功能以及相关信号通路分析,揭示miRNA在猪感染肺炎支原体过程中可以参与调控免疫相关信号通路来调节机体的免疫反应。
综上所述,本研究使用高通量测序技术获得姜曲海猪人工感染肺炎支原体28 d后肺组织miRNA表达谱,通过生物信息学分析筛选到与免疫调控相关的miRNAs,预测靶基因功能分析发现miRNA参与调控感染肺炎支原体机体免疫应答反应过程中的信号通路。由于miRNA在免疫调控的研究还处于起步阶段,其作用机制还未清楚,miRNA功能和作用机制还需进一步研究和验证。

