瑞芬太尼对脓毒症大鼠急性肺损伤保护作用的实验研究
张贝蕾 廖秀玉▲ 林建东 刘名法 吴 越 杨闽霞
1.福建医科大学附属第一医院重症医学科,福建福州 350005;2.福州长乐区医院内科,福建福州 350200
急性肺损伤和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)在脓毒症中非常常见,也是导致重症监护室患者死亡的首要原因。瑞芬太尼是一种μ 受体激动剂,目前被广泛使用在ICU 危重患者的镇静镇痛治疗中,研究发现在脓毒症时,瑞芬太尼有着抗炎的作用,但是其具体机制尚不清楚。本文拟通过ELISA 测定脓毒症急性肺损伤大鼠肺组织炎症因子TNF-α、IL-6 水平并测定肺组织氧化应激指标SOD 活性及MDA 的水平,以阐明瑞芬太尼对脓毒症急性肺损伤的保护作用。
1 材料与方法
1.1 实验动物和材料
雄性清洁级Wistar 大鼠32 只,体质量270 ~320g,上海斯莱克实验动物有限公司。瑞芬太尼(规格:1mg,江苏恒瑞制药厂,H20030197),乌拉坦Urethane(Sigma-Aldrich),TNF-α 和IL-6 测试盒(solarbio 有限公司),MDA 和SOD 测试盒(南京建成生物工程研究所),脂多糖LPS(Escherichia coli O127:B8,Sigma,St. Quentin Fallavier,France)。
1.2 动物分组和模型制备
大鼠按随机数字表法分为四组,即对照组、ALI组、瑞芬太尼处理组、瑞芬太尼对照组(每组8 只)。采用LPS 诱导制备脓毒症急性肺损伤模型,大鼠常规禁食6h,不禁饮。乌拉坦腹腔注射诱导麻醉大鼠,将其放置于变温毯上俯卧,维持体温(36±0.1)℃。除乌拉坦经腹腔注射外,瑞芬太尼和LPS 均通过尾静脉注射。具体给药方式如下:ALI 组给予LPS 15mg/kg 尾静脉注射(20min 注射完毕),对照组用相同量的生理盐水代替;瑞芬太尼处理组,首先注射LPS 15mg/kg,20min 后给予瑞芬太尼(0.04mg/kg),40min 注射完毕。瑞芬太尼对照组先给予与LPS 等量生理盐注射,20min 后再给予瑞芬太尼(0.04mg/kg)40min 注射完毕。所有组予生理盐水液体复苏,总补液量为5mL/h,在2h 内注射完毕。
1.3 标本的留取
造模成功6h 后打开胸腔,取右肺上叶,用滤纸吸干肺表面的水分,称湿重后,恒温干燥箱85℃烘烤48h,称干重,计算W/D。右肺部分组织,用10%福尔马林固定,石蜡包埋,切片,行HE 染色,光镜下进行组织病理学评估;右肺部分组织,-80℃低温冰箱保存,用于EILSA 检测TNF-α、IL-6 的水平及MPO、SOD 检测。
1.4 TNF-α、IL-6、MDA和SOD检测
采用酶联免疫分析法(ELISA)检测TNF-α和IL-6,具体按照操作试剂盒说明书进行。采用黄嘌呤氧化酶法检测SOD 的含量和活性,用硫代巴比妥酶法测定MDA 的含量,具体按照操作试剂盒说明书进行,肺组织中的SOD、MDA 含量按照公式计算,考马斯亮蓝检测蛋白含量。
1.5 统计学方法
采用统计学软件SPSS18.0 对数据进行统计分析,计量资料以(s)表示,采用单因素方差分析,组间两两比较采用SNK 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠肺组织TNF-α和IL-6的表达
LPS 注 射 后6h,LPS 致ALI 组 大 鼠 肺 组 织 中TNF-α 和IL-6 水平显著高于对照组(P 均<0.05),而瑞芬太尼处理组大鼠的TNF-α 和IL-6 平显著低于ALI 组(P 均<0.05),见表1。
表1 各组大鼠肺组织TNF-α和IL-6的水平 s,pg/mL)
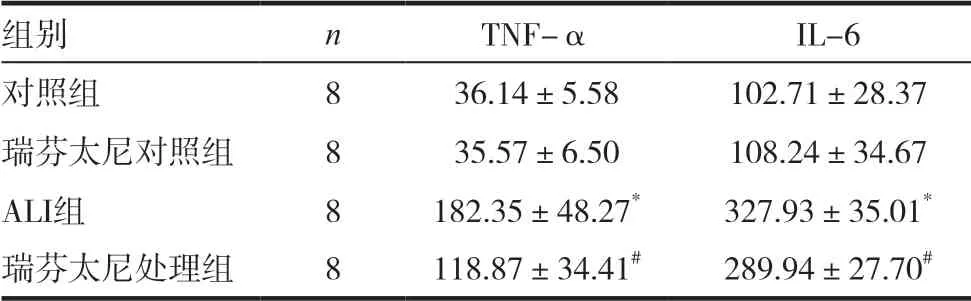
表1 各组大鼠肺组织TNF-α和IL-6的水平 s,pg/mL)
注:与对照组比较,*P <0.05;与ALI 组比较,#P <0.05
2.2 大鼠肺组织SOD、MDA水平
与对照组相比,ALI 组肺干湿比明显升高,肺组织匀浆MDA 水平升高,而SOD 水平显著降低(P 均<0.05),提示LPS 导致肺组织水肿,肺部受氧自由基攻击的严重程度增加,而清除氧自由基的能力减弱。与ALI 组相比,瑞芬太尼处理组大鼠肺湿干比重、肺组织匀浆MDA 水平显著降低,SOD 水平则显著升高(P 均<0.05),提示瑞芬太尼可以改善脓毒症ALI 肺组织的抗氧化能力。见表2。
表2 各组大鼠肺湿干比重和肺组织MDA、SOD的水平
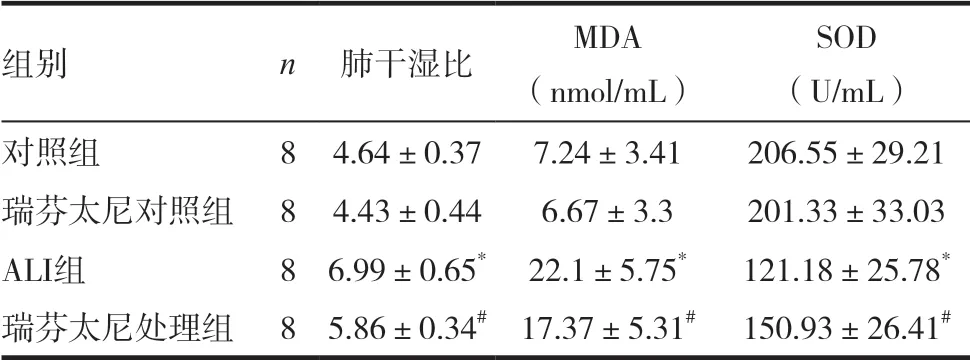
表2 各组大鼠肺湿干比重和肺组织MDA、SOD的水平
注:与对照组比较,*P <0.05;与ALI 组比较,#P <0.05
2.3 病理学改变
肺脏的病理损伤轻重分度参照等SU 的方法评判。由两位病理科医师对每张切片随机选择在高倍视野进行观察。显微镜下急性肺损伤定义为中性粒细胞浸润、间质水肿、出血、透明膜形成、坏死和充血。肺损伤严重度评分标准:(1)正常;(2)极轻度(<25%);(3)轻度(25%~49%);(4)中度(50%~75%);(5)重度(>75%)。根据上述标准进行肺脏病理学评分,两位医师采用双盲法的评分结果计算平均分后作为大鼠肺部损伤的病理评分。
ALI 组大鼠的肺组织体积増大,色泽暗红甚至发黑,可有淡红色血性液体渗出。肺组织石蜡切片HE 染色光镜显示(图1 ~4),对照组大鼠肺组织结构完整,形态正常,肺泡腔清晰,腔内无渗液,肺泡壁光滑,肺泡和肺间质无炎症细胞浸润。ALI 组肺组织结构损伤严重,肺泡隔增宽,肺泡膨胀不全,部分塌陷或有肺泡融合,无法辨别肺泡结构,可见大量炎性细胞聚集,毛细血管扩张充血,管腔内可见大量红细胞。而瑞芬太尼处理组大鼠的肺组织上述病理学改变则明显减轻。
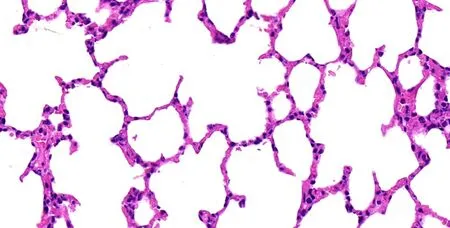
图1 对照组肺组织病理学(HE 染色×400 倍)

图2 瑞芬太尼对照组肺组织病理学(HE 染色×400 倍)
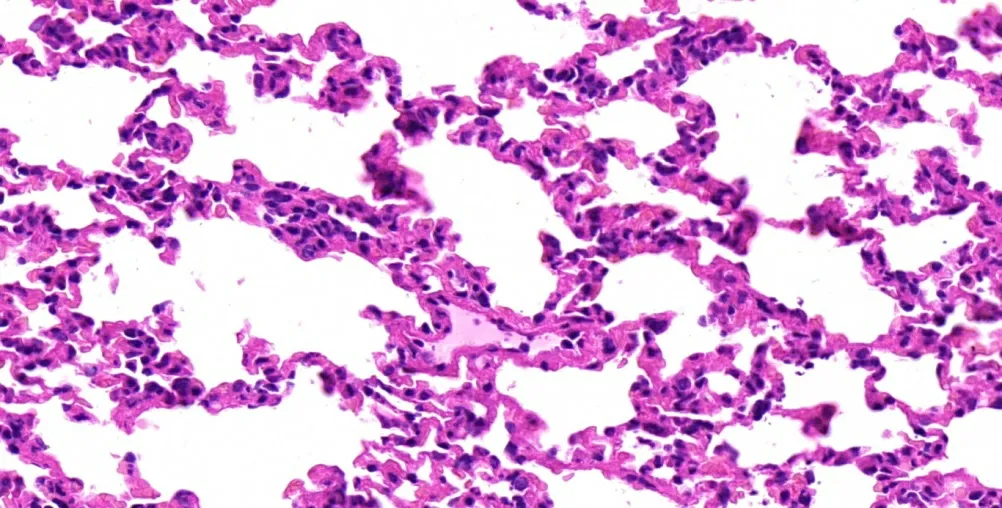
图3 瑞芬太尼处理组肺组织病理学(HE 染色×400 倍)
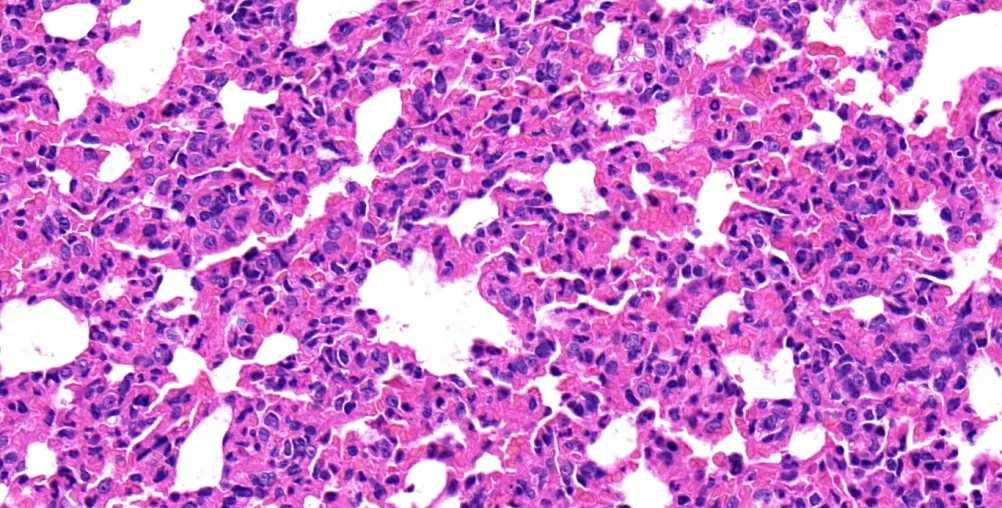
图4 ALI 组肺组织病理学(HE 染色×400 倍)
3 讨论
在脓毒症发展到全身脏器功能衰竭综合征(MODS)的过程中,肺经常是第一个受到累及的脏器[1-2]。脓毒症相关的ALI/ARDS 起病迅速且极其危重,是脓毒症发病率和死亡率最高的临床综合征[3]。超过50%的脓毒症为革兰氏阴性菌引起的,内毒素是构成革兰氏阴性杆菌外膜的主要成分,能够触发一系列瀑布式级联炎症反应,导致机体产生大量的促炎细胞因子,具有极强的诱导脓毒症的能力。LPS 诱导的脓毒症模型是公认的与临床相关性较强的脓毒症模型,广泛用于脓毒症发病机制的研究。本研究通过静脉注射LPS 诱导大鼠产生脓毒症急性肺损伤,发现ALI 组大鼠肺组织结构损伤严重,肺泡隔增宽,肺泡膨胀不全,部分塌陷或有肺泡融合,可见大量炎性细胞聚集。符合ALI 的病理学改变,而瑞芬太尼处理组大鼠的肺组织上述病理学改变则相对减轻。肺泡结构破坏可见少量破坏,大部分结构完整,肺间质仅见轻微水肿,肺泡腔内及间质中红细胞的渗出及炎性细胞的浸润均较ALI 组轻。
ALI 的发病机制尚未完全阐明,目前认为全身炎症反应在ALI/ARDS 的发生和发展中起关键作用[4-7]。内毒素通过活化巨噬细胞及单核细胞,导致瀑布式的炎症级联反应,产生并释放大量的炎症介质如白细胞介素、TNF-α,导致肺泡上皮细胞和肺毛细血管上皮细胞损伤,肺血屏障功能障碍,最终导致间质性水肿与肺泡性水肿,以及肺泡内透明膜形成,从而导致脓毒症发展成ALI/ARDS。在ALI的发展过程中最主要的炎症细胞因子包括TNF-α和IL-6[8]。TNF-α 是介导内毒素休克、全身的炎症反应综合征(systemic inflammatory response syndrome,SIRS)、ARDS 和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的重要起始因子[9-10],其能导致通过使溶酶体受损导致酶外泄、刺激血管内皮细胞、上调肺血管内皮细胞间粘附分子-1、促使白细胞迁移至炎症部位、诱导内皮细胞和巨噬细胞合成、释放IL-1、IL-6、IL-8、释放过氧化物和溶酶体,促进炎症反应、促进花生四烯酸的代谢和脂类介质的产生,促进微血栓形成等多种途径导致肺损伤[11-13]。IL-6 也是一种重要的致炎炎症因子,在急性肺损伤/急性呼吸窘迫综合征患者肺部和血液中大量分泌,含量明显高于健康人,能够反应肺组织的损伤程度。IL-6 参与巨噬细胞的分化和浸润,能够通过激活补体及C 反应蛋白的表达,诱导产生黏附分子,激活血管内皮细胞及淋巴细胞,参与时肺损伤的急性期反应[14-15]。因此抑制细胞因的产生是治疗炎症性疾病的有效手段。本研究表明LPS 可以导致TNF-α 和IL-6 水平显著升高,而瑞芬太尼能够通过增加显著降低促炎因子TNF-α和IL-6 的水平,减轻脓毒症诱导的ALI。
在脓毒症的发病及发展过程中,氧自由基所导致的氧化还原损伤是造成肺泡结构破坏和功能障碍的重要原因。在ALI/ARDS 的发病机制中机体特别是肺内的氧化/抗氧化平衡失调起主要作用[16-18]。脓毒症时大量氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化从而形成大量脂质过氧化产物MDA,MDA 是脂质过氧化物的一种,是氧化应激和抗氧化剂状态的标志物,MDA 的量可以反应机体受氧自由基攻击的严重程度。而SOD 是生物体内氧自由基的天然清除剂,能清除体内超氧阴离子、自由基保护细胞免受损伤, SOD 的高低可以间接反映机体清除氧自由基的能力,对机体的氧化与抗氧化平衡起着至关重要的作用。SOD 和MDA 联合检测能很好反应氧化应激状态,能够代表组织损伤程度[9]。本研究发现,与对照组相比ALI 组MDA显著增加而SOD 下降,提示LPS 导致肺组织产生氧化应激损伤。而瑞芬太尼能够上调SOD 并且降低MDA 的含量,提示瑞芬太尼可以通过减少氧自由基的产生并提高机体的抗氧化能力,抑制LPS 导致的氧化应激损伤,对ALI 有保护作用。
综上所述,瑞芬太尼能够通过减少抗炎细胞因子的的表达,并通过抗氧化应激途径对LPS 导致的ALI 起到保护作用。

