Orai2对成骨细胞增殖、凋亡及分化的作用研究
郭云山,郝定均,王晓东,胡慧敏,姜扩,黄研生,杨小卫
(西安交通大学附属红会医院脊柱外科,陕西 西安 710054)
骨质疏松症是一类常见的骨骼系统退行性疾病,严重影响老年人的健康。成骨细胞增殖减少、凋亡增加以及分化异常是骨质疏松症发生发展的重要原因[1-5]。因此,深入研究成骨细胞增殖、凋亡及分化的调控机制,发现并鉴定在骨形成过程中具有成骨作用的关键调控分子,将为临床骨质疏松症的生物治疗提供新的方法。Orai是一类细胞膜上的钙通道蛋白,包括Orai1蛋白和Orai2蛋白。研究发现缺失钙通道蛋白Orai1基因会导致小鼠骨密度降低等骨质疏松症的表型,提示钙通道蛋白Orai1参与骨质疏松症的发生过程[6-9]。然而,目前尚无钙通道蛋白Orai2参与骨质疏松症发生发展的相关报道。本研究从Orai2调控成骨细胞的增殖、凋亡以及分化入手,研究Orai2在骨质疏松症发生中的作用,以期更为全面地认识骨质疏松症发生发展的病理过程。
1 资料与方法
1.1 材料 Orai2干涉片段购自上海生工公司,Orai2、Runx2和Osterix的引物全部从上海生工公司购买,RPMI1640细胞培养液从美国GIBCO BRL公司购买,四氮唑蓝(MTT)从中国碧云天试剂公司购买,Real-time PCR试剂盒从美国invitrogen公司购买,Annexin V/PI试剂盒从美国Abcam公司购买,流式细胞仪和Real-time PCR仪从美国BIO-RAD公司购买。
1.2 方法
1.2.1 Real-Time PCR 小鼠成骨细胞系MC3T3-E1分别转染靶向Orai2的shRNA和空白对照shRNA后,将MC3T3-E1成骨细胞分为对照组和Orai2 shRNA组。对应时间节点将对照组和Orai2 shRNA组收集到2 mL离心管。然后用Trizol法提取细胞总RNA,再将细胞总RNA反转录成cDNA,具体步骤如下:在离心管中加入2 μL的模板RNA溶液、1 μL的Oligo dT primer溶液、2 μL dNTP mixture溶液、1 μL Ace反转录酶溶液、1 μL RNase inhibitor溶液、4 μL RT buffer溶液,10 μL RNase-free水。反应条件:第一步37 ℃ 30 min,第二步84 ℃ 30 s。反应产物4 ℃保存。然后进行实时定量PCR反应。反应条件:12.5 μL RealMasterMix溶液、2 μL模板cDNA溶液、1 μL正向引物溶液、1 μL反向引物溶液、8.5 μL RNase-free水。反应条件为:第一步94 ℃ 5 min;第二步94 ℃ 60 s、57 ℃ 30 s、72 ℃ 30 s,共30个循环;第三步72 ℃ 5 min;最后4 ℃结束反应。
1.2.2 免疫印记实验 对照组和Orai2 shRNA组待检测细胞裂解后进行总蛋白定量,然后取等量的细胞裂解样品进行SDS电泳90 min,取下SDS凝胶转膜45 min,然后脱脂奶粉封闭约30 min。洗膜4次后在膜上滴加Orai2的抗体孵育90 min,再次洗膜4次。然后加入相应辣根过氧化物酶(和horseradish peroxidase,HPR)标记二抗。在聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上滴加适量化学发光液,然后将PVDF膜置于胶片盒中,曝光适当时间后,进行拍照与定量。
1.2.3 细胞周期检测 对照组和Orai2 shRNA组细胞培养于无血清培养基24 h后,在细胞培养中10%胎牛血清(fetal bovine serum,FBS),然后继续培养细胞。24 h后将细胞收集至离心管,用磷酸盐平衡生理盐水(public broadcasting service,PBS)洗涤3次后弃上清离心液。然后用1 mL无水乙醇重悬细胞。将细胞置于4 ℃冰箱中过夜。PBS洗涤细胞3次。然后在细胞中加入500 μL的PI染料重悬细胞。将细胞置于4 ℃冰箱中染色40~60min。最后,用流式细胞仪检测细胞周期,并统计学分析实验数据。
1.2.4 Annexin V/PI双染检测细胞凋亡 对照组和Orai2 shRNA组待检测细胞用胰蛋白酶处理,然后收集至离心管并离心,用PBS重悬细胞。行细胞计数后取出1×105个细胞,再次离心弃上清液。细胞中先后加入400 μL的Annexin V-FITC检测液,充分混匀并重悬细胞。将细胞置于37 ℃孵箱避光静置约30 min。离心弃上清后,加入400 μL PBS轻轻重悬待检测细胞,并加入10μL的PI,充分混合均匀,静置在冰盒中20 min。然后用流式细胞仪检测并统计分析细胞凋亡情况。
1.2.5 MTT法检测细胞增殖 收集对照组和Orai2 shRNA组细胞至离心管;弃上清液后重悬细胞,然后进行细胞计数,取1×104/mL细胞悬液100 μL滴加到96孔细胞培养板中。分别培养24 h、48 h、64 h后,弃上清液在细胞培养板的每个孔中滴加50 μL MTT和150 μL细胞培养基。然后将细胞培养板在37 ℃静置。4 h后弃上清,再在细胞培养板的每个孔中滴加200 μL的DMSO溶液溶解MTT 30 min。最后,用酶标仪在570 nm测各个孔的吸光值并统计学分析实验数据。

2 结 果
2.1 应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中沉默Orai2的表达 为了明确Orai2在骨形成过程中是否发挥作用,我们在成骨诱导条件下用Western blot和Real-Time PCR的方法检测Orai2的mRNA转录和蛋白表达。Western blot检测结果发现,成骨诱导后第7天、第14天和第21天,Orai2的蛋白表达水平是逐渐增加的,结果差异有统计学意义(见图1)。同样,Real-Time PCR的结果也发现,成骨诱导后第7天、第14天和第21天,Orai2的mRNA转录水平也是逐渐增加的,结果差异有统计学意义(见图2)。以上结果发现成骨细胞分化过程中Orai2的蛋白表达水平逐渐增加,提示:Orai2可能在骨形成过程中发挥了作用。然后我们用Western blot和Real-Time PCR的方法检测转染了靶向Orai2的shRNA后Orai2的表达。Western blot检测结果发现,在转染了靶向Orai2的shRNA后,Orai2的蛋白表达出现了明显降低,结果差异有统计学意义(见图3)。同样,Real-Time PCR的结果也发现,在转染了靶向Orai2的shRNA后,Orai2的mRNA转录水平出现了显著降低,结果差异有统计学意义(见图4)。以上结果提示:我们应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中可成功沉默Orai2的表达。
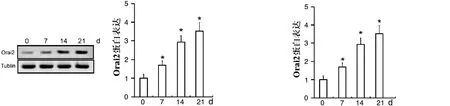
注:*表示与成骨诱导后0 d比较,差异有统计学意义 注:*表示与成骨诱导后0 d比较,差异有统计学意义图1 成骨诱导后0、7、14、21 d,检测成骨细胞Orai2蛋白表达水平 图2 成骨诱导后0、7、14、21 d,检测成骨细胞Orai2 mRNA转录水平

注:*表示与对照组比较,差异有统计学意义 注:*表示与对照组比较,差异有统计学意义图3 细胞转染Orai2 shRNA后,检测成骨细胞Orai2蛋白表达水平 图4 细胞转染Orai2 shRNA后,检测成骨细胞Orai2 mRNA转录水平
2.2 沉默Orai2表达抑制成骨细胞增殖 为了研究Orai2能否参与调控成骨细胞的增殖能力,我们应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中沉默Orai2的表达后,应用MTT法检测成骨细胞增殖能力的变化。研究发现,与转染无关干涉片段的对照组相比较,沉默Orai2表达后,成骨细胞的增殖能力明显降低,结果差异有统计学意义(见图5)。为了进一步明确Orai2能否参与调控成骨细胞的增殖,我们采用PI染色,流式细胞仪检测成骨细胞在沉默Orai2表达后细胞周期的变化。结果发现,与转染无关干涉片段的对照组相比较,沉默Orai2表达后,细胞周期的G0/G1期明显增加,而细胞周期的S期明显减少,结果差异有统计学意义(见图6)。以上结果证实,沉默Orai2的表达可在成骨细胞抑制DNA合成,减少细胞进入S期,抑制成骨细胞的增殖,从而导致成骨细胞的数量减少。
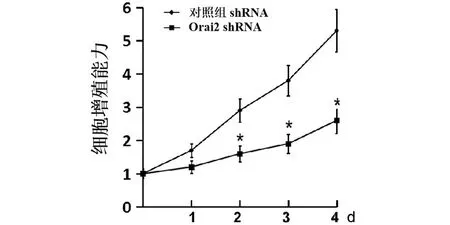
注:*表示与对照组比较,差异有统计学意义图5 细胞转染Orai2 shRNA后0、1、2、3、4 d,MTT法检测Orai2对细胞增殖能力的影响
2.3 沉默Orai2表达促进成骨细胞凋亡 为了研究Orai2的表达异常可否参与成骨细胞凋亡的调控,我们应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中成功沉默Orai2的表达后,采用PI/AnnexinⅤ法检测成骨细胞凋亡的变化。结果发现,与转染无关干涉片段的对照组相比较,沉默Orai2表达后,细胞的凋亡比例明显增加,并且差异有统计学意义(见图7,P<0.05)。以上结果提示:沉默Orai2的表达可在成骨细胞促进其细胞凋亡,从而导致成骨细胞的数量减少。
2.4 沉默Orai2表达抑制成骨细胞的分化 成骨细胞分化抑制导致成骨细胞数量减少也是骨质疏松症发生发展的重要原因。Runt相关转录因子2(runt-related transcription factor2,Runx2)和锌指结构转录因子(osterix)是反映成骨
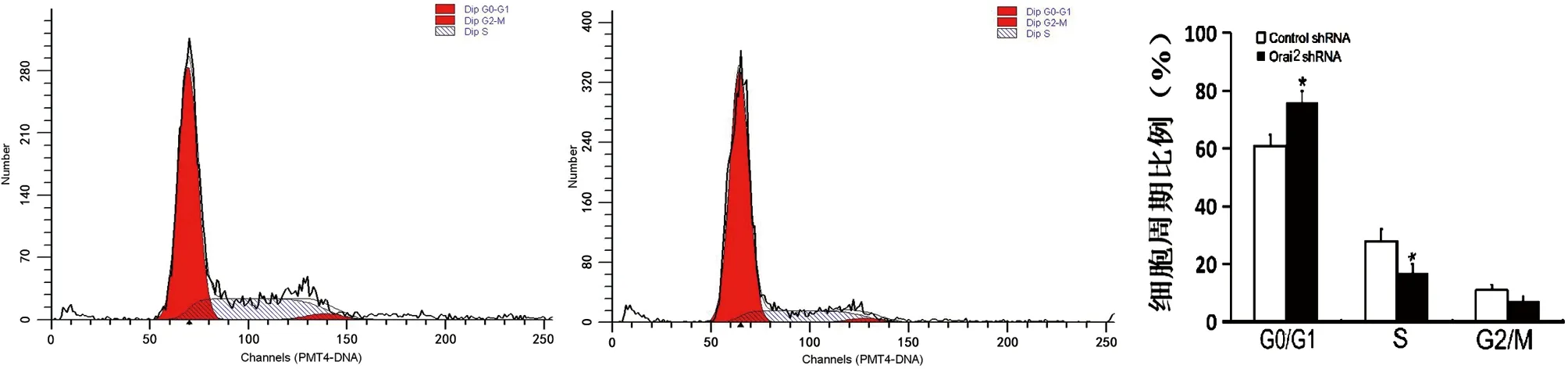
注:*表示与对照组比较,差异有统计学意义图6 细胞转染Orai2 shRNA后,检测Orai2对成骨细胞细胞周期的影响
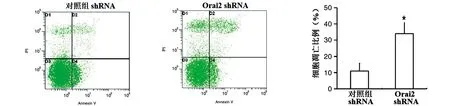
注:*表示与对照组比较,差异有统计学意义图7 细胞转染Orai2 shRNA后,检测Orai2对成骨细胞凋亡影响
细胞成骨分化能力的关键转录因子[10-12]。为了研究Orai2可否参与成骨细胞分化的调控,我们应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中成功沉默Orai2的表达后,分别在成骨诱导后第7天、14天和21天采用Real Time-PCR方法检测细胞中Runx2和Osterix这两个关键转录因子的mRNA转录水平。结果显示,与转染无关干涉片段的对照组相比较,沉默Orai2表达后,成骨细胞Runx2和Osterix的mRNA转录水平都明显降低,结果差异有统计学意义(见图8)。碱性磷酸酶(alkaline phosphatase,ALP)是反映成骨分化的另一重要指标,随着成骨细胞分化程度的增加,碱性磷酸酶的表达也随之增加。为了进一步明确Orai2在成骨细胞分化过程中的作用,我们用Real-Time PCR的方法检测了在成骨过程中Orai2对碱性磷酸酶转录的影响。我们发现在成骨分化的早期和晚期,沉默Orai2表达都会显著抑制碱性磷酸酶的转录,结果差异有统计学意义。提示:沉默Orai2的表达可在成骨分化的早期和晚期都明显抑制成骨细胞的成骨分化能力(见图9,P<0.05)。这些结果证实沉默Orai2的表达可明显抑制成骨细胞的成骨分化能力,从而导致成骨细胞的数量减少。
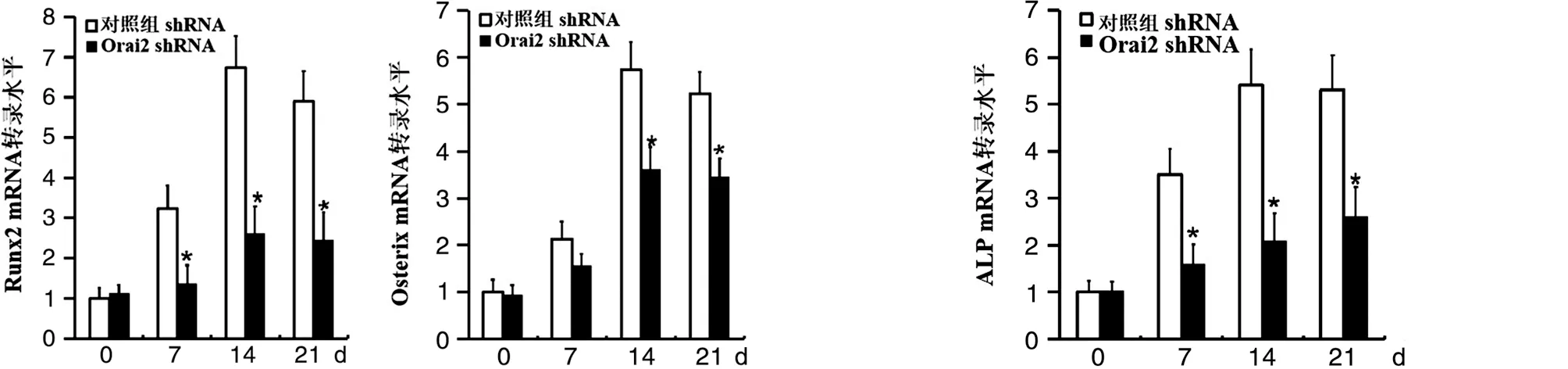
注:*表示与对照组比较,差异有统计学意义 注:*表示与对照组比较,差异有统计学意义图8 Real-Time PCR检测转染Orai2对Runx2和Osterix mRNA转录水平的影响 图9 Real-Time PCR检测转染Orai2对碱性磷酸酶(ALP)的mRNA转录水平的影响
2.5 沉默Orai2表达抑制成骨细胞Ras-ERK1/2信号通路活性 已有研究发现抑制Ras-ERK1/2信号通路后,成骨细胞会出现增殖减少、凋亡增加以及分化异常等现象。Orai2是定位于细胞膜上的一类介导受体依赖型钙离子通道,它的主要功能是介导受体依赖型的钙离子内流。钙离子进入细胞后会发挥第二信使的作用调控细胞增殖、分化、凋亡等细胞功能。研究发现,钙离子作为第二信使能直接与Ras-GTP结合而显著增加Ras-ERK1/2信号通路的活性[13-15]。为了研究Orai2在成骨细胞可否激活Ras-ERK1/2信号通路参与调控成骨细胞的增殖、凋亡以及分化等生物学功能,我们应用靶向Orai2的shRNA在MC3T3-E1成骨细胞中成功沉默Orai2的表达后,然后用Western blot检测成骨细胞Ras与ERK1/2的表达与活性。我们发现,与转染无关干涉片段的对照组相比较,沉默Orai2表达后,细胞内Ras与ERK1/2的活性形式Ras-GRF和p-ERK1/2都明显降低,结果差异有统计学意义(见图10)。这些结果证实在成骨细胞沉默Orai2表达可明显抑制Ras-ERK1/2信号通路的活性。
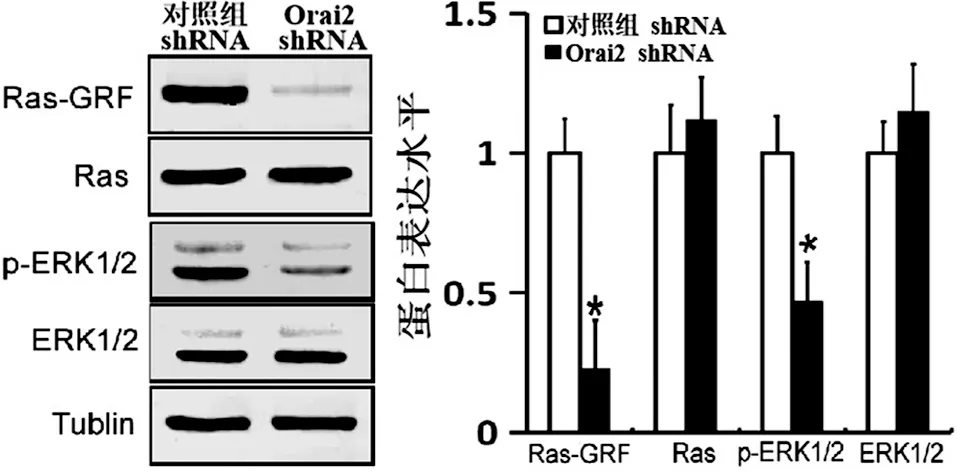
注:*表示与对照组比较,差异有统计学意义图10 细胞转染Orai2 shRNA后,检测Orai2对成骨细胞Ras与ERK1/2的活性的影响
3 讨 论
目前,大量研究证实骨质疏松症发生发展的主要原因包括成骨细胞增殖减少、成骨细胞凋亡增加以及成骨细胞分化异常[1-5]。高度矿化的骨基质由成骨细胞组成。成骨细胞可介导钙和磷酸盐沉积到I型胶原基质。已有研究证实细胞外钙离子浓度增加可以增强体外培养的人间充质干细胞的成骨作用。研究发现,维生素D是钙稳态和骨矿化的主要调节因子,可在体外促进成骨分化[16-18]。当细胞外液的钙离子浓度增加时,成骨细胞的增殖、分化以及细胞外基质钙化等成骨能力都显著增加,并且凋亡减少[19-21]。还有研究发现,骨质疏松症患者,由于破骨细胞过度激活,成骨细胞的细胞外液钙离子水平增加了将近20倍[22]。然而,虽然细胞外液的钙离子水平显著增加,但骨质疏松症患者成骨细胞的成骨能力却仍处于一个较低水平[23-24],其机制未见报道。细胞外液的钙离子从胞外进入胞内是钙离子发挥第二信使作用的主要方式。细胞膜是半通透膜,钙离子不能自由顺浓度梯度扩散,而是需要依赖于细胞膜上的钙离子载体,也被称为钙离子通道。因此,细胞膜上钙离子通道的表达或者功能异常导致钙离子内流减少,可能会是成骨细胞在高钙的细胞外液中却依然处于较低成骨分化能力的原因。
最近发现了一种细胞膜上钙通道Orai蛋白,包括Orai1蛋白和Orai2蛋白,其在钙离子内流过程中发挥了重要的作用。当内质网中的钙储存耗尽时,Orai蛋白被激活,允许快速而短暂的钙离子从胞外流入细胞质,称为钙库操作钙内流。基因敲除Orai1可导致骨骼发育受损,并出现骨量减少,骨矿物质密度降低[6-9]。然而,Orai2对成骨细胞增殖、凋亡及分化的影响尚未见报道,这限制了我们对Orai蛋白在骨生物学中的作用理解。成骨细胞增殖的减少、凋亡的增加以及分化的异常导致成骨细胞数量减少是骨质疏松症的发生发展的重要原因。为了研究Orai2是否通过调控成骨细胞的增殖、凋亡及分化等细胞功能参与骨质疏松症的发生发展,我们在小鼠成骨细胞系MC3T3-E1转染了靶向Orai2的shRNA来沉默Orai2的表达。我们研究发现,在小鼠成骨细胞系MC3T3-E1沉默Orai2的表达后,成骨细胞的增殖明显减少。细胞增殖是通过细胞周期来实现的。细胞周期的S期为DNA合成期,是反映细胞增殖能力的重要指标。为了进一步明确Orai2能否参与调控成骨细胞的增殖,我们在成骨细胞沉默Orai2表达后,检测了细胞周期的变化。结果发现,沉默Orai2表达后,成骨细胞的G0/G1期的细胞比例明显增加,而S期的细胞比例明显减少。这些结果提示抑制Orai2的表达可抑制成骨细胞的增殖,从而减少成骨细胞的数量。细胞凋亡的水平是决定成骨细胞数量的另一重要指标。我们在MC3T3-E1成骨细胞中沉默Orai2的表达后,成骨细胞的凋亡比例明显增加。这提示Orai2的表达可在成骨细胞发挥抗细胞凋亡的作用,从而增加成骨细胞的数量。骨髓间充质干细胞是具有成脂分化、成软骨分化和成骨分化多向分化潜能的多能干细胞。成骨分化能力的降低也会显著减少成骨细胞的数量。Runx2和Osterix是成骨细胞成骨分化的两个关键的特异性转录因子。研究发现,在骨髓间充质干细胞同时或者分别敲除Runx2和Osterix后,都可导致成骨分化抑制或者骨形成不全[10-11]。另有研究发现在Osterix基因敲除小鼠仍可检测到Runx2基因的表达,然而在Runx2基因敲除小鼠中却检测不到Osterix基因的表达。所以,Runx2位于Osterix上游而发挥调控成骨分化的作用。但是Runx2和Osterix在成骨细胞分化过程如何相互作用,目前仍未研究清楚。碱性磷酸酶是反映成骨分化的另一重要指标,随着成骨细胞分化程度的增加,碱性磷酸酶的表达也随之增加[12]。我们研究发现,在小鼠成骨细胞系MC3T3-E1沉默Orai2的表达后,成骨细胞Runx2和Osterix以及碱性磷酸酶的mRNA转录水平都明显降低,提示沉默Orai2的表达可明显抑制成骨细胞的成骨分化能力,从而导致成骨细胞的数量减少。以上研究结果证实,Orai2的表达降低可减少成骨细胞增殖、增加成骨细胞凋亡、抑制成骨分化,从而减少成骨细胞的数量。因此,Orai2对于成骨细胞数量的维持至关重要。研究发现抑制Ras-ERK1/2信号通路后,成骨细胞出现增殖减少、凋亡增加以及分化异常等现象。Orai2是定位于细胞膜上的一类介导受体依赖型钙离子通道,它的主要功能是介导受体依赖型的钙离子内流。钙离子进入细胞后会发挥第二信使的作用而激活多条信号通路调控细胞功能。钙离子作为第二信使能直接与Ras-GTP结合而显著增加Ras-ERK1/2信号通路的活性[13-14]。有研究发现,ERK1/2在成骨细胞内可直接入核结合Runx2启动子区并显著促进Runx2的表达[15]。我们在本研究中发现,在小鼠成骨细胞系MC3T3-E1沉默Orai2的表达后,Ras-ERK1/2信号通路活性明显下降。这说明Orai2的表达抑制可显著降低Ras-ERK1/2信号通路活性,并减少成骨细胞增殖、增加成骨细胞凋亡、抑制成骨分化。
综上所述,我们的研究发现,在成骨细胞中沉默Orai2的表达可导致成骨细胞增殖减少、凋亡增加以及分化抑制,从而减少成骨细胞的数量。Orai2的表达异常或者功能异常可能是导致骨质疏松症发生发展的重要原因。因此,深入研究Orai2在骨质疏松症发生中的作用,可为骨质疏松症的生物治疗提供新的思路。

