脑出血女性患者低骨密度相关危险因素分析
陈南耀
海南省海口市第四人民医院神经内科,海南 海口 571199
与一般人群相比,由于偏瘫、平衡受损、药物的使用、视觉问题、认知能力下降、脑血管意外(ABI)会导致成年人摔倒的风险显著增加[1]。长期肢体活动受限,低维生素D水平和性腺功能减退是最常见导致骨密度(BMD)降低和随后出现骨折的原因[2]。老年脑卒中患者存在维生素D缺乏的风险[2]。如果服用已知可诱导细胞色素P450系统的抗癫痫药物如苯妥英和卡马西平,患有创伤性脑损伤的年轻成人出现代谢性骨病的风险明显增加[3]。这些药物可能会增加维生素D向其无活性形式的转化,从而导致生物活性维生素D减少,小肠钙吸收减少,低钙血症,甲状旁腺素水平增加。继发性垂体功能低下导致性腺功能减退是创伤性脑损伤的常见的并发症[4]。残疾人群中由于骨量降低导致骨折的发病率高于健全人群。与没有任何神经系统疾病的患者相比,需要手术固定髋部骨折的老年卒中患者,术后再次卒中风险较高,术后生存期较短,死亡率增加,住院时间延长,骨折后活动丧失[5]。现在可以评估骨折风险来预防骨折。在任何特定部位使用双能X射线吸收测定法(DXA)进行BMD测量是该部位骨折的单一最佳预测因子,髋部代表具有最大预测能力的部位[6]。BMD低于年龄匹配人群与骨折风险的增加相关,这种关系在绝经后女性中得到最好的证实[6]。本研究的目的是测量ABI患者接受康复治疗后低BMD患病率,并调查影响和预测该人群BMD的因素。
1 材料和方法
1.1 研究设计和数据收集
这是一项ABI患者的横断面研究,选取2016年3月到2018年5月因ABI导致残疾至少3个月且年龄在50岁以上的绝经后女性为研究对象。该研究获得海南省海口市第四人民医院伦理委员会批准,所有参与者或其近亲均签署书面知情同意书。参与者完成了一份调查问卷,询问有关人口统计学,残疾的性质和自发病以来的时间,自发病以来骨折的病史以及骨质疏松症的风险因素的信息。记录每位患者的体重,并将她的活动性质分类为“无法行走”,“只能在室内行走,无论是否有助行器”或“能够走出门去”,有或没有助行器。记录患者所患的任何医学病症,已知与低BMD相关。吸烟和饮酒情况。每位患者保留血样,并进行以下测定:总碱性磷酸酶、血清钙、甲状旁腺素(PTH)、维生素D(25-OHD)、卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇和黄体酮。
使用DXA(Hologic Discovery A)测量BMD,并且所有扫描均由相同的操作者进行。实际BMD测量值(g/cm2)表示为相对值,并进行T评分和Z评分。所有患者均在腰椎(L1-L4)和一侧髋关节进行骨密度测量。此外,任何患有偏瘫的患者都需进行臀部和两侧前臂比较检测,除非髋关节进行假体置换或内固定植入或上肢痉挛难以最佳定位。根据世界卫生组织(WHO)标准进行分类,检测的精确度全髋1.4%,股骨颈1.7%,腰椎1.1%,均在可接受的范围内[7]。
1.2 统计学处理
使用SPSS 19.0进行数据的统计分析。计量数据以均数和标准差表示。独立样本t检验用于比较BMD。使用Dunnett'st检验事后分析和单因素方差分析(ANOVA)来检验BMD与各种活动能力、类固醇的使用、其他医学情况和饮酒之间的关系。相关系数用于判断BMD与年龄、残疾持续时间、25-OHD状态、甲状旁腺素,雌二醇或睾酮水平及吸烟之间的关联。配对t检验用于比较健侧和患侧髋部之间的差异。对所有BMD测量值进行线性回归分析,以确定可能的低BMD预测因子。P<0.05表示比较差异有统计学意义。
2 结果
该研究共有200名绝经后女性纳入本研究。年龄57.6±13.8岁;体重61.7±10.6 kg;其中中风116例,创伤性脑损伤45例以及其他原因39例;吸烟者36例,饮酒者54例;无法走路52例(25.0%);室内步行38例(19.0%);户外步行110例(55.0%);血清钙2.33±0.14 mmol/L;25-OHD 50.9±23.4 nmol/L;甲状旁腺素33.5±13.5 ng/L;碱性磷酸酶1.22±1.3U/L;卵泡刺激素18.6±9.3mIU/mL;促黄体激素10.6±2.5mIU/mL;雌二醇156.7±63.5 pmol/L;孕酮3.9±1.2 nmol/L。
表1中显示了女性的腰椎、患侧和健侧股骨颈、股骨髋部和桡骨远端的BMD,T评分和Z评分。当使用配对样本t检验进行比较时,健侧和患侧的股骨颈、股骨髋部和桡骨远端的BMD、T评分和Z评分之间差异存在统计学意义 (P<0.05)。当基于BMD分类时,所有参与者中124例(62.0%)患者出现骨量减少,76例(38.0%)患有骨质疏松症。
相关系数用于判断BMD与残疾持续时间、年龄、体重、25-OHD水平和PTH水平之间的关系。表2显示了相关性测试的结果。发现各部位的BMD与残疾持续时间、体重、25-OHD水平之间显著相关。
为了检验腰椎BMD与年龄、残疾持续时间、体重和活动状态之间的关系,进行多元线性回归分析,如表3所示。年龄、残疾持续时间、体重和活动状态作为独立预测因素。研究结果表明,每个回归模型都显著地表明因变量与独立预测因子之间存在显著关系。在每种情况下,发现体重是BMD的重要预测因子。此外,发现自残疾的持续时间和健侧股骨颈BMD、健侧股骨髋部和患侧股骨髋部BMD密切相关。
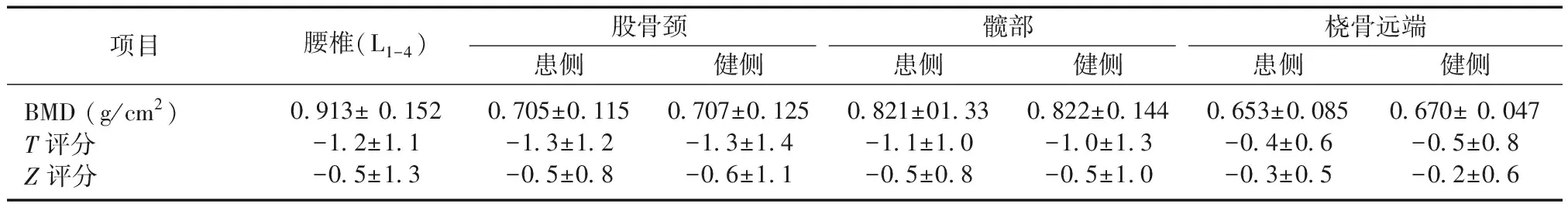
表1 女性获得性脑损伤患者的骨密度Table 1 Mean (SD) bone mineral density, T scores and Z scores in female patients with acquired brain injury
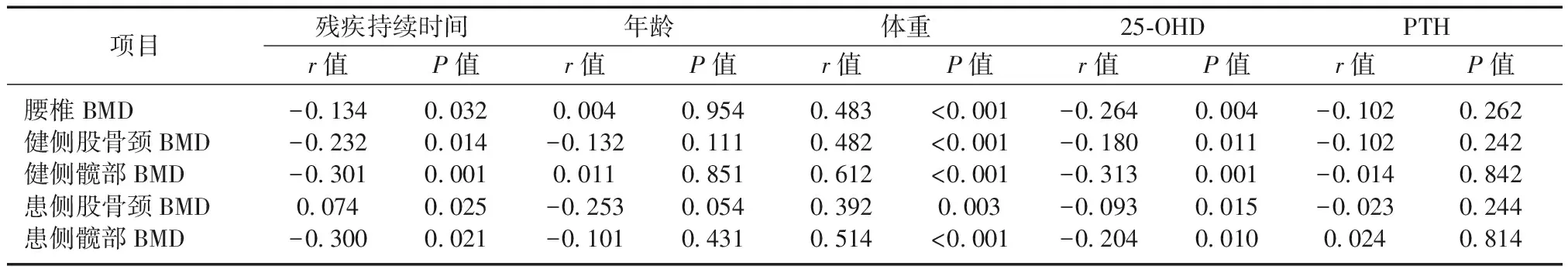
表2 骨密度与残疾持续时间、年龄、体重、25-OHD和PTH之间的相关性Table 2 Correlations between bone mineral density and duration of disability, age, body mass, 25-OHD, and PTH
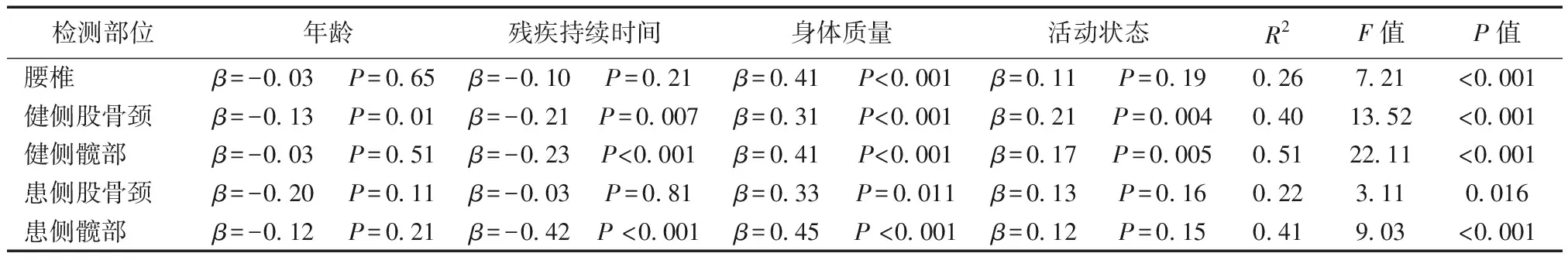
表3 BMD的多元线性回归分析Table 3 Multiple linear regression analysis of BMD
3 讨论
之前大多数检测ABI患者BMD的研究都集中在老年人中风患者身上。最近的一项研究检测了年轻创伤性脑损伤患者的BMD,但使用定量超声而不是DXA[7]。我们的受试者群体的平均年龄低得多,脑损伤亚型范围更广。然而,根据T评分,我们发现BMD低的患者人数(总计62.0%)处在老年脑卒中患者研究报道的48.5%~80.0%范围内[4]。在腰椎和股骨近端,38.4%和37.5%的Z评分均为-1或更低,这可能反映了残疾对其骨骼状态的影响。
研究表明大多数50岁以下的北美女性骨密度正常,但髋部脆性骨折的终生风险为17.5%,前臂远端为16%,临床诊断的椎体骨折为15.6%[4]。在我们的BMD低的研究人群中,推测他们的终生骨折风险甚至高于此,并且可能因其摔倒风险增加而加剧。之前建议将持续行走不足的卒中患者转诊进行基线DXA评估,因此可能是谨慎的建议[4]。
我们发现健侧和患侧的髋部BMD明显不同,但患侧或健侧股骨和前臂及颈部并没有发现。这与许多其他研究形成对比,这些研究发现在患侧或健侧肢体之间的各种部位存在显著差异[8]。在我们的受试者中,股骨颈和前臂BMD之间没有显着差异;残疾的持续时间与股骨颈部和髋部的BMD显著负相关并且是独立的预测因素,而与股骨颈BMD或患侧无关。其他研究已确定卒中持续时间与瘫痪下肢特定部位BMD或瘫痪肢体与非瘫痪肢体BMD之间的关系,但没有特别提及卒中后持续时间对健侧下肢BMD的影响[9]。
我们的研究参与者中有28.0%存在25-OHD缺乏的风险,35.0%的患者具有足够的水平,40%的水平超过了大多数人群的水平。缺乏风险的数字远远超过先前对18~84岁爱尔兰成年人的研究报告,其中只有6.7%的人有缺乏风险[10]。以前的研究还发现,大部分老年卒中患者中维生素D水平较低,缺乏阳光照射和残疾诱导的高钙血症可能是原因引起的,尽管中风前期也可能存在缺乏[10]。我们没有像之前的研究[11]那样发现BMD和25-OHD水平之间存在显著的相关性,这可能是因为只有少数患者的25-OHD水平足够低而导致PTH水平升高。
我们发现患者活动状态与健侧髋部的BMD显着相关,但不是瘫痪髋部的BMD。当使用五点步行评分作为评估工具时,患者的行走能力与瘫痪跖骨皮质骨密度呈显著正相关,并且与瘫痪股骨颈、总体股骨、和大转子的BMD显著负相关[12-13]。无法行走的患者健侧和患侧的骨密度均下降,在瘫痪肢体面积越大,而保留任何动态能力的患者仅在瘫痪侧丧失骨量[14]。步行的时间也非常重要,即使只有3个月的不能行走,导致下肢的矿化显著降低,特别是在瘫痪侧[15]。通过肢体承受的重量,地面反作用力和所采取的步数似乎是决定患侧股骨颈和髋部骨密度下降程度的重要因素[13,15]。这一发现表明早期更积极的康复重点是恢复行走能力,可能在预防ABI患者骨质流失方面发挥非常重要的作用。
在这项研究中,少数偏瘫患者限制了可以在该组中进行的统计分析。虽然有足够的病例来测试每个患者健侧和患侧,股骨颈和髋部及腰椎的回归模型,但对于瘫痪股骨颈BMD和髋部的BMD并不是这种情况。我们的相关回归中的重复测试数量可能会受到影响,并且已经参考了对测试回归模型的患者数量不足所造成的结果的限制。然而,尽管存在这种限制,但结果提供了初步证据,可在未来的更大规模研究中得到证实。进一步的影响ABI出现之前可能已经存在25-OHD缺乏和低骨量的风险。在这些ABI患者中,骨质减少和骨质疏松症的患病率高于一般年轻人群。自ABI发病以来的持续时间是最重要的残疾特异性髋部BMD降低的独立预测因子,恢复活动对于维持发生偏瘫的髋关节的BMD也很重要。

