套索肽
——一种可供多肽类药物设计和改造的多功能载体
成骋,华子春,2,3*
(1. 南京大学生命科学学院 医药生物技术国家重点实验室,江苏 南京210023;2. 江苏省产业技术研究院医药生物技术研究所/常州南京大学高新技术研究院,江苏 常州213164;3. 南京大学深圳研究院,广东 深圳518057)
套索肽是一类由核糖体合成和翻译后修饰的活性肽(RiPPs),因具有互锁套索拓扑结构的特征而命名[1-2]。其带有螺旋结构的C端穿过N端的内酰胺环而形成互锁套索样的结构,其中N端的肽环通常由7 ~ 9个氨基酸组成。大多数套索肽N末端的氨基酸残基通常为甘氨酸(Gly)、丝氨酸(Ser)、半胱氨酸(Cys)或丙氨酸(Ala)[3-4],但近期发现了N末端氨基酸为亮氨酸(Leu)的新型套索肽[5]。套索肽大的肽环是在N-末端的氨基酸的α-氨基与天冬氨酸(Asp)或谷氨酸(Glu)的羧酸侧链之间形成。这种结构赋予了套索肽对化学、热和蛋白酶降解高度的稳定性[1]。线性的多肽药物通常呈非结构化且在体内不稳定,相比之下,稳定性高的套索肽愈发受到关注。
1991年套索肽anantin首次被发现[6],1992年从新生儿的粪便中分离出套索肽microcin J25(MccJ25)[7],随后多种套索肽相继被发现并分离出来。套索肽具有多样的生物学功能,如抗微生物、抗肿瘤、酶抑制和受体拮抗活性等。基因挖掘技术已被用于新型套索肽发掘[8],发现了包括capistruin在内的超过24种套索肽[2,8-9]。基因挖掘技术必将使得越来越多的套索肽被发现,且其结构得到鉴定和表征。
1 套索肽及其基因簇的结构及分类
根据套索肽所含二硫键的数量和形成的位置不同可将其分为4类(见图1)。C端肽链与大肽环通过2个二硫键连接的套索肽被定义为Ⅰ类套索多肽(Class I);若肽链尾在穿出肽环之后,C端肽链与大肽环间无二硫键连接,而是通过空间相互作用稳定套索拓扑结构,则被称为Ⅱ类套索多肽(Class II);若肽链尾C端方向序列与肽环之间只形成一个二硫键的套索多肽,根据其二硫键形成位置不同,分为Ⅲ类或Ⅳ类套索肽(Class III,Class IV),具体而言,Ⅲ类套索肽的二硫键将肽环与肽链尾相连接,而Ⅳ类的二硫键仅存在于肽链尾。其中,II类套索肽是目前已知的套索肽中最常见且最具有特征性的套索肽,通常来源于变形菌,Ⅰ类、Ⅲ类和Ⅳ类套索肽则通常来源于放线菌。来源变形菌的Ⅱ类套索肽主要为极性亲水性,从链霉菌中分离出来的Ⅰ类套索肽和Ⅱ类套索肽(如MccJ25、propeptin和anantin)则为疏水性[8],正是这些结构特征决定了套索肽所具有的多种生物活性。因此,对套索肽的生物合成、结构及其活性的研究,在其作为药物的多功能骨架的应用中起到至关重要的作用。
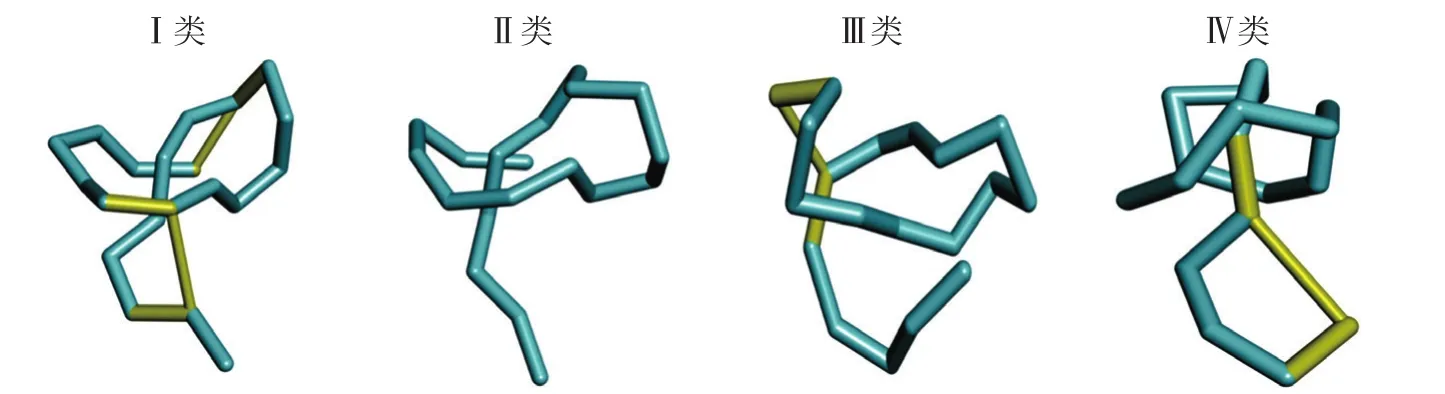
图1 套索肽的4种类别Figure 1 Four types of lasso peptides
套索肽从核糖体前体肽(precursor peptide)衍生而来,前体肽由N端的前导序列和C端的核心序列构成。N端前导序列功能在于底物识别,以及介导翻译后加工酶之间的相互作用;核心序列是翻译后修饰酶修饰的结构域。翻译后修饰包括环化、磷酸化、瓜氨酸化、C端甲基化,以及二硫键形成。翻译后修饰往往增加了套索肽分子中官能团的多样性和套索肽的化学及生物稳定性。套索肽基因簇的一个显著特征是编码RiPP识别元件,即RRE(E蛋白),用于结合前导肽并介导翻译后修饰。来自不同家族的E蛋白均由N端的3个β链结构和C端的3个α螺旋组成[2]。如图2所示,套索肽的生物合成过程需要3个步骤:1)E蛋白识别并结合前体肽(A蛋白);2)与转谷氨酰胺酶同源的半胱氨酸酶(B蛋白)负责切割前导肽并释放核心肽;3)与天冬酰胺合成酶同源的ATP依赖性的内酰胺合成酶(C蛋白)以AMP酯形式激活Asp/Glu羧酸,然后通过α-氨基缩合催化内酰胺环的形成。

图 2 套索肽生物合成步骤Figure 2 Biosynthesis procedure of lasso peptide
图3总结了常见的来自放线菌、变形菌和厚壁菌的套索肽基因簇的组成。基因A负责编码前体肽,前体肽A可以分为2个肽段(A1和A2)或甚至3个肽段(A1、A2和A3)[3,10-12]。基因B和C产生成熟酶,在形成套索拓扑结构的过程中,基因B和C密切相关且不可或缺[13]。变形菌的基因簇中E-B通常是融合蛋白,而来源于放线菌和厚壁菌的基因簇中通常分为2个开放阅读框(ORF),分别独立地编码E蛋白和B蛋白。结构保守的ABC转运蛋白(D蛋白)是套索肽合成的核心蛋白。D蛋白能使套索肽具有增强宿主免疫力的功能,因此,含有D蛋白的套索肽通常具有抗菌活性[5]。图3显示:大多数来源于变形菌的套索肽基因簇不含有编码ABC转运蛋白的基因,而对应存在编码异肽酶(isopeptidase,简称Isop)的第4个基因[3,10-11,14]。

图 3 已知套索肽生物合成基因簇组成Figure 3 Known biosynthetic gene clusters of lasso peptides
异肽酶最早是在套索肽astexin-2/3基因簇的AtxE2中被分离出来的[12],其能够特异性地水解相邻基因簇形成的异肽键,从而产生线性肽[15],但不能水解分支环状结构astexin-2/3中的异肽键[16]。为了更好地理解异肽酶的特异性,科学家研究了鞘磷脂I-异肽酶(SpI-IsoP)。SpI-IsoP的相对分子质量为74 500,由N端β螺旋和C端α/β-水解酶2个结构域构成[17],SpI-IsoP对肽底物中单个氨基酸的取代具有高耐受性,但SpI-IsoP对于肽底物的loop环序列的识别非常严格,因此SpI-IsoP保持高度特异性。
目前研究最多的套索肽microcin J25(MccJ25)的生物合成基因簇由4个基因(McjA、McjB、McjC和McjD)组成[18]。MccJ25套索肽成熟期间,B蛋白从前体肽中切割前导肽,释放核心肽来进行预折叠。对B和C蛋白的体外研究表明:B蛋白可能具有分子伴侣功能[14,19];C蛋白则以ATP依赖性方式激活侧链的羧酸,催化肽环形成反应。随后,D蛋白将成熟的套索肽从细胞中输出。套索肽成熟的系统中B蛋白是否具有ATP依赖性,B蛋白与C蛋白是否不存在相互依赖性[19-20],目前还存在互为矛盾的报道。
2 套索肽的生物学活性
目前已发现的大部分套索肽是在变形杆菌和放线菌中合成的,如羊毛硫细菌素、小菌素、微环素、蓝内酯和硫肽等。套索肽因其具有抗菌、抗病毒或其他生物活性被认为是生物制药研发热点之一。
大多数套索肽都具有抗细菌的作用。许多羊毛硫抗生素对多种革兰阳性菌具有杀菌作用,有些对耐甲氧西林的金黄色葡萄球菌(MRSA)、耐万古霉素肠球菌和耐奥沙西林的革兰阳性菌等具有较好的活性[21-22]。套索肽MccJ25对于革兰阴性菌(如大肠埃希菌和沙门菌等)有杀伤作用,同时能够中和内毒素,并通过其免疫调节作用抑制炎症细胞因子的产生;活性肽MccJ25还可以防止由肠毒素ETEC K88引起的肠道损伤和炎症反应,可作为一种新的预防性药物来减少动物、食品或人类的病原体感染。来源于链霉菌属Streptomyces sannurensis的套索肽marinopyrroles A-F 对MRSA 也具有极强的抗菌活性[23],套索肽chaxapeptin对革兰阳性菌有微弱的抗菌活性,对金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度为 30×10-6~ 35×10-6g·mL-1[24]。目前认为套索肽的抗菌作用主要是通过2种机制:其一是作用于细菌的细胞膜,在膜上形成离子通道,引起胞内物质的外漏而杀死细菌;其二是套索肽不破坏细胞膜而进入胞内,与胞内靶标结合后抑制其代谢,从而杀死细菌。例如,MccJ25与细菌外膜受体蛋白FhuA结合,进入细菌后抑制RNA聚合酶的作用,起到杀菌的作用[25]。微环素(microviridins)是在蓝藻中合成的一类环状或笼状的套索肽,是良好的蛋白酶抑制剂。Microviridins M对弹性蛋白酶和枯草杆菌蛋白酶有较强的抑制作用[26]。研究发现套索肽还具有抗病毒作用,如1994年发现的来源于链霉菌属Streptomyces griseo flavus套索肽RP71955 aborycin具有抗HIV的作用[27]。RP71955 aborycin类似于HIV蛋白酶抑制剂,抑制其活性,使得病毒不能正常装配,从而达到抑制HIV的目的。相较于正常细胞,细胞膜富含酸性磷脂的肿瘤细胞对套索肽类抗生素更敏感,套索肽对肿瘤细胞具有杀伤作用,如来源于链霉菌属Streptomyces sannurensis和Streptomyces leeuwenhoekii的Ⅱ类套索肽chaxapeptin和sungsanpin均可以抵御人肺癌细胞的侵袭[24,28]。
3 套索肽的人工合成
3.1 套索肽的基因工程合成
基因工程法生产套索肽可以有效降低生产成本,异源表达套索肽是套索肽研究中常用的方法。这不仅是因为套索肽在其天然宿主菌中的表达难以在标准培养条件下实现[10,14,29-30],而且异源表达有利于深入研究套索肽生物合成过程和翻译后修饰[31-34]。大肠埃希菌表达系统相较于其他蛋白表达菌株,具有遗传背景清晰、操作简单等优势,被广泛用于重组蛋白的生产。研究表明来源于变形菌的套索肽可以实现在大肠埃希菌中异源表达。在天然宿主中,套索肽的表达通常是由调控元件和弱启动子组合调控[30],且套索肽基因组的GC含量较高。大肠埃希菌缺乏翻译后修饰系统,套索肽在大肠埃希菌中异源表达时通常表达产量会相对较低甚至不表达[35]。因此,利用链霉菌和鞘氨醇单胞菌表达系统异源表达套索肽也受到了关注。来源于缺陷短波单胞菌(Brevundimonas diminut)的套索肽brevunsin的基因簇在鞘氨醇单胞菌中能够实现高水平表达,表达量达到 10.2×10-3g·L-1[36]。来自白色链霉菌(Streptomyces albusDSM 41398)的翻译后乙酰基修饰的套索肽albusnodin在异源宿主中也实现了高效表达[37]。
3.2 套索肽的化学合成
目前一些核糖体多肽,如羊毛硫肽化合物(lantipeptide)和环肽(cyclotides),已经可以利用化学法从头合成[38-39]。近年来利用化学法合成套索肽的研究显著增加。但是,化学法合成的套索肽大多难以形成其拓扑结构。不过,专利CN106749497提出的方法解决了这一难题[40]。该方法以多锚点支撑实现了套索多肽及其类似物的化学全合成,通过连接点限制与导引来控制多肽链的走向,使其能够构成拓扑的套索构型。固相肽合成法被用于合成支链环状MccJ25以及其环状和双环类似物[41-42],该方法由于在一个反应容器中进行所有反应,便于自动化操作,且可定点合成多肽,因此在有机合成中广泛应用。Ferguson等[43]基于通过铜催化的叠氮化物-炔烃环加成的环化,观察到肽环和其特定拓扑结构对于生物活性具有关键性作用。
化学酶法合成也是获得套索肽的方法之一。该法是指将生物合成的套索肽纯化后再通过化学方法修饰,可以通过体外化学连接或其他方法打开肽链并接入短肽,将固相肽合成和酶类强大的立体和区域选择性结合起来。化学酶法生物合成的最后一步,是非核糖体肽合成酶 (nonribosomal peptide synthetases,NRPs)的C末端硫酯酶(thioesterase,TE)结构域的催化反应[44-45]。分离和纯化的TE结构域,被广泛用于线性肽底物的环化,促进药理活性化合物库的丰富和发展[46]。TE结构域由于其特有的环化和水解的双重活性,还可以催化非核糖体肽(nonribosomal peptide, NRP)的水解形成线性肽,如万古霉素型抗生素[47]。大多数酶促反应都是可逆的,反应速率取决于pH、温度,以及酶和底物的浓度等因素[48-50]。迄今尚无利用化学酶法生产套索肽的报道,原因一方面可能是生物合成套索肽的产量有限;另一方面,生物法表达后,化学法修饰的范围也有限。
4 套索肽的应用及前景
目前所有的常规抗生素都出现了相应的抗药性致病株系,致病菌的抗药性正在日益严重威胁着人们的健康。抗菌肽不仅对细菌、真菌和病毒等具有广泛的杀伤作用,且其靶菌株不易产生抗性突变,还可以通过免疫调节作用控制免疫反应,减轻炎性损伤,且具有高特异性、低毒性,是良好的药物先导化合物来源。但由于其不理想的物理化学和药动学性质,比如溶解度变化大、生物利用度低和稳定性差等问题,大大地限制了抗菌肽的应用。
通过采用诸如PEG修饰、环化、引入非天然氨基酸、氨基酸N-甲基化法等方法对天然多肽进行改造和应用,增强了天然多肽结构的稳定性[50],其中,最为人熟知的蛋白骨架就是环肽[51-53]。来源于植物的大环寡肽具有头尾相接的环状骨架,同时还含有3对保守的二硫键组成的胱氨酸结,因此其结构紧密、稳定性非常好。科学家将具有血管内皮生长因子A拮抗剂功能的肽段移植进大环寡肽kalata B1的分子骨架中[54-55]。通过固相肽合成大环寡肽kalata B1的衍生物,随后进行分子内硫酯介导反应形成环化,经修饰后的大环寡肽kalata B1衍生物高度稳定且具有良好的生物活性[55]。
套索肽基因簇来源于细菌,适合在大肠埃希菌中异源表达;除了由黄单胞菌产生的套索肽外[56-58],目前已知的套索肽均无致病性。套索肽的序列可在生物合成过程中用任意氨基酸进行替换取代,使其成为新型药物开发和多肽表位移植等应用中合适且理想的蛋白骨架。因此,可以利用套索肽的结构设计并获得目的多肽,改善其结构,提高其对热和蛋白水解的稳定性。
通常认为套索肽的肽环是其保持高度紧凑和稳定结构及内在抗菌性的关键。肽环的大小允许变化的幅度很小,只能在其中插入或删除1 ~ 2个氨基酸。套索肽尾部区域负责套索肽从其宿主菌中输出,同时与套索肽的自我保护机制相关。套索肽的转向模序是套索肽中较为适合修饰、改造的区域。
有一项研究报道套索肽和三甘氨酸短肽共价缀合,通过旋转肽环与线性肽链之间的键形成套索肽结构,从而形成治疗性多肽与套索肽骨架的共价支链环状化合物。该方法的局限性在于所缀合的线性肽的分子大小要足以通过肽环,因此不适用于含较大侧链的氨基酸的肽。此外,通过键旋转形成套索肽的反应是可逆的,即便是插入三甘氨酸肽这种小且结构简单的短肽,产量也仅有4%[59]。因此,该方法用于改造套索肽时,在肽延展性和应用性方面都具有较大的限制。整联素结合基序RGD作为短肽表位被移植到套索肽MccJ25上,插入位点在套索肽尾部的转向模序中[56,60],改造后的套索肽MccJ25在体外实验中对 αvβ3、αvβ5 和 α5β1 整联素具有亲和力,并能抑制肿瘤细胞中毛细血管形成。套索拓扑结构增强了MccJ25衍生物对蛋白质降解的稳定性。在对野生型的套索肽与改造后的套索肽进行结构比对时,发现RGD取代并未改变其分子骨架,证明MccJ25结构在插入短肽表位后仍然保持稳定[56]。在MccJ25的合成基因簇中,基因McjA和McjB之间有一段长非编码区,可用来插入外源性功能基因而不影响套索肽的合成,例如,可在MccJ25的前体肽McjA后插入绿色荧光蛋白[13,61]。Bode等[59]发明了一种利用轮烷支架形成套索结构的方法,其能够将具有治疗或靶向功能的线性肽插入套索肽结构,使其免受热或蛋白酶降解。胰腺癌中内皮素B受体(ETB)过表达,套索肽RES-701-1具有ETB拮抗剂的功能。由RES-701-1和内皮素组合而成的杂合肽不仅对ETB具有高度选择性,而且对ETB和内皮素A受体(ETA)都具有高亲和力和拮抗作用;有的杂合肽类似物还具有ETB激动剂作用[62-63]。将RGD移植到套索肽RES-701-1可以提高其生物活性和结构稳定性[64]。
5 前景和挑战
通过基因工程和表位移植等方法用靶配体修饰套索肽,得到的套索肽缀合物具有靶向分子探针和药物载体的功能。套索肽能够作为多种肽表位的良好的载体。虽然目前尚未完全了解哪种类型的套索肽的稳定性最强,对Ⅰ类和Ⅲ类套索肽进行模拟,在插入位点引入半胱氨酸可以稳定套索肽结构[5],改造后的套索肽由于RGD结合基序附近空间位阻较小,提高了对整联素亚型的选择性。异源表达能极大地提高套索肽的表达水平,如果肽序列中存在难以修饰的氨基酸残基则会极大地影响到其表达量;某些修饰也可能会产生稳定性较差的套索化合物。有关套索肽的研究除了探索基于套索肽的药物研发,还有待阐明套索肽在自然界的进化,即套索肽何时产生、为何产生,以及如何实现生物学功能等各方面。
6 结语
套索肽是一类具有生物活性的多肽类天然产物。肽链N末端与酸性侧链之间的异肽键使其形成了特征性的套索结构。近年来在套索肽的稳定性和生产等方面取得了一些进展。由于其多样性的功能,套索肽在药物开发和应用中展示出巨大的潜力[56-57]。相比于化学合成,生物发酵法合成套索肽具有生产成本低、安全环保等优点,改造后的套索肽可被应用于医药领域。对套索肽氨基酸组成和结构的研究,将为阐明其所具有的抗菌、酶抑制、抗HIV作用等奠定基础。通过基因重组和化学合成,理性设计和修饰改造套索肽将大大拓展套索肽的药学和医学应用前景。

