TUBB6在胃癌中的表达情况及临床意义
张敏,左云,卢玮冬
张家港市第一人民医院(苏州大学附属张家港医院)肿瘤科,江苏 张家港 215600
胃癌是全球常见的恶性肿瘤之一,发病率居全部恶性肿瘤第4位,病死率居全部恶性肿瘤第2位[1]。随着分子生物学的快速发展,与胃癌相关的肿瘤标志物的研究日益得到关注。β微管蛋白Ⅴ(tubulin beta 6 classⅤ,TUBB6)是β微管蛋白的亚型之一,由TUBB6基因编码。TUBB6广泛表达于人类的各种正常组织中,其在乳腺组织和肺组织中的表达量分别占β微管蛋白表达量的11%和10%[2]。TUBB6也广泛表达于肿瘤细胞,其在乳腺癌、肺癌、卵巢癌、结直肠癌细胞中均异常高表达[3-7]。但目前关于TUBB6在胃癌中表达情况的报道较少,本研究通过免疫荧光染色和免疫组织化学染色方法,探讨TUBB6在胃癌细胞中的定位及在胃癌组织中的表达情况,并分析其表达情况与胃癌患者临床特征的关系,现报道如下。
1 对象与方法
1.1 研究对象
选择2017年1—12月于张家港市第一人民医院接受手术治疗的90例胃癌患者。纳入标准:年龄为18~85岁;经病理检查确诊为胃癌;预计生存期≥3个月。90例患者中,男61例,女29例;年龄为31~83岁,中位年龄为65.5岁;病理类型:腺癌66例(乳头状腺癌3例,黏液腺癌5例,管状腺癌58例),印戒细胞癌13例,未分化癌11例;分化程度:中/高分化16例,低分化60例,未分化14例;有淋巴结转移64例,无淋巴结转移26例;有远处转移3例(1例卵巢转移,1例结肠转移,1例肝实质转移),无远处转移87例;TNM分期:Ⅰ~Ⅱ期36例,Ⅲ~Ⅳ期54例。所有患者术前均未行放疗或化疗等抗肿瘤治疗。收集患者的胃癌组织90例及癌旁组织(距肿瘤边缘>5 cm)45例进行研究,术中取得标本后立即转移至-80℃冰箱中保存备用。本研究经医院伦理委员会审批通过,所有患者及家属均对本研究知情并签署知情同意书。
1.2 细胞及主要试剂
细胞:正常胃黏膜上皮细胞株GES-1和胃癌细胞株BGC-823(低分化)均购自上海吉凯基因科技有限公司。主要试剂:TUBB6抗体、Alexa Fluor 555标记的山羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)(H+L)高交叉吸附的二抗均购自美国Proteintech公司,兔抗人TUBB6多克隆抗体购自艾博抗(上海)贸易有限公司,鼠抗兔UltraSensitiveTMS-P超敏试剂盒购自福州迈新生物技术开发有限公司。
1.3 免疫荧光染色
将正常胃黏膜上皮细胞株GES-1和胃癌细胞株BGC-823培养后,制成(1~2)×104/ml的单细胞悬液,接种于96孔板中,置于CO2培养箱中培养3天。待细胞长成单层后,采用4%多聚甲醛将细胞固定;0.2%Triton破膜穿孔;滴加封闭液于湿盒中,室温封闭;采用抗体稀释液稀释一抗(TUBB6抗体,1∶200稀释),滴加一抗,置于湿盒内,37℃孵育;采用抗体稀释液稀释二抗(Alexa Fluor 555标记的山羊抗鼠二抗,1∶300稀释),滴加二抗,置于湿盒内,37℃保温、避光;荧光显微镜镜检、拍照。
1.4 免疫组织化学染色
90例胃癌组织和45例癌旁组织标本均经10%甲醛固定,石蜡包埋,4 μm厚连续切片。将组织切片进行脱蜡和水化;采用3%H2O2灭活内源性过氧化物酶,抗原热修复;滴加10%血清封闭非特异性结合位点,依次滴加一抗(兔抗人TUBB6多克隆抗体,1∶500稀释)和二抗(鼠抗兔S-P超敏试剂盒);加入二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染;最后脱水、封片、镜检。
1.5 免疫组织化学染色结果判定
TUBB6定位于细胞质,阳性染色细胞中可见棕色颗粒。由2位病理科医师进行判断,在高倍镜(×400)下观察5个视野,每个视野计数200个细胞。根据染色强度进行评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。根据阳性细胞所占百分比进行评分:<1%为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。染色强度评分与阳性细胞所占百分比评分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。其中,≥1分即为阳性。
1.6 统计学方法
采用SPSS 17.0软件对数据进行统计学分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 TUBB6在不同细胞株中的免疫荧光染色结果
TUBB6在正常胃黏膜上皮细胞株GES-1、胃癌细胞株BGC-823中均可检测到免疫荧光信号,且胃癌细胞株BGC-823中的荧光染色强于正常胃黏膜上皮细胞株 GES-1(图 1A、2A);经 4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)核复染(图1B、2B),进一步提示TUBB6定位在细胞质。

图1 正常胃黏膜上皮细胞株GES-1中TUBB6的表达情况(免疫荧光染色,×400)

图2 胃癌细胞株BGC-823中TUBB6的表达情况(免疫荧光染色,×400)
2.2 胃癌组织和癌旁组织中TUBB6表达情况的比较
TUBB6在胃癌组织中主要表达于细胞质,呈不同程度的表达;TUBB6在癌旁组织中也表达于细胞质,但染色较浅(图3、图4)。分析45例胃癌组织及其对应癌旁组织中TUBB6的表达情况,结果显示,胃癌组织中TUBB6的阳性表达率为88.9%(40/45),低于癌旁组织的68.9%(31/45),差异有统计学意义(χ2=5.404,P<0.05)。

图3 胃癌组织及癌旁组织中TUBB6的表达情况(免疫组织化学染色,×400)

图4 胃癌组织中TUBB6的染色情况(免疫组织化学染色,×400)
2.3 不同临床特征胃癌患者胃癌组织中TUBB6的表达情况
90例胃癌组织中,TUBB6的阳性表达率为88.9%(80/90)。不同性别、年龄的胃癌患者胃癌组织中TUBB6的阳性表达率比较,差异均无统计学意义(P>0.05)。不同病理类型、分化程度、浸润深度、淋巴结转移情况、TNM分期及Lauren分型的胃癌患者胃癌组织中TUBB6的阳性表达率比较,差异均有统计学意义(P<0.05)。(表1)
3 讨论
胃癌是临床中常见的恶性肿瘤之一,严重影响人类的生命健康,其发病机制尚未完全阐明。研究发现,胃癌由多种基因调控失衡发展而来,与原癌基因C-erbB-2、c-myc、ras的激活和抑癌基因p21、p53的失活有关,上述基因表达的变化对胃癌的生物学行为及预后均产生影响[8-10]。目前在胃癌中尚缺乏特异性或敏感性高的生物标志物,由于部分生物标志物受技术和成本的限制,尚未进入临床应用阶段,因此寻找一些新的具有临床应用价值的生物标志物对胃癌的研究具有重要意义。
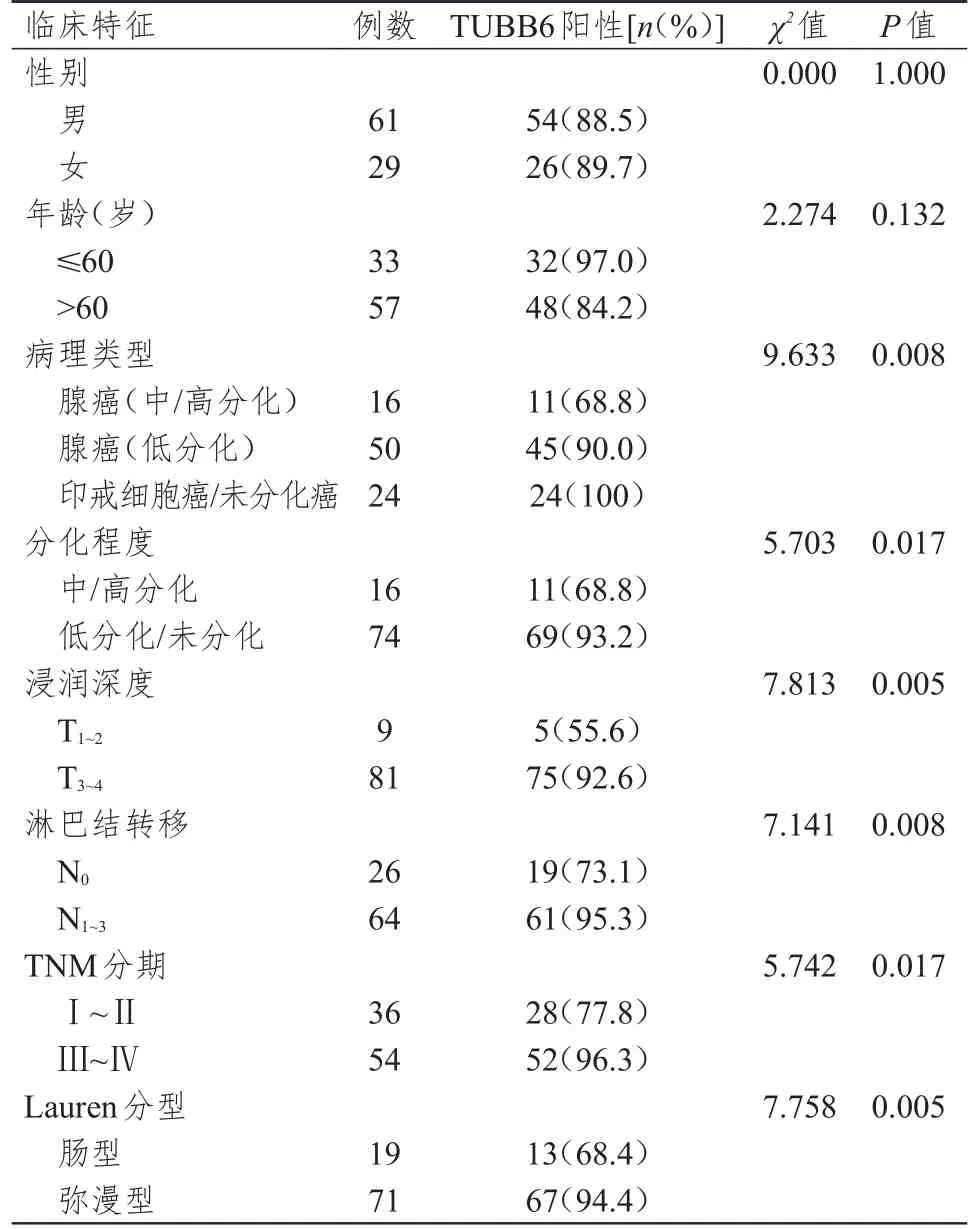
表1 不同临床特征胃癌患者胃癌组织中TUBB6表达情况的比较(n=90)
微管是细胞骨架的重要组成部分,普遍存在于真核细胞中,参与细胞形态的维持、细胞内物质运输、细胞运动、细胞分裂及分化等过程。微管由微管蛋白和微管辅助蛋白组成[11]。微管蛋白是一种异质二聚体蛋白,由α微管蛋白和β微管蛋白组成,至少有6个α微管蛋白和7个β微管蛋白亚型,两者在细胞质内保持高度动态平衡[12]。微管蛋白是有丝分裂时纺锤体的组成部分,也是抗微管药物的主要作用靶点。通过一种新的实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)技术,可以精确地测量出人类β微管蛋白亚型Ⅰ、Ⅱa、Ⅱb、Ⅲ、Ⅳa、Ⅳb、Ⅴ和ⅥmRNA的表达水平,它们分别由TUBB、TUBB2A、TUBB2B、TUBB3、TUBB4、TUBB2C、TUBB6和TUBB1基因编码[2]。
Verdier-Pinard等[13]首次在人类细胞系中检测到TUBB6,并发现在上皮样卵巢癌细胞系Hey中高表达。研究发现,TUBB6在具有分泌功能的输卵管上皮细胞中具有组织特异性;TUBB6在浆液性卵巢癌中高表达,尤其是在分化较差、乳腺癌易感基因(breast cancer susceptibility gene,BRCA)突变的浆液性卵巢癌中,TUBB6的表达水平更高[6]。浆液性卵巢癌中TUBB6高表达可能与浆液性卵巢癌的发展有关,具有迁移能力的输卵管上皮细胞脱落,然后附着于邻近的卵巢上皮细胞,是卵巢癌起始和恶性播散的来源[14-15]。TUBB6的异常表达提示输卵管上皮分泌细胞的异型性是癌前病变的表现。研究表明,在浸润性乳腺癌中TUBB6呈高表达,尤其是低分化浸润性乳腺癌,提示TUBB6的高表达与乳腺癌的分化程度及恶性转移有关[4]。另有研究表明,TUBB6在非小细胞肺癌中高表达,提示TUBB6可作为非小细胞肺癌的生物标志物[5]。在女性结直肠癌及转移性结直肠癌中TUBB6呈高表达,且表现出较差的预后,提示TUBB6可作结直肠癌侵袭性及预后的预测因子[7]。在非肿瘤疾病中,TUBB6突变与常染色体显性非进行性先天性面瘫、双侧上睑下垂和腭咽功能障碍有关[16]。
TUBB6作为微管蛋白亚型之一,其表达水平同样也影响细胞分裂和抗微管药物的敏感性。研究表明,TUBB6的过表达会破坏细胞骨架结构,抑制微管组装,改变微管的动态不稳定性,并促使微管从中心体蛋白分离,进而引起细胞分裂,并对紫杉醇耐药[17-19]。而微管稳定药物紫杉醇可增加具有组装能力的微管蛋白补丁,抑制微管分离,稳定微管,进而抑制细胞分裂,消除TUBB6过表达的表型效应。此外,TUBB6过表达或缺失均会抑制有丝分裂,影响微管的稳定性或动态行为,从而抑制细胞增殖。另有研究发现,尽管TUBB6的过表达存在毒性作用(如破坏细胞骨架结构、抑制微管组装和药物耐药等),但在某些细胞中,少量的TUBB6表达对维持微管的可塑性和细胞分裂是必需的[20]。由于TUBB6表达的独特性以及一些恶性肿瘤的特征性表现(如分化差、转移性等),提示TUBB6表达情况的改变可能与肿瘤的发生有关[4]。因此可推测,TUBB6过表达在恶性肿瘤中可能引起恶性生物学行为,如分裂增殖、转移、浸润、侵袭等,微管稳定药物如紫杉醇则可抑制TUBB6过表达引起的恶性生物学行为,达到治疗的目的。
本研究中,TUBB6定位于胃癌细胞的细胞质,与之前的研究结果一致[4]。既往研究证实,TUBB6在非小细胞肺癌和正常肺组织中的表达水平比较,差异有统计学意义(P<0.05)[5]。本研究结果表明,胃癌组织及其对应的癌旁组织中TUBB6的阳性表达率分别为88.9%(40/45)和68.9%(31/45),差异有统计学意义(P<0.05)。既往研究表明,在分化差的浆液性卵巢癌、低分化浸润性乳腺癌、非小细胞肺癌、女性结直肠癌及转移性结直肠癌中,TUBB6均呈高表达,提示TUBB6高表达与肿瘤的预后、分化程度、侵袭性、恶性转移有关[4-7]。本研究结果显示,不同病理类型、分化程度、浸润深度、淋巴结转移情况、TNM分期及Lauren分型的胃癌患者胃癌组织中TUBB6的阳性表达率比较,差异均有统计学意义(P<0.05)。由此可推测TUBB6可能与胃癌的发生发展具有密切关系,可作为胃癌的生物标志物,并可能预测患者预后。
综上所述,TUBB6在胃癌组织中的表达水平较高,且其表达情况与患者的临床特征有关,可能与胃癌的发生发展具有密切关系,可作为胃癌的生物标志物。
——水芹主要害虫识别与为害症状

