对二氧化硫、氧气与硫化钠溶液反应的研究
王兰芳 顾华津

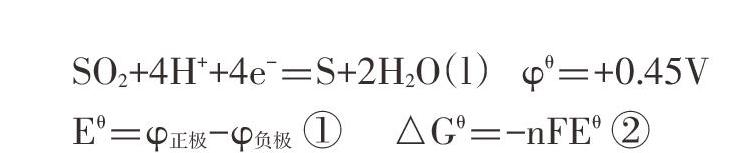
摘要:通过实验探究得出向硫化钠溶液中通入氧气一段时间后没有明显现象,通入二氧化硫后立即产生黄色沉淀,指出这与中学化学教学中惯性思维“谁强谁先”相背离,反应发生的先后顺序受热力学和动力学共同影响。建议在中学化学教学与命题中谨慎使用“习惯说法”,摆脱惰性,多学习、多研究,指导学生多做实验,捕捉“异常现象”,培养学生学科核心素养。
关键词:硫化钠;二氧化硫;化学实验;异常现象
文章编号:1008-0546( 2019) 11-0093-03
中图分类号:G633.8
文献标识码:B
doi:10.3969/j.issn. 1008-0546.2019. 11.026
一、问题的提出
笔者2018年10月参加江苏省新课程培训,扬州大学吴星教授在高中化学教育现状与思考中提及中学化学教学存在两个重大问题:1.中学化学教学中实验做得少乃至不做实验的现象较为严重。2.在教学内容方面,由于受到“习惯说法”的影响,如讲氧化还原反应、金属活动性时,始终强调“谁强谁先”,存在着严重的认识误区。吴教授提出的问题深深触动了笔者,认为在日常教学过程中要努力尝试改变这种怕做实验、想当然的现象。
恰逢笔者所在的QQ群对某市期末联考中实验题进行探讨,题目如下:
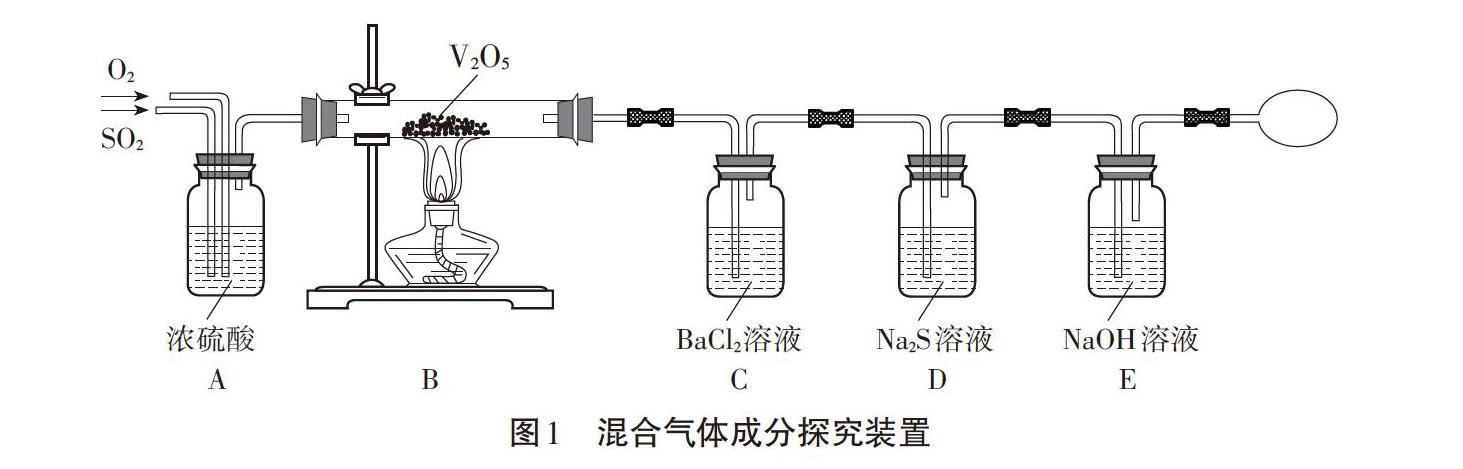
工业制取硫酸时,有一步反应为2SO2+O2=△催化剂2SO3(其中=表示反应不能进行到底,即反应物不能完全转化)。某兴趣小组模拟该过程并对反应得到的混合气体成分进行探究,设计如图1所示实验装置:
相关问题:实验时装置D中产生淡黄色沉淀。为探究此时发生的反应,取少量D中溶液滴加BaCl2溶液,生成白色沉淀,再加入稀鹽酸,白色沉淀溶解且生成刺激性气体,则实验时装置D中发生反应的离子方程式为____。
对于该题有老师提出了质疑,认为该题的假设不存在,存在科学性问题。理由是:2SO2+O2=△催化剂2SO3,该反应为可逆反应,通入Na2S溶液的气体为SO2O2的混合气体,又因为O2的氧化性强于SO2,所以应该是02先氧化S2-而非SO2氧化S2-。在此条件下,事实如何呢?笔者对此展开了研究。
二、实验探究
1.资料查询
如果O2能氧化S2-,O2转变为H2O,O元素由0价转化成-2价,S元素由-2价转化为0价硫单质。同理如果SO2能氧化S2-,SO2中的S元素由+4价转变成0价硫单质,S元素由-2价转化为0价硫单质。那么这两个氧化还原反应能否发生?理论上可查找两个半反应的标准电极电势[1]并进行比较:
S+2e-= S2- φ0= -0.447V
O2+4H++4e-=2H2O(1) φθ=+1.229V
S02+4H++4e-=S+2H2O (1) φθ=+0.45V
Eθ=φ正极-φ负极① △Gθ=-nFEθ②
由①、②计算公式可知02、SO2均能氧化S2-,在此条件下,是02还是S02优先氧化S2-呢?笔者设计了如下实验。
2.实验操作及现象
实验操作及现象见表1所示。
3.现象分析
实验现象表明,在SO2与Na2S溶液以及O2与Na2S溶液反应中,S02优先于O2氧化S2-,为什么SO2优先于02氧化S2-呢?
对于化学反应实际进行情况的研究,我们要从热力学与动力学两个方面综合进行。化学反应热力学侧重研究化学反应过程的始态和终态,不涉及变化过程所经历的途径和中间步骤。化学反应热力学可以判断反应能否发生,不考虑时间因素,不能回答反应的速率和历程问题。根据热力学数据可以判断,SO2、O2都能和Na2S溶液反应,但是反应的速率和机理如何是动力学研究的重点。化学动力学最重要的是研究化学反应的内因(反应物的结构和状态等)与外因(温度、浓度及介质、催化剂、压强等)对化学反应速率的影响及化学反应的过程从而揭示化学反应机理[2]。
因此,我们在分析化学反应的先后顺序时要从“热力学”和“动力学”两个视角进行,由热力学数据可以判断反应能否进行以及反应进行的程度。化学反应先后顺序的问题,本质上是化学反应的速率的问题,需要通过动力学实验进行测定,不能受到“习惯说法”的影响,简单地认为都遵循“谁强谁先”的原则。
三、反思与启示
笔者将所做的“SO2、02与Na2S溶液反应”实验视频发到QO群上,引起了强烈的反响,得到了大市教研员以及老师们的一致称赞。笔者深受鼓舞,同时也做了如下几点思考。
1.切实进行教学研究
江苏省自2008年新高考方案实施以来,每年选择化学作为高考科目的考生占总考生的人数逐年减少,化学科目在高考中的地位和作用明显降低,学校分配的化学课时数也受到挤压,在这样的背景下,怎样才能高效地完成教学任务呢?教师需要摆脱惰性,应对教学内容进行深入地研究,对教学中的一些“习惯说法”不能怕麻烦,而应通过理沦推演或实验验证其科学性、真实性。例如,在离子共存的判断中,一直有这样的说法:NH4+在碱性介质中不能大量存在;Ca2+和HCO3-能大量共存。但通过理论计算和实验验证后,事实并非如此。对于这些不符合事实的“习惯说法”,应大胆舍弃。只有摆脱惰性,对教学内容进行实践研究,我们才能知道课堂上应该讲什么,不能讲什么;才能把宝贵的课堂时间运用到激发学生的兴趣上,让更多的学生喜爱并选择化学;才能真正地提高教学效率,减轻学生的学业负担。
2.利用异常现象设计教学
化学实验不仅能为学生提供感性认识,还是培养学生科学态度和探究精神的有效途径,因而教师要尽可能地指导学生多做实验。但在具体的操作过程中,由于受药品的纯度、浓度、反应条件、操作的正确性等诸多因素的影响,有些反应还伴随着副反应的发生,常常会出现学生难以理解的异常现象[3]。如:CO2通入澄清的石灰水,石灰水不变浑浊。教师应积极引导学生分析形成异常的原因(①可能由于制备的CO2中混有部分HCl;②饱和澄清石灰水已经部分与空气中的CO2反应,使溶液的浓度有所降低。)[4],消除他们误以为实验“失败”的失落感,使他们体验到化学实验的神奇魅力,从而激发学生学习兴趣,培养学生严谨求实的探究精神和创新意识。
3.确保命题科学合理
教师命题时如果仅凭主观臆想,想当然地朝着自己设定的考查方向进行编制,往往容易陷入过于理论化、不切实际的误区。如2018年江苏省初中教师基本功大赛化学试卷(专业知识测试)中有这样一道题:下列为某地初三模拟试题,请指出存在的问题。
图5表示向一定量氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,横坐标表示加入的碳酸钠溶液的质量,纵坐标表示实验中得到的沉淀或气体的质量;图6表示一定体积的气体X和不同体积的氧气反应(若反应生成水,水为液态),横坐标表示通人的氧气体积,纵坐标表示反应后气体的总体积(反应前、后的温度与压强相同,同温同压下,相同体积的任何气体含有相同的分子数)。
图5过于理论化了,其中涉及C032-与H+、Ca2+的竞争反应,且溶液巾CO2不可能全部逸出,产生的HCO3-与Ca2+也能生成沉淀。
图6命题者认为应该是CH4,完全没有考虑CH4与02混合,不同比例的产物有C、CO、CO2等复杂情况,所以,几乎找不到对应的气体X能够表现出这种图像。
我们中学化学教师常年与中学教材、教辅资料打交道,加之与生产生活脱节,易出现主观臆断现象,导致教学、命题过程中出现科学性错误。我们只有多学习、多研究、多实践,教学、命题时依据客观实验事实或者在实验事实基础上进行合理地简化,才能确保教学、命题的科学合理性。
参考文献
[1]武汉大学,吉林大学等校编.高等学校教材无机化学上册[M].北京:高等教育出版社,1994:513
[2]吴晗清,李丹,赵冬青.速率”和“平衡”教学亟待澄清的误区[J].化学教学,2017(3):21-25
[3]徐作培.基于反应异常现象命制实验探究试题初探[J].化学教学,2017( 11):77-79
[4]吴星,吕琳,张天若.中学化学疑难辨析[M].江苏:江苏教育出版社,2012:192

