颅脑损伤诱导联合应用他克莫司促进周围神经再生实验研究*
何新泽,杨 涛,林书卿,李 芹,王成刚,高丽丽,于立志,孙金占,王 培
1.山东省滨州市中心医院(滨州251700);2.承德医学院附属医院手足外科(承德067000)
颅脑损伤合并周围神经损伤并不罕见,神经损伤后的恢复具有特殊性,功能恢复不全,致残率较高[1-6]。Wang、何新泽等研究发现,实验大鼠在颅脑损伤后合并周围神经损伤,损伤坐骨神经的修复速度加快,但修复机制尚不清楚[2-8]。研究发现他克莫司可促进损伤神经修复再生[3-14]。大量的实验发现,他克莫司促进周围神经损伤后的再生,主要通过免疫抑制、神经营养来实现[15-24]。本实验拟通过他克莫司促进神经损伤恢复机制,探索颅脑损伤促进神经损伤恢复的机制。
材料和方法
1 造模动物及材料 实验在2018年10月至2019年2月在滨州市中心医院完成。
1.1 实验动物:选用SPF级雄性SD大鼠180只,200~220 g[北京维通利华实验动物技术有限公司,许可证号:SCXK (京) 2012-0001]。饲养在昼夜各12 h节律下,实验室温度维持在(23±1)℃。将大鼠完全随机分为四组,每组45只。实验经过滨州市中心医院伦理委员会批准,按照国际动物实验标准执行。
1.2 主要设备及试剂:手术显微镜(LZL-6A型,镇江中天公司),光学显微镜(BH-3型,Olympus公司),电子分析天平(ESJ200-4 ±0.0001g),他克莫司(Tacrolimus)100mg(Selleck),Masson三色染色试剂盒(标准型,江苏Key GEN生物),Peroxidase来源于辣根100mg(Sigma)。
2 研究方法
2.1 造模:禁食水4 h,术前30 min,肌肉注射头孢唑啉钠10 mg/100g预防感染,术区备皮剪毛。10%水合氯醛按照0.35 ml/100g进行腹腔全麻。A组(颅脑损伤+坐骨神经损伤):消毒,沿头部正中矢状切开,在颅骨冠状线后1.5 mm、中线偏左5 mm处开直径5 mm骨窗,撞击造成中度脑损伤;右侧臀部,显微镜下完全切断坐骨神经,9-0无损伤线缝合坐骨神经外膜4~6针[11]。B组 (坐骨神经损伤):SD大鼠仅于显微镜下完全切断右侧坐骨神经,缝合坐骨神经外膜。
2.2 造模后的干预:分笼饲养在同样环境中。他克莫司用0.9%氯化钠稀释,1 ml 0.9%氯化钠+1 mg他克莫司,现用现配制,4℃恒温保存;造模手术12 h后,A1组SD大鼠给予他克莫司按1 mg/200 mg腹腔注射,A2组给予生理盐水按1 ml/200 mg腹腔注射,B1组大鼠给予他克莫司按1 mg/200 mg腹腔注射,B2组大鼠给予生理盐水按1 ml/200 mg腹腔注射。每日应用1次,连续2周。SD大鼠均存活。
3 观察指标
3.1 坐骨神经指数(Sciatic nerve function index,SFI)的测量:分别于造模后4、8、12周,每组每次随机取10只大鼠。根据Schiaveto de Souza A方法[8],实验侧足3个参数分别为:实验侧足印长度(SPL)、实验侧足趾宽度(STS)、实验侧中间足趾距离(SIT);正常侧足3个参数分别为正常侧足印长度(ZPL)、正常侧足趾宽度(ZTS)、正常侧中间足趾距离(ZIT)。
3.2 腓肠肌恢复率:造模手术4周、8周、12周,每组随机取5只大鼠,取下完整的双侧腓肠肌,吸取肌肉周围的血液,双侧腓肠肌在分析天平上称重。计算腓肠肌的恢复率,推测运动功能恢复的情况。
3.3 神经Masson染色:第4周、第8周、第12周,随机取5只大鼠,切取吻合口远、近端0.5 cm坐骨神经,10%甲醛固定,梯度酒精脱水,石蜡包埋,切片厚度5 μm,染色、封片,光学显微镜下观察神经纤维、胶原纤维增生情况。
3.4 辣根过氧化物酶(HRP)示踪:分别于造模术后第8周、第12周,于坐骨神经断端以远0.5 cm处,注入30%HRP溶液5 μl。深麻醉下开胸,灌流固定,取坐骨神经相应脊髓节段,横断面连续振荡切片30 μm。光镜下观察脊髓前角运动神经元中被标记为蓝染颗粒的胞体数目。
4 统计学方法 采用SPSS 19.0统计学软件,组间均数比较采用SNK-q检验;计数资料间接化法计算率,进行统计分析,以P<0.01为差异有统计学意义。
结 果
1 造模后大鼠基本生活状态 造模后所有动物均存活,未发现切口感染情况。造模手术后5 d B2组SD大鼠出现足部红肿明显,其他组红肿较轻。3周后,A2、B1、B2组SD大鼠足跟出现程度不同的溃疡面,A1组SD大鼠足部未见明显溃疡;12周时,各组SD大鼠足部溃疡基本痊愈,B2组SD大鼠出现足部的自食现象。
2 大鼠坐骨神经功能指数(SFI) 暗箱测试结果显示,造模后第4周,A1组与A2组、B1组与B2组SD大鼠的坐骨神经功能指数接近(P>0.05),A1组坐骨神经功能指数优于B1组、B2组,A2组坐骨神经功能指数优于B1、B2组(P<0.01);第4周后大鼠坐骨神经功能指数逐渐降低,第8、12周时,A2组与B1组大鼠坐骨神经功能指数接近(P>0.05),A1组坐骨神经功能指数优于A2、B1、B2组大鼠,A2组坐骨神经功能指数优于B2组,B1组坐骨神经功能指数优于B2组(P<0.01)。见表1。
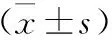
表1 脑损伤、他克莫司对周围神经损伤大鼠坐骨神经功能指数的影响
3 腓肠肌恢复率 4周后取材可见各组大鼠失神经支配的腓肠肌颜色均较健侧苍白,肌肉明显萎缩,8周、12周后A1组、A2组、B1组大鼠神经损伤侧腓肠肌恢复明显优于B2组。4周后,A2组大鼠腓肠肌恢复率与B1组、B2组大鼠腓肠肌恢复率、B1组大鼠腓肠肌恢复率与B2组大鼠腓肠肌恢复率比较差异无统计学意义(P>0.01),A1组大鼠腓肠肌恢复率优于A2组、B1组、B2组大鼠腓肠肌恢复率(P<0.01);4周后四组大鼠出现腓肠肌恢复率升高,第8、12周时,A1组与A2组大鼠腓肠肌恢复率比较差异无统计学意义(P>0.05),A1组大鼠的腓肠肌恢复率优于B1组、B2组、A2组、B1组大鼠的腓肠肌恢复率优于B2组大鼠腓肠肌恢复率(P<0.01);术后8周A2组大鼠腓肠肌恢复率优于B1组大鼠腓肠肌恢复率(P<0.01);术后12周A2组与B1组大鼠腓肠肌恢复率比较无明显统计学差异(P>0.01,图1)。
4 神经Masson三色法染色 造模4周后A1组、B1组神经纤维红染较多,绿色纤维较少,A2组绿染与红染均匀,B2组未见红染的神经纤维;造模8周后A1组、A2组、B1组可见绿染与红染均匀分布,B2组可见再生的轴突;造模12周后A1组胶原纤维均匀分布,并呈波浪形随神经纤维排列,A2组、B1组可见绿染与红染分布均匀,B2组可见大量胶原纤维,少量再生的轴突(图2)。
图1 脑损伤、他克莫司对周围神经损伤大鼠

图2 坐骨神经Masson三色染色(×400)

图3 辣根过氧化物酶(HPR)联苯胺染色(×400)
5 神经元HRP标记 光镜下,观察到相应脊髓节段的前角神经元细胞胞浆中发现标记成蓝黑色的HRP阳性颗粒细胞(图3)。每高倍视野下进行计数,统计分析结果;造模后第8周,各组脊髓神经元胞浆HRP标记阳性率比较差异有统计学意义(P<0.01),A1组脊髓前角阳性标记率高于A2组、B1组、B2组,A2组HRP标记细胞阳性率高于B1组、B2组,B1组HRP标记阳性率高于B2组;第12周时,A2组HRP标记脊髓前角阳性率与B1组大鼠脊髓神经元胞浆HRP标记阳性率接近(P>0.01),A1组HRP标记脊髓前角阳性率高于A2组、B1组、B2组,A2组HRP标记脊髓前角阳性率高于B2组,B1组HRP标记阳性率高于B2组(P<0.01)(图4)。
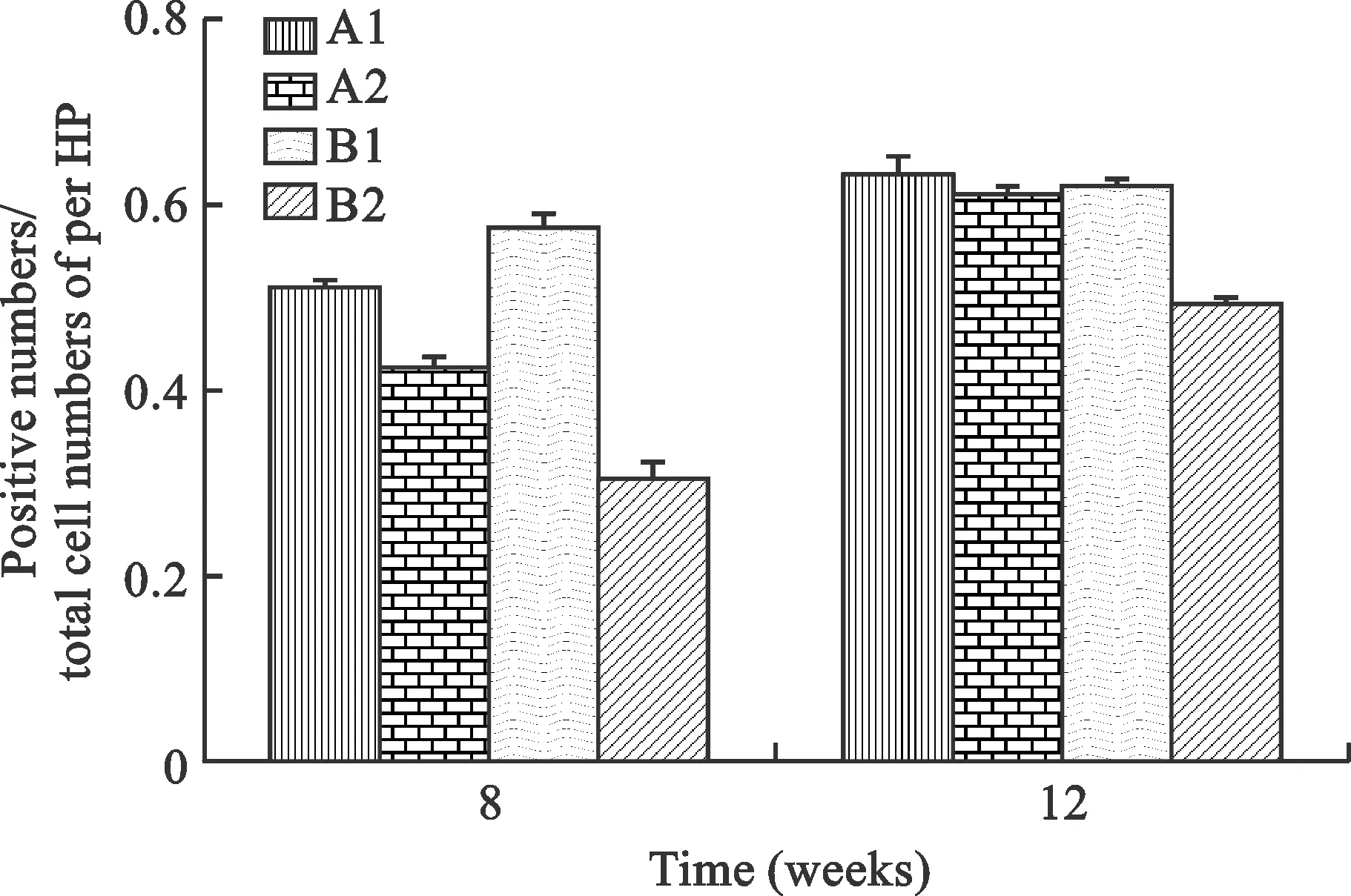
图4脑损伤、他克莫司对周围神经损伤大鼠脊髓神经元HRP标记阳性率(%)的影响(神经元胞浆中均发现标记成蓝黑色的HRP阳性颗粒)
讨 论
何新泽等动物实验发现大鼠脑损伤后损伤的坐骨神经的修复重建有明显促进作用,但具体修复机制尚不清楚[25-29]。本文通过动物实验比较颅脑损伤联合应用他克莫司的坐骨神经损伤大鼠,损伤后的坐骨神经损伤恢复的情况。在所有的实验观测项目中,颅脑损伤联合他克莫司(A1)组的坐骨神经修复效果要优于其他组,这也证实了颅脑损伤可以与他克莫司协同促进坐骨神经损伤后的修复,其作用机制与他克莫司不完全相同。
在Sunderland V型的外围神经损伤后,神经损伤切断了神经内分泌的养分,不能将其输送到靶子器官上,靶子器官将失去活性和营养的支持[23-24]。根据目前的他克莫司促进神经机制,促进外围神经修复相对明确是两个功能领域,发挥神经营养功能,形成一个FKBP12的综合体,加入功能地区后表达GAP-43,一个超蛋白质神经生长,并促进形成和扩大神经的生长由神经脉冲生成的生物电能,靶器官,再生轴突的内径上升,厚厚的神经膜层,作用范围增加[19-20]。这证实了他克莫司有助于恢复外围神经的营养功能,萎缩身体的部分看起来更容易溃疡,坐骨神经神经功能指数、湿重肌他克莫司组恢复较好,提示促进外形神经损伤的作用,结合功能或复杂的FKBP12 地区来促进表达GAP-43。
在外围神经损伤后,轴突的退化立即发生,轴突碎片是由巨噬细胞吞噬清除的,新的轴突、未退化的神经元延伸到由Schwann细胞组成的内膜神经的间隙,靶器官逐渐建立联系和营养[19]。靶子器官的恢复Masson染色、辣根过氧化物酶切片显示,A1组免疫抑制效果优于 A2组/B1组/B2组,他克莫司结合FKBP12,形成钙复合物抑制碱(CAN),抑制T细胞的衰减,并抑制IL-2、IL-3的表达,以生产免疫抑制物[6]被神经接收。
周围神经的损伤伴随着血液神经屏障的破坏,刺激纤维增生和巨噬细胞的扩散,形成影响神经修复的疤痕[21-22]。他克莫司可以抑制纤维素的扩散、迁移和生物活性,抑制纤维素的扩散,并通过免疫抑制作用促进神经损伤的重建和修复。Masson 染色观察到,A1组比A2组/B1组/B2组瘢痕减少;神经内分泌系统的调节,创造微型环境的因素、Schwann细胞的信号有助于促进轴突再生。神经交换的物质是轴浆的运输器官[25]和再生轴芽器官通过内膜管再生作用于目标器官。轴突内物质更好地恢复运输功能和靶器官的反馈是相互促进的[2]。辣根过氧化物酶染色证明A1组优于 A2组/B1组/B2组。免疫神经内分泌系统与脑损伤修复有密切的关系[26],自主神经系统的中心结构被摧毁,导致免疫调节紊乱、改变或丧失,功能脑细胞的变性,导致Caspase瀑布反应性的激活,从而导致神经凋亡。
本试验结果提示脑损伤伴随周围神经损伤动物早期应用他克莫司后,周围神经修复再生方面较好,脑损伤、他克莫司均可促进周围神经损伤的修复,并且协同促进神经损伤的修复效果更好,为脑损伤合并周围神经损伤的患者提供了新的治疗思路。但脑损伤促进周围神经损伤的具体机制仍需进一步深入研究。

