糜蛋白酶联合锡类散灌肠治疗溃疡性结肠炎的疗效及对患者炎症反应和免疫功能的影响
宋东旭,何洪芹,张文岭,李亚培
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性、非特异性结直肠炎性病变,好发于直、乙状结肠,主要表现为腹痛、腹泻和黏液脓血便。UC发病机制尚未完全明确,目前研究认为,肠黏膜屏障受损、免疫应答紊乱和细胞炎性反应是造成UC关键环节[1-2]。该病治疗困难,目前西医采用激素、免疫制剂和氨基水杨酸制剂为主,但长期西医治疗不良反应发生率升高,耐药性增加。而中药对促进溃疡愈合,降低疾病炎症程度有独到优势,故中西医结合治疗尤显重要。本研究收集2013年1月—2017年6月在沧州市人民医院确诊为UC的158例患者资料,观察对比糜蛋白酶联合锡类散保留灌肠疗法对UC患者临床症状的改善情况,探讨该疗法对患者炎症反应和免疫功能的影响,旨在为UC治疗筛选有效药物、方法,并提供依据。
1 材料和方法
1.1 一般资料 收集诊断为溃疡性结肠炎的患者158例。纳入标准参照“炎症性肠病诊断与治疗的共识意见”(2012,广州)[3]。排除标准:就诊时存在严重的肝肾疾病、恶性肿瘤等严重系统性疾病;具有免疫功能缺陷或低下等疾病;有严重并发症,如肠道穿孔、梗阻患者;不愿参加本研究及不合作者。按照随机数字表法分为治疗组83例和对照组75例,治疗组男45例,女38例,平均(45.3±14.3)岁,病变范围分类:直肠,28人,左半结肠,29人,广泛结肠,26人,根据Mayo[2]分级方法分为轻度31例,中度44例和重度8例。对照组男43例,女32例,平均(48.3±15.8)岁,病变范围分类:直肠,34人,左半结肠,27人,广泛结肠,14人,根据Mayo分级方法分为轻度27例,中度41例和重度7例。两组间性别、年龄构成差异无统计学意义(P>0.05)。
1.2 治疗方法 予两组患者柔软、易消化、富含维生素的高营养饮食,禁忌辛辣刺激、生冷生硬饮食,同时根据病情予静脉补液等支持治疗。对照组给予美沙拉嗪肠溶片口服、保留灌肠,灌肠液为生理盐水150 mL,同时加入庆大霉素80 000 IU、氟美松5 mg。治疗组以此为此基础,将糜蛋白酶4000 IU,锡类散3 g加至灌肠液,灌肠液温热至40 ℃,药物滴速控制在80滴/min左右,早晚各1次。治疗组与对照组灌肠1周后停用庆大霉素,将氟美松减量为2.5 mg,均继续再灌肠1周,两组患者均以2周为1个疗程,治疗2个疗程后复查病情。
1.3 临床观察指标
1.3.1 临床疗效标准评价 根据Mayo疾病活动指数评分,从便血、排便次数、内镜发现、医师总体评价方面评估UC的活动度,3~5分为轻度,6~10分为中度,11~12分为重度。疗效判定标准,参照“炎症性肠病诊断与治疗的共识意见”(2012,广州):(1)完全缓解:临床症状消失,复查结肠镜见黏膜大致正常或无活动性炎症;(2)有效:临床症状基本消失,复查结肠镜见黏膜轻度炎症;(3)无效:临床症状、结肠镜复查均无改善[3]。
1.3.2 内镜评分 治疗前后均行结肠镜检查,内镜下炎症程度评分参考Baron分级方法:黏膜正常记录0分;黏膜充血,血管纹理模糊记录1分;黏膜存在接触性出血记录2分;黏膜存在自发性出血记录3分;黏膜存在大小不等溃疡且合并出血记录4分。评分由2位内镜医师共同评价。
1.3.3 不良反应发生情况 治疗期间注意患者有无便秘、腹痛及肛门坠痛等不良反应,注意治疗过程中及治疗结束后患者有无肝肾功能损害。
1.4 试剂和检测方法
1.4.1 血清炎性活动指标检测 采集所有受试对象清晨空腹外周静脉血10 mL,交由检验科。魏氏法检测ESR,散射光比浊法检测CRP,ELISA(酶联免疫吸附)法检测外周血细胞因子TNF-α、IL-6。ELISA试剂盒购自美国Genzyme公司,依试剂盒说明书严格操作。
1.4.2 Th17细胞和Treg细胞检测 采集所有患者清晨抗凝静脉血5 mL,由检验科应用FACSCalibur流式细胞仪检测Th17和Treg细胞,按照荧光抗体试剂盒说明书操作,试剂盒和荧光抗体FITC-CD4、APC-CD17和PE-CD25购自于美国BD公司。
1.5 统计学方法 采用spss18.0统计软件包进行数据分析处理,计数资料采用卡方检验,定量资料采用表示,组内处理前后比较采用配对样本t检验、组间比较采用独立样本t检验,采用Spearman等级相关性分析做相关性检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床效果比较 治疗前两组患者Mayo评分差异无统计学意义。治疗后治疗组较对照组有效率更高,复发率更低。两组患者Mayo评分均下降,治疗组更为显著(P<0.05),见表1、表2。
2.2 内镜评分比较 治疗前两组患者内镜Baron评分差异无统计学意义。治疗后两组患者Baron评分均下降,治疗组更为明显(P<0.05),见表2。

表1 两组患者临床疗效比较
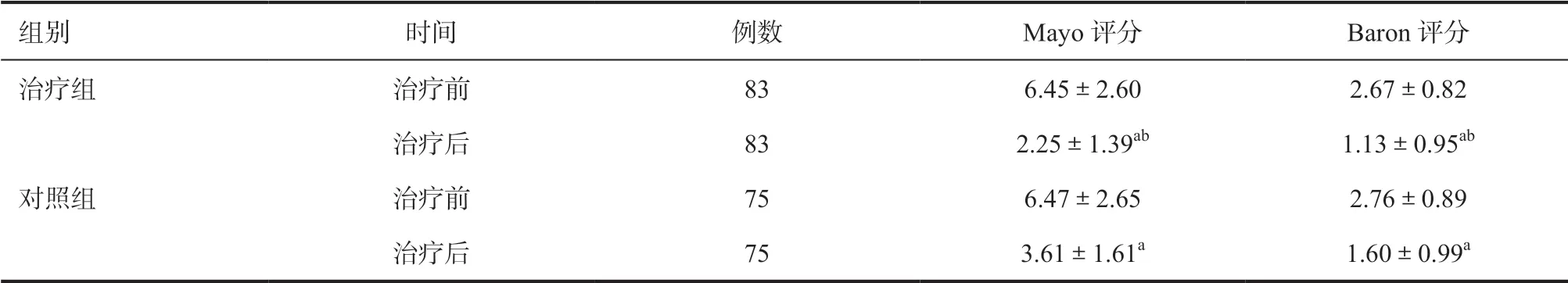
表2 两组患者Mayo、Baron评分情况比较
2.3 不良反应比较 两组各有2例患者灌肠后出现下腹坠痛,分析原因为灌肠对肠道刺激反应,均可自行缓解,未予特殊处理,两组患者均未出现肝、肾功能损害等其他不良反应。
2.4 血清炎性因子水平对比 两组UC患者ESR、CRP、TNF-α、IL-6表达较正常人群增加,TNF-α、IL-6与Mayo分级呈正相关。治疗前两组患者ESR、CRP、TNF-α、IL-6检测水平差异无统计学意义,治疗后各炎性因子表达均下降,治疗组下降更为明显,差异有统计学意义,见表3、表4。
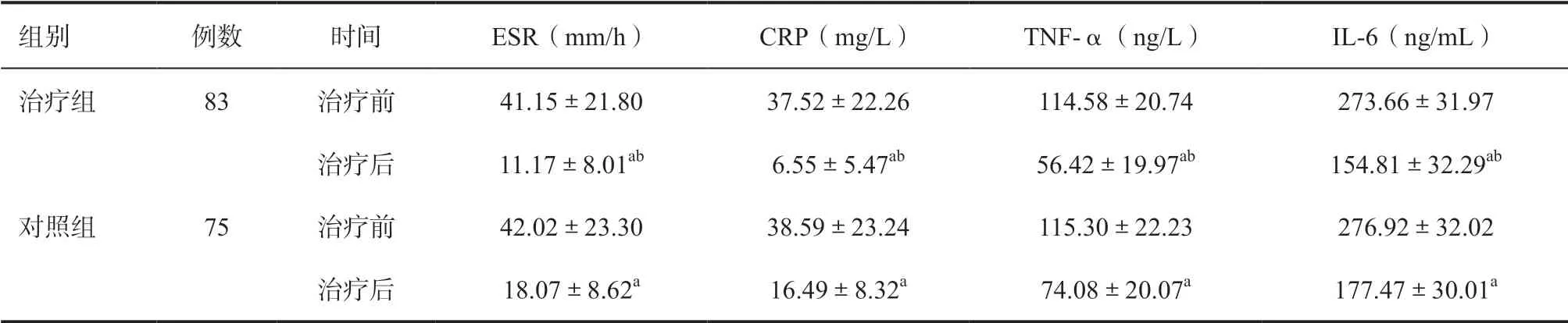
表3 UC患者ESR、CRP、TNF-α、IL-6水平表达
2.5 UC患者辅助性T细胞(Th17)和调节性T细胞(Treg)表达水平对比 两组UC患者Th17细胞数较正常人群增加,Treg细胞数较正常人群减少。Th17细胞与Mayo分级呈正相关,Treg细胞与Mayo分级呈负相关。治疗前两组患者Th17细胞和Treg细胞水平无明显差异,治疗后Th17细胞数下降,Treg细胞数上升,治疗组较对照组更为明显,见表4、表5。

表4 UC患者各亚组间TNF-α、IL-6、Th17细胞、Treg细胞与Mayo分级相关性分析

表5 UC患者外周血Th17细胞和Treg细胞表达情况
3 讨论
UC的病因和发病机制尚不明确,有学者认为炎性细胞因子失衡在UC发病过程中起重要作用,促炎因子表达水平升高会损害肠道黏膜,导致该病的发生[4],并且炎症反应程度高低和患者的病情以及预后等都具有相关性[5]。TNF-α由单核巨噬细胞产生,是炎症启动因子,能趋化炎性细胞,调节细胞因子表达水平,在机体炎症与免疫调节中发挥重要作用[6]。IL-6 主要由单核细胞分泌,也是一种促炎细胞因子,可以介导炎性反应,且有多重免疫调节功能,对机体生理平衡的维持至关重要,亦在UC发病中扮演重要角色[7]。本研究显示,在UC患者中,重要血清促炎因子TNF-α、IL-6 表达水平较正常人群升高,一般炎症指标ESR、CRP亦较正常人群升高,而且血清TNF-α、IL-6 水平与UC患者Mayo分级呈正相关,随疾病严重程度加重而表达增加。这也进一步说明炎性细胞因子参与UC的发病。
肠道免疫功能失调是UC发生、发展过程中的一环,研究认为,肠道黏膜受损后,通透性增加,肠组织长期暴露于大量抗原中,导致肠道免疫系统反应和错误识别,激活巨噬细胞和淋巴细胞,释放细胞因子和炎症介质,导致机体全身和局部免疫系统功能紊乱,进而引起组织损伤而发生UC[8]。Th17细胞是一种新发现的辅助性淋巴细胞亚群,主要分泌IL-17。除此之外.Thl7还能够分泌IL-6、TNF-α及IL-23等多种炎性细胞因子,在UC的发病及肠道黏膜免疫中起着重要的作用[9]。Eastaff-Leung等[10]也发现,与正常对照者相比,IBD患者不仅外周血中Th17 细胞比例显著升高,而且肠黏膜中IL-17 mRNA 表达也明显升高,提示Th17比例增加或功能亢进可能是导致IBD发病的原因之一。Treg细胞是一种具有免疫负调控作用的T淋巴细胞,一方面Treg细胞通过分泌大量IL-10、TGF-β等抗炎因子来抑制树突状细胞、巨噬细胞等释放促炎性细胞因子,另一方面其通过负性调控来抑制Th-17细胞的生成和IL-17的分泌,进而抑制炎症产生及扩大,维持人体肠道的免疫耐受[11]。本研究亦显示,UC患者Th17细胞较正常人群增加,而Treg细胞较正常人群减少,而且Th17细胞数与Mayo分级呈正相关,Treg细胞数与Mayo分级呈负相关,差异有统计学意义,也进一步说明Th17细胞与Treg细胞在UC的发病过程中起着重要的作用。
UC患者主要表现为腹痛、腹泻和黏液脓血便,症状反复、病程迁延,属于癌前病变,被WHO列为难治病之一,该病治疗方法虽多样,但目前尚缺乏满意疗法。西医治疗主要以氨基水杨酸制剂、激素及抗生素为主,取得了一定疗效,但激素长期应用副作用明显,抗生素长期应用则导致肠道菌群失调。UC好发病于直、乙状结肠,因此局部保留灌肠可使药物以高浓度作用于病灶,提高利用度,且肠壁黏膜吸收药物有效成分比内服快,可避免上消化道酸碱度和消化酶对药物的影响,延长药物作用时间。即使对病灶位于近端结肠者,药物仍可通过肠道黏膜毛细血管入血起效。但是美沙拉嗪、康复新等灌肠液费用昂贵,长期应用不良反应也随之出现,故临床更为需要经济实用的治疗药物。
糜蛋白酶是从牛胰腺提取的一种蛋白分解酶,能分解肽链,溶解脓液,分解坏死组织、血凝块,清洁净化创面,并减轻组织水肿、消退炎症,同时可加速肉芽生长及创面愈合。锡类散具有清热解毒、去腐生肌功效。实验研究认为,锡类散能改善患者TLR4表达及核转录因子NF-kB活化水平,减少炎性细胞因子释放,抑制炎症反应及免疫反应,起到修复黏膜、愈合溃疡面的作用[12]。前期糜蛋白酶缓解UC急性期病变,起到“清理战场”的铺垫作用,以此为基础锡类散可直接作用于创面,进一步发挥抗炎、抑制免疫反应作用。故糜蛋白酶与锡类散具有相互补充的作用,糜蛋白酶使锡类散的抗炎作用达到了最大化。本研究显示,治疗组较对照组患者临床症状改善更为明显,总有效率更高,Mayo评分、内镜评分下降更为显著,充分说明了糜蛋白酶联合锡类散保留灌肠疗法的临床有效性。
本研究显示,治疗后两组患者血清ESR、CRP、TNF-α、IL-6表达水平下降,治疗组更为显著,表明糜蛋白酶联合锡类散保留灌肠疗法抑制了血清炎性因子ESR、CRP、TNF-α、IL-6的表达,分析原因,早期糜蛋白酶净化创面的作用,使锡类散更充分的作用于创面,起到抗炎作用,而炎症的消退又促进了肠黏膜的修复。本研究亦显示,治疗后两组患者Th17细胞下降,Treg细胞上升,治疗组更为显著,提示改善肠道免疫功能可能是糜蛋白酶联合锡类散保留灌肠疗法作用的一个靶点,糜蛋白酶的“清创”和锡类散的“抗炎”改善了肠道的炎性环境,通过抑制炎性细胞因子的释放,调控了免疫细胞水平、纠正了肠黏膜免疫功能紊乱状态。
糜蛋白酶联合锡类散保留灌肠疗法临床效果显著,调控UC患者炎性细胞因子水平,恢复肠黏膜的免疫平衡状态可能是其作用机制。UC发病机制复杂,故糜蛋白酶联合锡类散保留灌肠疗法的作用靶点需进一步研究。

