马钱子碱通过调控线粒体凋亡途径诱导人胰腺癌CFPAC-1细胞凋亡
田龙夫 张琦 崔立华 杨磊 周易 田余 马波
1黄冈市中心医院肿瘤科,黄冈 438000;2天津市中西结合医院南开医院天津市急腹症器官损伤中西医结合修复重点实验室,天津 300100;3天津市南开医院肿瘤外Ⅱ科,天津 300100
马钱子碱是来源于传统中草药马钱子中的一种弱碱性吲哚型生物碱,又叫番木鳖碱,分子式C23H26N2O4,相对分子质量394 000,主要存在于马前科植物马钱子干燥的成熟种子,在《本草纲目》中记载“状似马之连钱,故名马钱”。目前国内外研究发现马钱子碱具有明显的抗炎、镇痛、抗肿瘤、兴奋中枢神经系统、调节免疫等功效[1],对结肠癌、肝癌、肺癌、乳腺癌、白血病、胶质母细胞瘤等均具有抗肿瘤作用[2-7],但其在治疗胰腺癌方面的相关研究国内外均未见报道。本研究观察马钱子碱对人胰腺癌CFPAC-1细胞凋亡的影响,探讨其作用机制。
材料与方法
一、材料
人胰腺癌CFPAC-1细胞系由天津市南开医院天津市急腹症器官损伤中西医结合修复重点实验室张琦博士惠赠。马钱子碱(Brucine)购于中国成都植标化纯生物技术有限公司(批号:357573)。DMEM培养基购自Gibco公司,胎牛血清购自Hyclonge公司,二甲基亚砜购自Solarbio公司,MTT粉购自Amresco公司;细胞裂解液(RIPA)和BCA蛋白定量试剂盒购自Thermo公司,磷脂结合蛋白V/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自Wanleibio公司,花青染料(JC-1)试剂盒购自YEASEN公司,Immobilon-P转印膜购自Millipore公司;兔抗小鼠Bcl-2、Bax、GAPDH一抗及抗兔IgG均购自Cell Signaling Technology公司。
二、细胞增殖抑制率检测
采用MTT比色法检测CFPAC-1细胞的增殖抑制率。CFPAC-1细胞复苏后常规培养、传代。取对数生长期CFPAC-1细胞,胰酶常规消化后制成单细胞悬液,按5×103个细胞/200 μl接种于96孔培养板,培养到细胞完全贴壁后清洗2次,加入含有马钱子碱终浓度为0.05、0.1、0.2、0.4、0.8 mmol/L的DMEM培养液分别孵育24、48、72 h,以不加马钱子碱干预作为对照组。每个浓度、每个培养时间均设3个复孔。培养到时间点时每孔加入5 mg/ml MTT 20 μl,继续培养4 h,吸掉上清液,每孔加入DMSO 150 μl,常温下低速振荡15 min,置全自动酶标仪以570 nm波长测每孔A570值,根据(1-加药组平均A570值/对照组平均A570值)×100%公式计算增殖抑制率。
三、细胞凋亡率检测
采用流式细胞仪检测细胞凋亡率。取对数生长期CFPAC-1细胞,以3×105个细胞接种于6孔板中,待细胞贴壁后应用0.4、0.8 mmol/L马钱子碱干预48 h,以不加马钱子碱干预作为对照组。消化并收集细胞后,取1 ml细胞悬液分别加入5 μl Annexin V-FITC染色液,混匀后室温避光10 min,再加10 μl的PI染色液,混匀后避光反应5 min,上流式细胞仪检测细胞凋亡率。
四、线粒体膜电位检测
采用JC-1染色法检测细胞线粒体膜电位。取对数生长期CFPAC-1细胞接种于12孔板,待细胞完全贴壁后应用0.4、0.8 mmol/L马钱子碱干预48 h,以不加马钱子碱干预作为对照组,按照JC-1试剂盒说明书步骤进行染色,置于倒置荧光显微镜下观察红、绿色荧光强度的变化并摄片。
五、细胞Bax、Bcl-2蛋白表达检测
取对数生长期CFPAC-1细胞接种于6孔板,待细胞贴壁后采用0.4、0.8 mmol/L马钱子碱干预48 h,以不加马钱子碱干预作为对照组,置冰上用RIPA裂解液裂解细胞并提取细胞总蛋白,采用BCA法定量蛋白,取40 μg样本行蛋白质印迹法检测细胞Bax、Bcl-2蛋白表达,以GAPDH为内参。抗Bcl-2、Bax一抗1∶1 000稀释,二抗1∶1 000稀释,最后使用ECL发光,X片曝光、显影、定影。用Quantity One软件分析获取条带的灰度值,以目的条带与内参条带灰度值比为蛋白相对表达量。
六、统计学处理
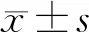
结 果
一、马钱子碱对CFPAC-1细胞的增殖抑制率
马钱子碱干预呈浓度及时间依赖性地抑制CFPAC-1细胞的增殖,其中,同一时间0.4、0.8 mmol/L马钱子碱干预对CFPAC-1细胞增殖抑制率显著高于对照组,且不同时间两两组间比较的差异均有统计学意义(表1)。

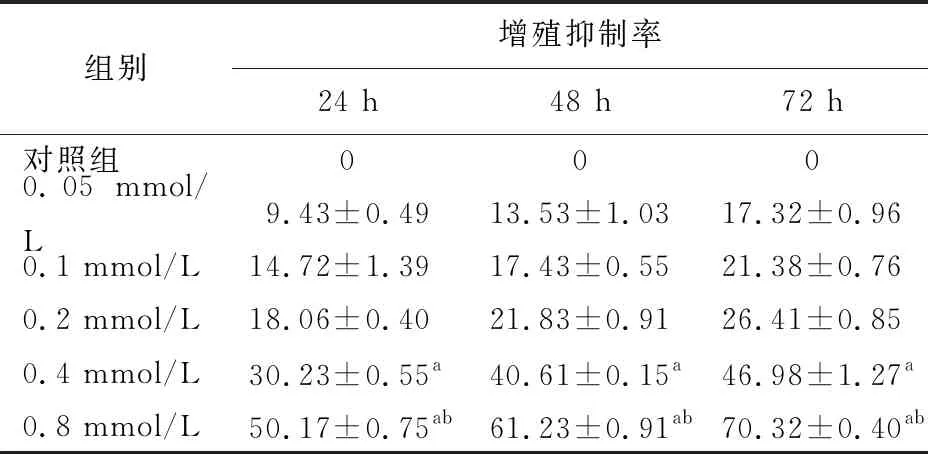
组别增殖抑制率24 h48 h72 h对照组0000.05 mmol/L9.43±0.4913.53±1.0317.32±0.960.1 mmol/L14.72±1.3917.43±0.5521.38±0.760.2 mmol/L18.06±0.4021.83±0.9126.41±0.850.4 mmol/L30.23±0.55a40.61±0.15a46.98±1.27a0.8 mmol/L50.17±0.75ab61.23±0.91ab70.32±0.40ab
注:同一时间不同浓度组与对照组比较,aP<0.05;同一浓度不同时间两两组间比较,bP<0.05
二、马钱子碱对CFPAC-1细胞凋亡率的影响
对照组及0.4、0.8 mmol/L马钱子碱干预组CFPAC-1的细胞凋亡率分别为(2.92±0.46)%、(4.64±1.31)%、(13.09±0.65)%,随药物浓度增加而逐渐升高,其中0.8 mmol/L干预组的细胞凋亡率显著高于对照组,差异有统计学意义(P<0.05,图1)。
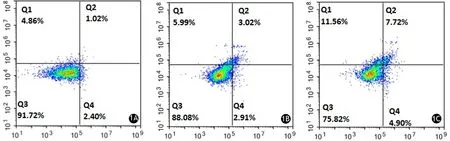
图1 对照组(1A)及0.4、0.8 mmol/L马钱子碱干预组(1B、1C)CFPAC-1细胞凋亡率比较
三、CFPAC-1细胞线粒体膜电位的变化
JC-1聚集物提示未凋亡的活细胞呈红色荧光形式存在,JC-1荧光单体提示凋亡和坏死细胞呈绿色荧光形式存在。对照组JC-1以聚合物形式出现红色荧光。0.4、0.8 mmol/L马钱子碱干预CFPAC-1细胞48 h后,随着药物浓度的增加红色荧光逐渐减少,而绿色荧光逐渐增多,提示线粒体膜电位受到重度破坏而降低(图2)。
四、马钱子碱对CFPAC-1细胞Bcl-2、Bax蛋白表达的影响
对照组及0.4、0.8 mmol/L马钱子碱干预组CFPAC-1细胞的Bcl蛋白表达量分别为(0.92±0.12)、(0.67±0.14)、(0.35±0.14)mmol/L;Bax蛋白表达量分别为(0.56±0.12)、(0.85±0.10)、(1.15±0.12)mmol/L。随马钱子碱浓度增加,Bcl-2表达量显著下调,而Bax表达量显著上调,差异均有统计学意义(P值均<0.05,图3)。
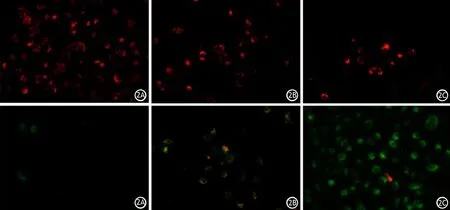
图2 对照组(2A)及0.4、0.8 mmol/L马钱子碱干预组(2B、2C)48 h后CFPAC-1细胞线粒体膜电位变化(荧光显微镜 ×200倍;上图为JC-1红色荧光聚合物,下图为JC-1绿色荧光单体)
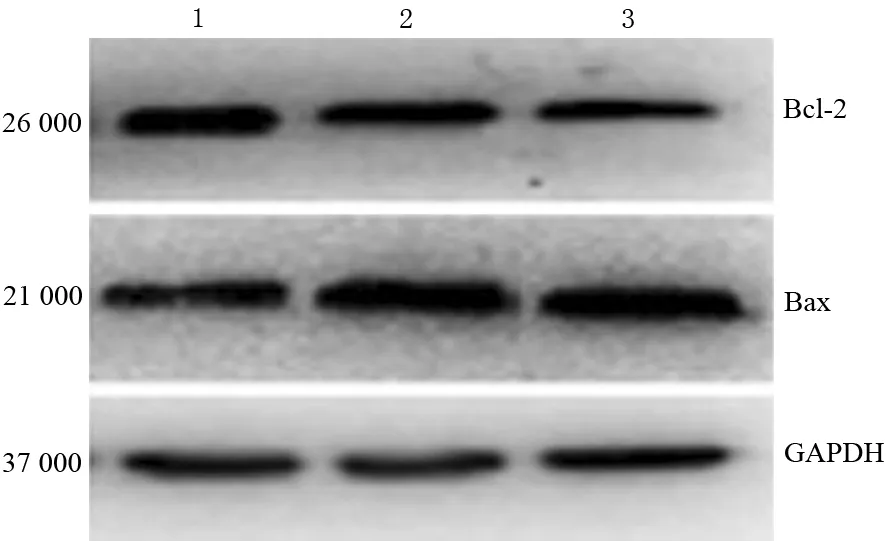
图3 对照组(1)及0.4、0.8 mmol/L马钱子碱干预组(2、3)CFPAC-1细胞Bcl-2、Bax蛋白的表达
讨 论
胰腺癌是一种被称为“癌中之王”的消化道恶性肿瘤,其病因及发病机制目前尚未完全明确,细胞凋亡在胰腺癌肿瘤发生发展中占有十分重要的地位[8]。细胞凋亡是细胞程序性死亡,线粒体凋亡途径、死亡受体凋亡途径和内质网途径均参与细胞凋亡,以线粒体凋亡途径最为经典。该途径具有3个明显特点:磷脂酰丝氨酸膜外翻提示早期凋亡发生,线粒体损伤体现在线粒体膜电位降低提示中期凋亡,DNA链断裂提示晚期凋亡。在内源性线粒体途径中Bcl-2家族蛋白调控线粒体完整性,包括蛋白Bcl-2相关蛋白(Bax、Bid、Bak)等[9],Bcl-2是抑制凋亡蛋白重要基因,Bax是促进细胞凋亡蛋白关键基因,均为主要影响细胞凋亡的关键因素[10]。
近年来马钱子碱已被逐步证实具有抗肿瘤作用,其机制主要表现在诱导细胞凋亡、抑制血管生成、调控信号通路及抗肿瘤侵袭转移等方面[2-7]。李苗等[4]研究证实,马钱子碱通过下调细胞周期蛋白D1和细胞周期蛋白 E的表达,阻断G0/G1期细胞周期,抑制人肺癌细胞株PC-9的增殖。Deng等[11]研究证实,马钱子碱能诱导人肝癌HepG2细胞增殖和凋亡,其机制是损害线粒体膜电位,引起Ca2+升高,且降低Bcl-2蛋白表达[12]。冯静和马艳萍[13]研究发现,马钱子碱可上调人骨髓瘤U266细胞的半胱氨酸蛋白酶-8、Bax蛋白表达,同时下调JAK-STAT通路中转录激活因子-3、转录激活因子-5的mRNA表达,诱导细胞凋亡,同时也能阻滞细胞周期及损伤线粒体膜蛋白,致使细胞色素C释放诱导人多发性骨髓瘤RPMI 8226细胞凋亡[7]。余志艳和李平[14]研究发现,马钱子碱作用人乳腺癌MDA-MB-231后可下调抑制凋亡基因Bcl-2表达,上调促凋亡基因Bax和半胱氨酸蛋白酶-3表达。马钱子碱也能明显抑制人早幼粒白血病HL-60细胞的增殖并诱导细胞凋亡,其机制可能与上调Bax、下调Bcl-2表达有关[15]。
本研究结果显示,马钱子碱呈药物剂量及时间依赖性抑制CFPAC-1细胞增殖,增加CFPAC-1的细胞凋亡率,降低线粒体膜电位变化,使Bax表达水平上调,Bcl-2表达水平下调,提示膜电位可能对线粒体凋亡途径有一定作用,但马钱子碱治疗胰腺癌其他相关作用机制还有待后续更深入的研究。
利益冲突所有作者均声明不存在利益冲突

