饲粮添加丁酸梭菌对断奶仔猪肠道健康的影响
王海亮,钱 坤*
(1.天津市农业农村委员会,天津 300061;2.天津市农业生态环境监测与农产品质量检测中心,天津 300402)
丁酸梭菌是厌氧菌,革兰氏染色后呈阳性,显微镜下观察为直杆状、也见有弯曲状,单双均有、链不长,偶尔发现丝状菌体,中间隆起,呈煎蛋样。细菌直径约(0.5~1.7)×(2.4~7.6)µm,因周生鞭毛,能够运动,内生孢子。可以利用单糖或多糖等碳水化合物代谢产酸,导致牛奶发酸、固化、产气,但不消化[1]。
试验研究表明,丁酸梭菌在实验室平板上培养后,边缘整齐,但不规则,略有酸臭味,并且其明显特征之一是可以产淀粉酶,但无法水解纤维素和不能消化血清蛋白,碳水化合物被其水解后的终产物是丁酸、乳酸及醋酸等有机酸,同时有少许的丙酸、甲酸、硝酸盐产生,对其进行还原试验,检测结果都是阴性。有研究报道,丁酸梭菌耐受力较强,耐受外部的高温,耐受外部的低pH浓度:在80 ℃热源下加热30 min后能够全部存活,90 ℃热源下加热10 min 后仍能全部存活,保持活性,加热20 min 后,存活率为95%;即使100 ℃加热5 min,存活率为30%,pH 为1.0~5.0 依然可以存活,适宜存活的pH 范围为4.0~9.8[2]。丁酸梭菌是益生菌之一,已作为抗生素替代品添加在实际生产中推广使用[3]。
丁酸梭菌在动物肠道内的主要特性分别是:加快机体肠道中益生菌(乳酸杆菌,嗜酸乳杆菌等)的定植和繁衍,阻碍肠道中的条件性致病菌、腐败菌等有害菌的繁衍,维持消化道内微生态平衡,降低肠道中毒素的产生;可以在畜禽肠道中代谢得到多种促生长因子,如维生素、淀粉酶等物质,发挥保护畜禽健康的功效;丁酸是该菌的代谢营养物,可促进肠道上皮细胞相关紧密连接蛋白的表达及组织的再生与修复;该菌对多类饲用抗生素而言拥有特别强的耐受性,且不受机体分泌的有机酸等物质的影响,配伍禁忌少,使用方便。丁酸梭菌已成为一种新型抗生素替代品添加剂用于养殖业的实际生产中,可以减少抗生素的使用量,降低动物产品中的药物残留及产生的耐药性,维持动物消化道中菌群平衡,提高动物健康状况,促进动物机体的生长和生产性能的充分发挥[4-6]。
本研究对丁酸梭菌制剂的试验室生物活性进行分析,并通过测定相关的血清指标、肠道微生物、肠道结构和紧密连接蛋白表达来研究丁酸梭菌对断奶仔猪肠道结构发育和健康状况的影响。
1 材料与方法
1.1 丁酸梭菌
丁酸梭菌制剂来源于仰韶生化工程(河南)有限公司,丁酸梭菌含量为2.0×109cfu·g-1,进行倍比稀释添加到基础日粮中。
1.2 试验设计
试验采用单因子设计,选取(28±2)日龄、健康状况良好、平均体重为(7.26±0.42)kg的(杜×长×大)断奶仔猪16 头,按完全随机区组设计分成2个处理,每个处理4个重复,每个重复2头仔猪,饲养于专用代谢笼中,试验期为28 d。两个处理组分别饲喂:阴性对照组:饲粮不添加丁酸梭菌;试验组:基础饲粮添加丁酸梭菌制剂,浓度为1×105cfu·g-1。
1.3 试验日粮
试验使用玉米-豆粕型基础日粮,配制方法参照NRC(1998)猪饲养标准(见表1)。
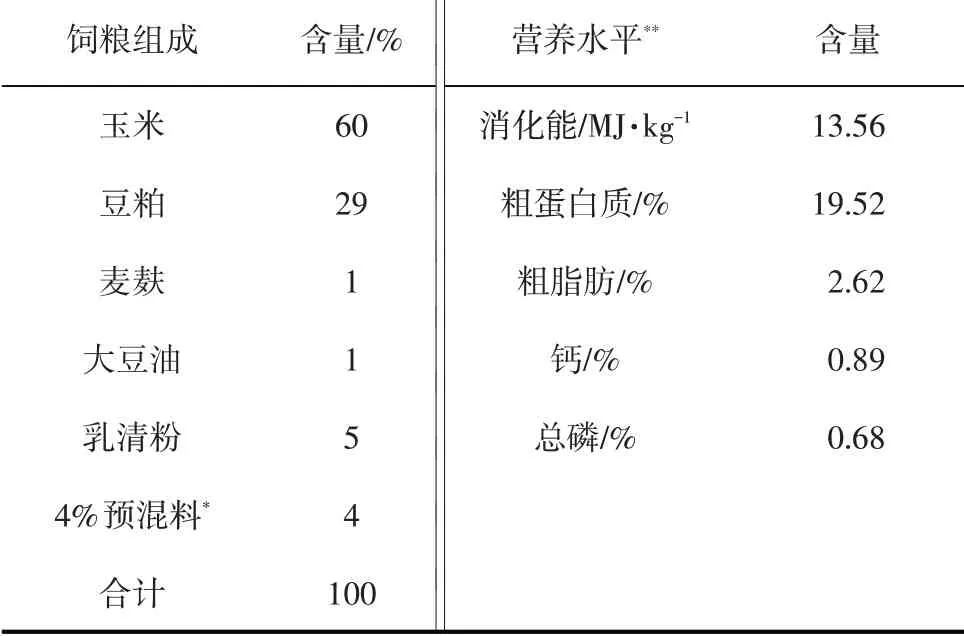
表1 基础饲粮组成及其营养水平
1.4 饲养管理
试验在河北省定州市海丰养殖有限公司完成。试验期间猪只封闭饲养,自由采食干粉料,饮水不限,猪舍环境温度稳定在25~28 ℃。预试期为3 d,试验期为28 d。试验期内每日观察仔猪的健康状况,记录死淘仔猪数以及腹泻、用药情况,其他饲养管理和免疫按照常规程序进行。试验完成时,2 个处理的4 个重复各分别随机选择1 头正常的断奶仔猪实施屠宰试验,采取所需样品。剖杀前12 h 禁食,屠宰前用真空促凝管进行采血,然后立即使用颈静脉放血的办法将其处死,消毒、剖开腹腔,立即结扎喷门瓣、幽门瓣、直肠远端,无菌取十二指肠、空肠、回肠、盲肠等内容物,放于液氮速冻后,转放到-80 ℃冰箱中冻存以待分析。取十二指肠、空肠、回肠、盲肠等中段各两份约5 cm 肠管,用PBS 冲洗,1 份置于液氮速冻,然后转放到-80 ℃冰箱中冻存以待分析,1 份存放至10%中性福尔马林固定液中,摇匀,待做组织切片。
2 检测指标和方法
2.1 肠道微生物
在无菌条件下称取所采各肠道样品内容物1 g,用9 mL无菌生理盐水溶解,并将其充分混匀,并进行10倍逐级梯度稀释,直至10-7,选择10-5、10-6及10-73个稀释度,吸取稀释液0.1 mL,接种到培养基上进行乳酸杆菌和厌氧菌培养。选取稀释度为10-2~10-5的不同梯度,吸取稀释液0.2 mL至相应的平板培养基上完成大肠杆菌与好氧菌的计数。大肠杆菌计数采用麦康凯琼脂培养基:蛋白胨20.0 g·L-1,乳糖10.0 g·L-1,胆盐5.0 g·L-1,氯化钠5.0 g·L-1,中性红0.075 g·L-1,琼脂12.0 g·L-1,pH(7.4±0.2)。总好氧菌用脑心浸液琼脂培养基:牛脑浸液12.5 g·L-1,牛心浸液5.0 g·L-1,蛋白胨10.0 g·L-1,氯化钠5.0 g·L-1,葡萄糖2.0 g·L-1,磷酸氢二钠2.5 g·L-1,琼脂10.0 g·L-1,pH(7.4±0.2)。乳酸杆菌计数采用Rogosa 琼脂:胰蛋白胨10.0 g·L-1,酵母膏5.0 g·L-1,葡萄糖20.0 g·L-1,吐温80 1.0 mL·L-1,磷酸二氢钾6.0 g·L-1,柠檬酸铵2.0 g·L-1,乙酸钠17.0 g·L-1,硫酸镁0.575 g·L-1,硫酸锰0.12 g·L-1,硫酸 亚 铁 0.034 g · L-1, 琼 脂 20.0 g·L-1,pH(5.4±0.2)。总厌氧菌计数采用Wilkinschalgren 厌氧琼脂:胰蛋白胨10.0 g · L-1,明胶胨10.0 g·L-1,酵母膏5.0 g·L-1,葡萄糖1.0 g·L-1,氯化钠5.0 g·L-1,精氨酸1.0 g·L-1,丙酮酸钠1.0 g·L-1,VK30.000 5 g·L-1,氯化血红素0.005 g·L-1,琼脂18.0 g·L-1,pH(7.1±0.2)。研究的厌氧菌与乳酸杆菌的琼脂培养基制成Hungates滚管,使用平板培养好氧菌及大肠杆菌。将全部培养基放于恒温培养箱中,37 ℃培养24~48 h后计数。所有稀释度均做2 个滚管或平板,用30~300 个菌落的滚管或平板的稀释度来计数。
2.2 肠道结构
将在10%中性福尔马林液中固定24 h 后的标本取出,按顺序进行洗涤、脱水、透明、透蜡、包埋后,将其修剪成1 cm×1 cm×1 cm 样品块,用莱卡切片机制成石蜡切片,HE 染色、封片后低倍镜(5×)下观测,选择代表性视野,用Leica Qwin图象分析系统对切片图像进行分析,各个样品均观察3张以上非连续切片,每张切片观察15~20 根完整、长并且直的肠绒毛及相对应的隐窝,测量后计算出绒毛高度及隐窝深度的平均值用于试验测定数据。
2.3 血清D-乳酸和二胺氧化酶(DAO)
ELISA法测定各组仔猪血清中D-乳酸和DAO,ELISA法检测按照说明书操作。D-乳酸ELISA试剂盒为上海酶联生物科技有限公司产品。
2.4 RT-PCR检测肠上皮细胞紧密连接mRNA表达
设计ZO-1、Occludin、Claudin-1 和Gapdh 共4对引物(均由上海生工合成),利用T165-48多样品组织研磨机(上海净信实业发展有限公司,中国)对定量空肠样品破碎,tacoTMRNA 萃取试剂盒提取RNA,利用All-in-OneTMFirst-cDNA Synthesis 试剂盒和PCR 仪(Eppendorf 384 梯度PCR 仪),将空肠RNA 反转录成cDNA。利用SYBR⑩Premix Ex Taq TM 荧光定量试剂盒和荧光定量PCR 仪(Applied Biosystems)检测ZO-1、Occludin和Claudin-1[7-10]。
用tacoTMRNA 试剂盒提取断奶仔猪空肠和回肠肠段上皮细胞中总RNA,利用All-in-OneTMFirstcDNA Synthesis 试剂盒,按照其说明书步骤分别将空肠和回肠RNA 逆转录为cDNA。利用SYBR⑩Premix Ex TaqTM荧光定量试剂盒,按照其说明步骤,以1ulcDNA 为模板进行PCR 扩增,实时定量PCR样品反应体系采用SYBR Green I,其最终反应体系为15 µL,每个基因4 个平行。反应条件为
Hold stage:95 ℃10 min;Cycling stage:95 ℃10 s,61 ℃20 s;72 ℃10 s,40 cycles;Melt curve:72 ℃10 s,95 ℃10 s。每个样品均设置相应未经逆转录的模板作为阴性对照,同时每个样品均设置相应的内参作为对照,得到各自的荧光阈值循环数(Ct 值),采用相对定量法2-ΔΔCt进行计算。定量PCR引物见表2。
2.5 统计分析
试验数据采用SAS 9.1.3 的one-way ANOVA、LSD进行方差分析和t检验。

表2 定量PCR引物
3 试验结果
3.1 饲粮添加丁酸梭菌对仔猪肠道微生物的影响
当饲粮中丁酸菌添加量为0时,仔猪肠道十二指肠中单好氧菌、乳酸杆菌、大肠杆菌的值分别为4.85、5.78、3.89 cfu·g-1;空肠中单好氧菌、乳酸杆菌、大肠杆菌的值分别为5.01、6.38、3.52 cfu·g-1;回肠中单好氧菌、乳酸杆菌、大肠杆菌的值分别为4.86、6.62、3.92 cfu·g-1;盲肠中单好氧菌、乳酸杆菌、大肠杆菌的值分别为5.34、7.15、4.15 cfu·g-1。当饲粮中丁酸菌添加量为1×105cfu·g-1时,仔猪肠道十二指肠中,单好氧菌、乳酸杆菌、大肠杆菌的值分别为4.72、6.02、3.92 cfu·g-1;空肠中,单好氧菌、乳酸杆菌、大肠杆菌的值分别为5.13、6.74、3.40 cfu·g-1;回肠中,单好氧菌、乳酸杆菌、大肠杆菌的值分别为4.69、6.95、3.67 cfu·g-1;盲肠中,单好氧菌、乳酸杆菌、大肠杆菌的值分别为5.19、7.32、3.96 cfu·g-1。
饲粮添加丁酸梭菌1×105cfu·g-1组与对照组相比,试验组的十二指肠、回肠和盲肠的总好氧菌分别降低了2.68%、3.50%和2.81%,但差异均不显著(P>0.05),而试验组的空肠总好氧菌提高了2.40%,差异不显著(P>0.05);试验组的十二指肠、空肠、回肠和盲肠的乳酸杆菌分别提高了4.15%、5.64%、4.98%和2.38%,其中十二指肠和盲肠的乳酸杆菌数量与对照组相比,差异不显著(P>0.05),空肠和回肠的乳酸杆菌数量与对照组相比差异显著(P<0.05);与对照组相比,十二指肠大肠杆菌的数量提高0.77%(P>0.05),空肠、回肠和盲肠的大肠杆菌数量分别降低3.41%(P>0.05)、6.38%(P>0.05)和4.58%(P>0.05)。
3.2 饲粮添加丁酸梭菌对仔猪肠道结构的影响
当饲粮中丁酸菌添加量为0时,仔猪肠道十二指肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为420µm、303µm和1.39;空肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为325 µm、189 µm、1.72;回肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为280 µm、168µm、1.67。当饲粮中丁酸菌添加量为1×105cfu·g-1时,仔猪肠道十二指肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为432µm、288µm和1.50;空肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为368µm、172µm 和2.14;回肠中绒毛高度、隐窝深度、绒毛高度∕隐窝深度的值分别为305µm、145µm和2.10。
与对照组相比,试验组的十二指肠、空肠和回肠的绒毛高度分别提高了2.86%、13.23%和8.93%,而十二指肠和回肠的绒毛高度差异不显著(P>0.05),空肠的绒毛高度差异显著(P<0.05);试验组的十二指肠、空肠和回肠的隐窝深度分别降低了4.95%、8.99%和13.69%,但差异不显著(P>0.05);试验组十二指肠的绒毛高度∕隐窝深度提高了7.91%,但差异不显著(P>0.05),空肠的绒毛高度∕隐窝深度较对照组提高了24.42%,差异显著(P<0.05),回肠的绒毛高度∕隐窝深度较对照组提高了25.75%,差异显著(P<0.05)。
3.3 饲粮添加丁酸梭菌对仔猪血清D-乳酸和DAO的影响
当饲粮中丁酸菌添加量为0 cfu · g-1时,仔猪血清D-乳酸和DAO 的值分别为235 mmol · L-1和3.48 U·mL-1;当饲粮中丁酸菌添加量为1×105cfu·g-1时,仔猪血清D-乳酸和DAO 的值分别为221 mmol · L-1和3.05 U · mL-1。饲粮添加1×105cfu·g-1的丁酸梭菌,与对照组相比,D-乳酸降低5.96%,但差异不显著(P>0.05),而二胺氧化酶DAO显著降低12.36%,差异显著(P<0.05)。
3.4 饲粮添加丁酸梭菌对仔猪肠道紧密连接蛋白表达的影响
当饲粮中丁酸菌添加量为0 时,仔猪空肠中ZO-1、Occludin、Claudin-1 的值都为1.00 cfu ·g-1;当饲粮中丁酸菌添加量为1×105cfu·g-1时,仔猪空肠中ZO-1、Occludin、Claudin-1 的值分别为1.05、1.35、1.12 cfu·g-1。
与对照组相比,试验组空肠ZO-1 mRNA 水平的表达提高5%(P>0.05),Occludin mRNA 水平的表达显著提高35%(P<0.05),Claudin-1 mRNA 水平的表达提高了12%,但差异不显著(P>0.05)。
4 讨 论
与对照组相比,饲粮添加丁酸梭菌浓度分别为5×104、1×105和5×105cfu·g-1的试验组在28~42 日龄阶段和42~56日龄阶段对仔猪生长性能影响较显著;与对照组相比,试验组在各日龄阶段对仔猪的腹泻影响极显著;与对照组相比,试验组有阻碍有害菌繁殖的趋势,并且加快有益菌繁殖,增加有益菌数量;与对照组相比,试验组空肠的绒毛高度、空肠的绒毛高度∕隐窝深度和回肠的绒毛高度∕隐窝深度差异显著;与对照组相比,试验组对仔猪血清D-乳酸的浓度影响不显著,而对DAO 的活性显著提高;与对照组相比,试验组可提高仔猪空肠黏膜紧密连接蛋白mRNA水平的表达。
与对照组相比,试验组的十二指肠、回肠和盲肠的总好氧菌数量均有降低趋势,空肠和回肠的乳酸杆菌数量均显著提高(P<0.05),空肠、回肠和盲肠大肠杆菌数量均有降低趋势。本次试验结果基本上符合前人的研究,当然还有一定的误差,在这次试验中我们没有涉及到肠道内pH 的测定,因此让本次试验的结果产生误差。但是在仔猪饲粮中添加丁酸梭菌确实降低了仔猪肠道内的大肠杆菌数量,增加了乳酸杆菌即益生菌的数量。
本研究中,饲粮添加丁酸梭菌1×105cfu · g-1后,与对照组相比,D-乳酸降低5.96%,但差异不显著(P>0.05),而二胺氧化酶DAO 显著降低12.36%(P<0.05),血清中D-乳酸和DAO 的活性检测结果趋势一致。因此饲粮添加丁酸梭菌后,促进了肠上皮细胞的增生,保护肠黏膜。本试验中,与对照组相比,试验组空肠ZO-1和Claudin-1的表达均有提高趋势,且Occludin 的表达显著提高(P<0.05)。因而,具有增强肠道黏膜屏障的功能。
空肠、回肠和盲肠中大肠杆菌的数量均有下降趋势,分别降低3.41%、6.38%和4.58%。与对照组相比,十二指肠、空肠和回肠的绒毛高度分别提高了2.86%、13.23%和8.93%,但十二指肠和回肠的绒毛高度与对照组相比,差异不显著(P>0.05)。与对照组相比,十二指肠、空肠和回肠的隐窝深度均差异不显著,分别降低4.95%、8.99%和13.69%。空肠和回肠的绒毛高度∕隐窝深度显著提高;与对照组相比,血清中DAO含量显著降低,D-乳酸含量降低5.96%。与对照组相比,空肠紧密连接ZO-1和Claudin-1的表达分别提高5%和12%,Occludin的表达显著提高。
5 结 论
本研究结果表明,丁酸梭菌对条件性致病菌大肠杆菌等病原菌拥有较强的抑制效果,在防治仔猪腹泻方面疗效显著,并且不会导致耐药菌株的出现。丁酸梭菌制剂作为饲料添加剂不仅活性高、稳定性好,并且能够产生多种益生物质(丁酸、淀粉酶、维生素等),在动物肠道内颉颃或杀灭动物病原菌,促进肠道中优势菌群的生长与繁殖,进而维持和调节肠道微生态平衡,同时提高动物的免疫机能及机体的抗病力,促进动物对饲料营养成分的消化吸收和利用,改善动物生长、生产性能和健康状况,因而它可代替抗生素在畜牧业中广泛应用。

