PK-15细胞生物学特性鉴定
柴 华,刘鑫莹,李建华
(哈药集团生物疫苗有限公司,哈尔滨 150000)
猪肾上皮细胞(PK-15)来源于猪肾,源自成年猪肾细胞PK-2a,体外贴壁生长,可连续传代培养。该细胞对猪细小病毒、猪圆环病毒、猪瘟病毒等多种病毒敏感,在疫苗生产中被广泛应用[1-6]。本研究对PK-15 细胞的基本生物学特性进行研究,旨在开展PK-15 细胞及多种疫苗的研究提供理论依据。
1 材料和方法
1.1 试验材料
试验用PK-15 细胞购自中国兽医药品检查所,DMEM 购自美国gibco,新生牛血清购自美国CLARK,0.25%胰蛋白酶购自美国gibco,秋水仙素购自美国sigma。试验仪器为CO2培养箱(美国ThermoFisher,参数设置为37 ℃,5% CO2),相差倒置显微镜(日本OLYMPUS)。
1.2 试验方法
1.2.1 细胞复苏
自液氮罐取出一支冻存PK-15细胞,于37 ℃水浴锅中解冻,离心后弃掉上清,用培养基重悬后接种至细胞瓶中,置于培养箱培养,逐日观察细胞生长状态,待细胞生达到90%汇合度时进行消化传代。
1.2.2 细胞传代
从培养箱中取出细胞,加入0.25%的胰酶消化液,将方瓶置于37 ℃培养箱中,待观察到个体清晰、细胞之间界限分明时,摇晃细胞从瓶壁上脱落时,培养基终止膜酶消化作用,吹打至形成单细胞悬液,按密度进行传代培养。
1.2.3 鉴定
细胞形态:用倒置显微镜进行观察。生长曲线:将PK-15 细胞按密度为4.0×105cells ·mL-1接种至T25细胞瓶中,每隔24 h进行细胞计数,绘制细胞增殖曲线。无菌检验:按现行《中国兽药典》附录进行检验。支原体检验:按现行《中国兽药典》附录进行检验。外源病毒检测:取待检细胞,反复冻融3 次,接种Vero 细胞、MDBK 细胞和ST细胞。细胞单层样品经甲醇定后,用适宜的荧光抗体进行染色,检查每一组细胞单层是否存在牛病毒性腹泻病毒、猪细小病毒和猪瘟病毒外源病毒的荧光。当阳性对照出现特异荧光,正常细胞无荧光时,如果被检样品出现外源性病毒特异性荧光,判为存在相应病毒污染而样品不合格。胞核学检查:取PK-15细胞,加入含0.1µg·mL-1秋水仙素的培养液作用2~4 h,离心弃去培养液。用Eargle's等渗盐水清洗,离心弃去液体,加入含1%酚红的低渗液(1 L水加入1 mol·L-1NaHCO34滴),37 ℃作用30 min。加入醋酸∕甲醛固定液,与细胞反应25 min。在加热板上加热至60 ℃,滴加1 mol·L-1盐酸作用10 min。用姬姆萨染色液染色后油镜下观察,取50个处于有丝分裂中期的细胞进行检查,对染色体计数,观察染色体组型。细胞致瘤性检验:用裸鼠20 只,随机分成3 组。第1 组10 只裸鼠,各皮下接种107个PK-15 细胞;第2 组5 只裸鼠,各经皮下接种107个人宫颈癌细胞(HeLa)作为阳性对照;第3组5只裸鼠,各经皮下接种107个人胚肺成纤维细胞(MRC-5)作为阴性对照。接种后逐日观察有无结节或肿瘤形成,21 d剖检第1组裸鼠5只;剩余5只裸鼠,继续观察,12周后全部剖检。阳性和阴性对照组观察21 d 全部剖检,剖检后观察淋巴结和器官有无结节形成。
2 试验结果
2.1 细胞形态
PK-15 细胞置显微镜下观察如图1,细胞为不规则多边形,轮廓清晰,细胞形态较好。
2.2 生长曲线
PK-15 细胞生长曲线成S 型,如图2,细胞生长经历了潜伏期、增殖期和停滞期。其中,细胞在48~120 h 增殖较快,细胞培养72 h 细胞密度约为43.0×105cells·mL-1。
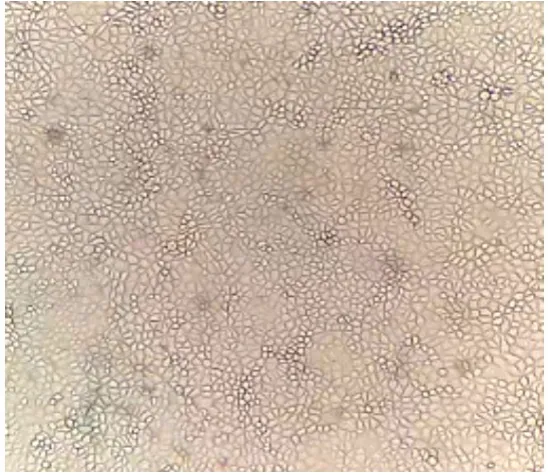
图1 PK-15细胞
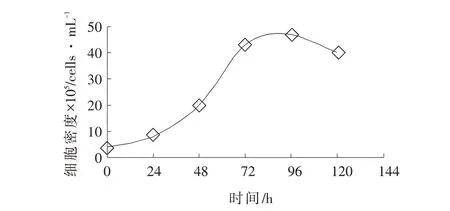
图2 细胞增殖曲线
2.3 无菌检验结果
按现行《中国兽药典》附录进行检验,PK-15细胞检验结果为阴性。
2.4 支原体检验结果
按现行《中国兽药典》附录进行检验,PK-15细胞检验结果为支原体阴性。
2.5 外源病毒检测结果
按现行《中国兽药典》附录进行PK-15 细胞检测,荧光抗体检测结果为阴性,结果如图3~5。
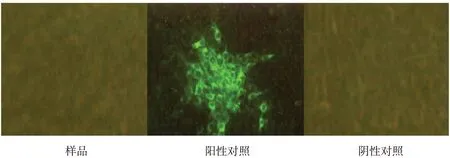
图3 BVDV荧光抗体检测结果
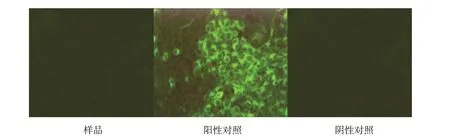
图4 CSFV荧光抗体检测结果
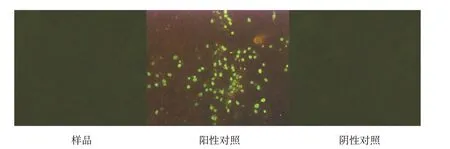
图5 PPV荧光抗体检测结果
2.6 细胞致瘤性检验
将PK-15 细胞颈部皮下接种裸鼠,21 d 及12周剖检裸鼠,裸鼠各个淋巴结和器官均无结节形成,阳性对照组出现明显肿瘤,阴性对照组裸鼠均无结节形成,PK-15细胞无致瘤性。
2.7 胞核学检查
细胞染色体标本经姬姆萨染色,对有丝分裂中期的细胞进行检查,染色体数为19×2,染色体形态见图6。
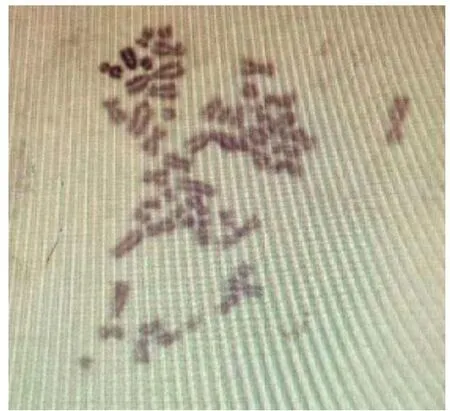
图6 PK-15细胞染色体
3 结 论
本研究对PK-15 细胞进行生长动力学鉴定、无菌检验、支原体检验、核型分析及致瘤性检验,结果表明,PK-15细胞为纯净细胞株。PK-15细胞培养过程中能保持相对稳定的遗传特性,为疫苗的生产打下了基础。同时,猪圆环病毒、猪细小病毒等病毒能够在PK-15 细胞系中稳定、高效价的增殖,为猪细圆环病毒疫苗及猪细小病毒灭活疫苗的研究及开发提供基础理论依据。

