甲状旁腺激素对老年大鼠种植体骨结合的影响及机制研究
许东亮,彭朝晖
种植牙是修复各种牙齿缺失的主要手段之一,种植体的功能行使主要靠种植体初期的机械嵌合和种植远期的骨结合[1],种植体骨结合的成功与否受种植体材料、种植部位、种植手术、种植体外形设计等因素影响,颌骨以及全身的骨代谢状况在种植体骨结合中也发挥重要作用[2-3]。骨密度和骨质量对种植体的成功具有重要意义,而年龄可影响骨密度和骨质量,随着年龄增加,老年人群的骨密度和骨质量均低于青中年人群,因此年龄也是影响种植体骨结合的因素之一[4-5]。甲状旁腺激素在骨组织代谢过程中具有促进骨吸收和骨形成双重作用,甲状旁腺激素可促进骨质疏松患者种植体骨结合的形成[6-7]。由于老年人群骨密度降低,甲状旁腺激素是否可促进老年人群种植体骨结合及其机制尚需进一步研究。本研究对老年大鼠给予甲状旁腺激素处理,观察甲状旁腺激素对种植体骨结合及碱性磷酸酶(ALP)、骨桥蛋白(OPN)、骨钙素(OCN)、白细胞介素-6(IL-6)水平的影响,探讨其可能作用机制,为临床提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 清洁级健康雄性SD 大鼠48只,22月龄,体质量530~560 g;清洁级健康雄性SD大鼠24只,12月龄,体质量520~550 g,购自上海斯莱克动物公司,动物许可证号:SCXK(沪)2007-0005。所有动物在通风良好、湿度45%~50%、温度24 ℃左右的环境下饲养。主要试剂和仪器:甲状旁腺激素(中国上海吉尔生化有限公司,100 μg/支,批号:S110819-04),甲苯胺蓝、多聚甲醛等(美国Sigma公司),骨组织RNA提取试剂盒、反转录试剂盒、聚合酶链反应(PCR)试剂盒、荧光定量PCR 试剂盒(日本Toyobo 公司),ALP、OPN、OCN、IL-6 PCR 引物序列由生工生物工程(上海)有限公司设计,种植钛钉(韩国DIO protem implant system 公司,长6 mm,直径2.5 mm),XR-36型双能X线骨密度测量仪(美国Norland公司)。
1.2 方法
1.2.1 大鼠分组 将48只22月龄老年大鼠根据随机数字表法分为老年组和甲状旁腺激素组,每组24只,将24只12月龄成年大鼠作为对照组。
1.2.2 3组大鼠种植术前骨密度测定 将3组大鼠适应性饲养1周后,采用双能X 线骨密度测量仪测量上颌骨和胫骨骨密度。
1.2.3 种植体植入及甲状旁腺激素给药 3组大鼠测定骨密度后植入种植体,戊巴比妥钠腹腔麻醉大鼠,在大鼠左侧胫骨近中干骺段做长约3 cm 纵行切口,切开皮肤以及软组织,在暴露骨面处用牙科电钻制备种植窝,种植窝直径2.5 mm,穿透对侧骨皮质,将种植钉旋转入种植窝,逐层缝合皮肤,术后青霉素肌内注射预防感染;甲状旁腺激素组大鼠腹腔注射甲状旁腺激素(20 μg/kg),隔天注射1 次[8];对照组和老年组大鼠腹腔注射等量生理盐水,隔天1次,共8周。
1.2.4 标本制作 3组大鼠用药结束后,每组取12只大鼠用多聚甲醛心脏灌注固定处死,将大鼠用戊巴比妥钠腹腔注射麻醉,麻醉后仰卧位固定到动物手术台上,剪开胸部皮肤、肌肉和胸骨,暴露心脏,剪开心包膜,暴露左心室,将灌注针头刺入左心室,剪开右心耳,用注射器推注生理盐水200~300 mL 至右心耳排出清亮液体,然后灌注多聚甲醛对组织进行固定。当大鼠抽动停止、僵硬后分离带种植体胫骨用多聚甲醛固定,分离健侧胫骨和上颌骨用乙醇固定,用于骨密度测定和制作骨组织磨片。每组取剩余12只大鼠麻醉处死,取种植体周围骨组织用于测定ALP、OPN、OCN、IL-6 mRNA水平。
1.2.5 种植术后8周骨密度测定 将分离的健侧胫骨和上颌骨用双能X线骨密度测量仪测量骨密度。
1.2.6 带种植体的骨组织磨片制作 将带种植体的胫骨标本修剪成10 mm长的组织块,乙醇脱水、二甲苯透明,树脂包埋,采用硬组织切磨机制备带种植体的骨组织磨片。
1.2.7 亚甲基蓝-品红染色 将上述制备的骨组织磨片加入亚甲基蓝染液水浴(60 ℃)染色1 min,蒸馏水漂洗,加入碱性品红染液染色5 min,干燥载片,中性树胶封片,显微镜10×2倍下观察亚甲基蓝-品红染色情况。红染为骨小梁,蓝染为纤维组织。
1.2.8 骨形态计量学参数测量 将带种植体的组织磨片放置到光镜下,采用微机彩色图像分析系统和微机彩色病理图像采集系统对骨组织形态计量学参数进行处理,测量参数包括:种植体骨结合率(BIC)、种植体周围松质骨区骨量(TA)、骨皮质厚度(TCB)、骨小梁平均宽度(TW)、结合骨板宽度(CBLW),BIC=种植体与新生骨接触部分面积/种植体总表面积×100%;TA=松质骨区种植体周围骨小梁面积/松质骨区总面积×100%;TCB为原有皮质骨厚度的平均值;TW为松质骨区骨小梁直径的平均值;CBLW为种植体和骨界面形成结合骨板厚度的平均值。
1.2.9 种植体周围骨组织中ALP、OPN、OCN、IL-6 mRNA 水平测定 取种植体周围骨组织100 mg,采用骨组织RNA 提取试剂盒提取种植体周围骨组织总RNA,反转录试剂盒进行反转录。PCR引物序列见表1。采用荧光定量PCR试剂盒进行qPCR,以GAPDH 为内参照,检测种植体周围骨组织中ALP、OPN、OCN、IL-6 mRNA 水平,以 2-ΔΔCt表示 ALP、OPN、OCN、IL-6 mRNA水平。
1.3 统计学方法 采用SPSS 20.0 软件分析,计数资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,并进行方差齐性检验,组内多重比较采用LSD-t检验,P<0.05为差异有统计学意义。

Tab.1 Primer sequence of PCR表1 PCR引物序列
2 结果
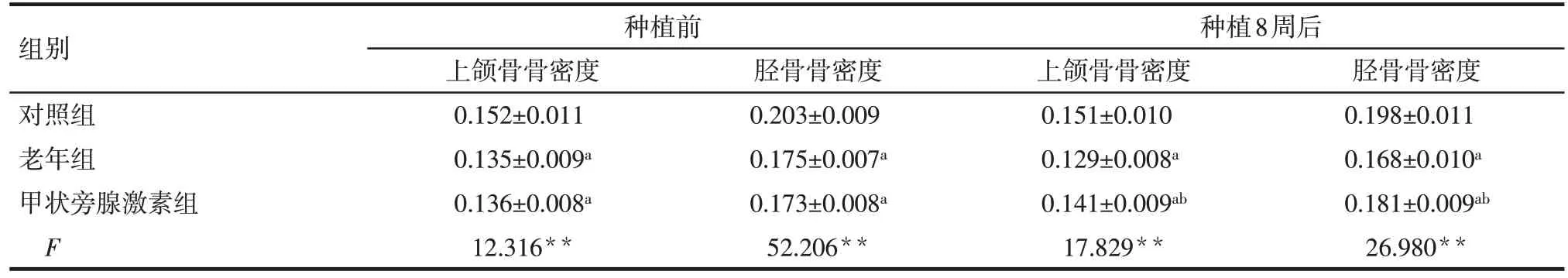
2.1 3 组大鼠种植前后骨密度比较 种植术前,与对照组比较,老年组和甲状旁腺激素组大鼠上颌骨和胫骨骨密度均降低(P<0.05);老年组和甲状旁腺激素组大鼠上颌骨和胫骨骨密度比较差异无统计学意义。种植术后8周,与对照组比较,老年组和甲状旁腺激素组大鼠上颌骨和胫骨骨密度均降低(P<0.05);与老年组比较,甲状旁腺激素组大鼠上颌骨和胫骨骨密度升高(P<0.05)。见表2。
2.2 种植术后8 周3 组大鼠植骨区亚甲基蓝-品红染色比较 种植术后8 周时,对照组大鼠植骨区可见大量成熟的哈弗系统和成熟的板状骨,结合骨板厚度增加,骨小梁密集;老年组大鼠植骨区见较多编织骨,可见成熟的板层骨,成熟的哈弗系统少,结合骨板薄,骨小梁稀疏;甲状旁腺激素组大鼠植骨区染色情况介于对照组和老年组之间,见较多哈弗系统和成熟板层骨,编织骨比较少,结合骨板厚度较厚,骨小梁较密集,见图1。
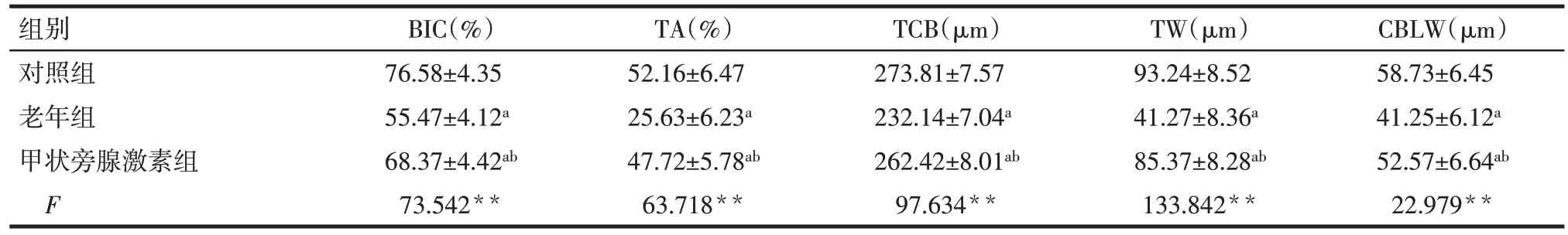
2.3 种植术后8周3组大鼠骨计量学指标比较 种植术后8周,与对照组比较,老年组和甲状旁腺激素组大鼠 BIC、TA、TCB、TW、CBLW 值均降低(P<0.05);与老年组比较,甲状旁腺激素组大鼠BIC、TA、TCB、TW、CBLW值均升高(P<0.05)。见表3。
Tab.2 Comparison of bone mineral densities before and after implantation between three groups of rats表2 3组大鼠种植前后骨密度比较 (n=12,g/cm2,±s)
Tab.2 Comparison of bone mineral densities before and after implantation between three groups of rats表2 3组大鼠种植前后骨密度比较 (n=12,g/cm2,±s)
**P<0.01;a与对照组比较,b与老年组比较,P<0.05;表2、3同
组别对照组老年组甲状旁腺激素组F种植前上颌骨骨密度0.152±0.011 0.135±0.009a 0.136±0.008a 12.316**胫骨骨密度0.203±0.009 0.175±0.007a 0.173±0.008a 52.206**种植8周后上颌骨骨密度0.151±0.010 0.129±0.008a 0.141±0.009ab 17.829**胫骨骨密度0.198±0.011 0.168±0.010a 0.181±0.009ab 26.980**
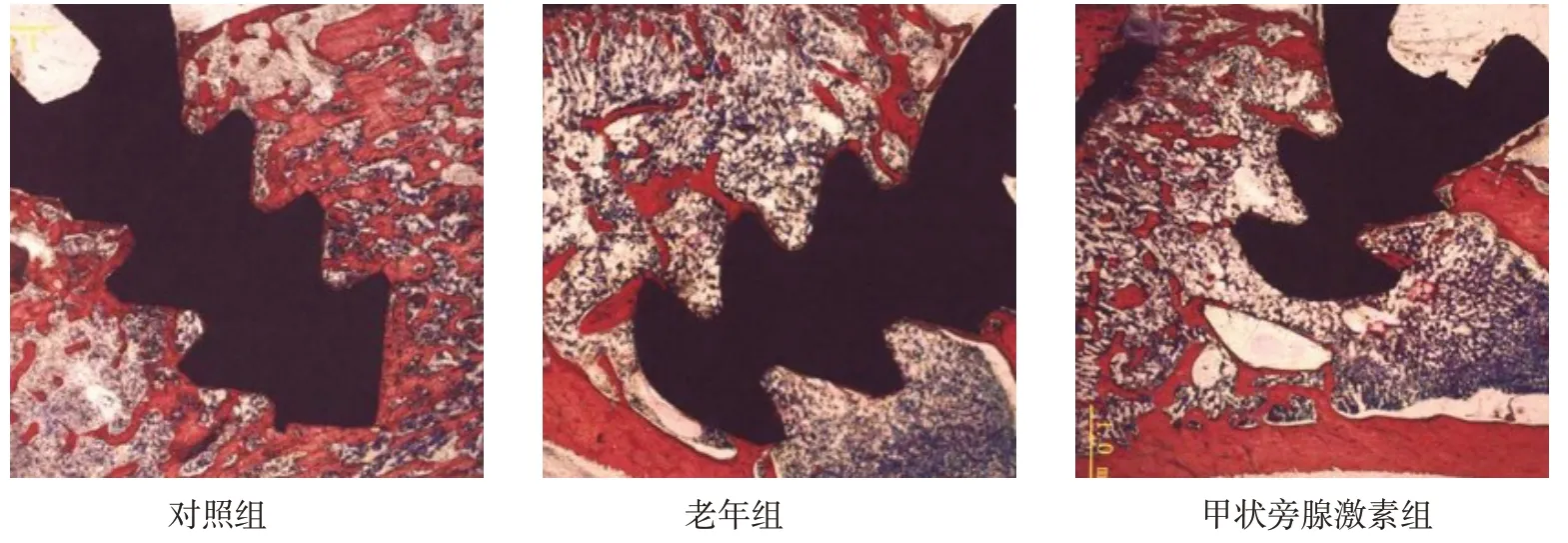
Fig.1 Toluidine blue staining of the bone grafting area 8 weeks after implantation in the three groups of rats(×20)图1 种植术后8周3组大鼠植骨区亚甲基蓝-品红染色(×20)
Tab.3 Comparison of bone metrology indexes at 8 weeks after implantation between three groups of rats表3 种植术后8周3组大鼠骨计量学指标比较 (n=12,±s)
Tab.3 Comparison of bone metrology indexes at 8 weeks after implantation between three groups of rats表3 种植术后8周3组大鼠骨计量学指标比较 (n=12,±s)
组别对照组老年组甲状旁腺激素组F BIC(%)76.58±4.35 55.47±4.12a 68.37±4.42ab 73.542**TA(%)52.16±6.47 25.63±6.23a 47.72±5.78ab 63.718**TCB(μm)273.81±7.57 232.14±7.04a 262.42±8.01ab 97.634**TW(μm)93.24±8.52 41.27±8.36a 85.37±8.28ab 133.842**CBLW(μm)58.73±6.45 41.25±6.12a 52.57±6.64ab 22.979**
2.4 种植术后8 周3 组大鼠种植体周围骨组织ALP、OPN、OCN、IL-6 mRNA水平比较 种植术后8周,与对照组比较,老年组和甲状旁腺激素组大鼠种植体周围骨组织ALP、OPN、OCN mRNA 水平均降低,IL-6 mRNA水平升高(P<0.05);与老年组比较,甲状旁腺激素组大鼠种植体周围骨组织ALP、OPN、OCN mRNA 水平均升高,IL-6 mRNA 水平降低(P<0.05)。见表4。
Tab.4 Comparison of ALP,OPN,OCN and IL-6 mRNA levels in the bone tissues at 8 weeks after implantation between the three groups of rats表4 种植术后8周3组大鼠种植体周围骨组织ALP、OPN、OCN、IL-6 mRNA水平比较 (n=12,±s)

Tab.4 Comparison of ALP,OPN,OCN and IL-6 mRNA levels in the bone tissues at 8 weeks after implantation between the three groups of rats表4 种植术后8周3组大鼠种植体周围骨组织ALP、OPN、OCN、IL-6 mRNA水平比较 (n=12,±s)
组别对照组老年组甲状旁腺激素组F ALP mRNA 1.00±0.03 0.34±0.05a 0.77±0.08ab 412.286**OPN mRNA 1.00±0.02 0.30±0.04a 0.59±0.06ab 795.214**OCN mRNA 1.00±0.02 0.45±0.05a 0.75±0.06ab 420.000**IL-6 mRNA 1.00±0.04 2.18±0.11a 1.71±0.12ab 452.114**
3 讨论
种植体行使功能的基础是种植体的骨结合,种植体成功与骨结合除了受种植体材料、外形、种植部位等因素影响外,也受颌骨和全身骨代谢状况的影响;为了提高种植成功率,种植体的设计进行了各种优化,种植体的优化设计改善了种植体的骨结合能力和种植体的生物力学性能[9],而对于颌骨骨量和骨质不良等患者自身因素对种植体带来的不良影响仍在探索中。
骨密度和骨质量对颌骨种植体成功具有非常重要的作用,种植体植入颌骨皮质骨变薄、疏松多孔时,或植入骨小梁骨量减少的解剖部位时,种植手术失败的风险显著增高[10];种植体植入部位骨量和种植失败关系密切,骨密度越低、骨质量越差,骨整合越不好,种植体成功率越低[11-12]。颌骨骨量和骨质缺陷可减弱种植初期骨组织本身对种植体的支持,降低种植体初期的稳定性,延长种植体的骨愈合时间,对种植体的远期骨结合造成不利影响,严重者可导致种植体松动、脱落,甚至种植失败等[13-14]。
随着人口的老龄化,老年牙列缺失人群增加,越来越多的老年患者选择种植修复[15]。在人的一生中,骨组织一直处于不断新陈代谢过程中,对于老年患者,人体的衰老过程影响骨代谢,骨密度、成骨细胞、骨基质、骨矿物质含量等都发生退行性变化[16]。骨代谢的两个基本过程为骨吸收和骨形成,骨吸收相对增强和骨形成的相对减弱可导致骨质疏松的发生,骨代谢指标有骨形成指标和骨吸收指标,两者反映整体骨转换情况,骨转换情况受年龄影响,随着年龄增加,骨转换减慢,骨量丢失[17-18]。本研究显示,与成年大鼠比较,老年大鼠上颌骨和胫骨骨密度明显降低;植骨区见较多编织骨,成熟的哈弗系统少,结合骨板薄,骨小梁稀疏,破骨细胞和成骨细胞多;BIC、TA、TCB、TW、CBLW 值降低,表明老年大鼠存在骨量丢失、骨密度下降,从而影响种植体骨结合的形成。
甲状旁腺激素具有调节钙磷代谢的重要作用,在骨质疏松的治疗中被广泛应用,在骨组织代谢过程中具有促进骨吸收和骨形成双重作用,且研究发现甲状旁腺激素对种植体骨结合具有促进作用[19]。在过高的甲状旁腺激素浓度作用下,破骨细胞活性大于成骨细胞活性,导致骨丢失大于骨形成,造成骨分解;但间歇性、低剂量甲状旁腺激素可促进处于增殖期的成骨细胞和前成骨基质细胞聚集,增加活化成骨细胞数量,从而促进骨形成[20]。ALP、OPN、OCN均为成骨标志基因:ALP为早期成骨标志,可促进细胞的成熟和钙化,ALP 水平可反映成骨细胞分化水平;OCN为成骨细胞分泌蛋白,是骨组织特异性蛋白,可反映成骨细胞功能[21]。IL-6可刺激破骨细胞增殖和破骨细胞功能表达,抑制成骨细胞功能,是破骨细胞的主要调节因子[7]。研究发现甲状旁腺激素可促进成骨相关基因OCN 和ALP 的表达发挥促进口腔种植体表面促成骨作用[22]。甲状旁腺激素在骨质疏松中发挥重要作用,如陈煜东等[23]研究发现甲状旁腺激素可升高骨质疏松性椎体压缩骨折患者的25-羟维生素D 水平,降低Ⅰ型胶原羧基前肽和Ⅰ型前胶原氨基端前肽水平,提高骨密度,通过改善骨代谢、提高骨密度增加患者的康复效果;张泽华等[24]研究发现甲状旁腺激素联合骨髓间充质干细胞可通过改善骨密度代谢指标提高骨质疏松的治疗效果。也有研究表明甲状旁腺激素可促进骨质疏松大鼠种植体骨结合的形成[8],老年患者普遍存在骨密度和骨质量低的现象,甲状旁腺激素能否促进老年种植体骨结合形成尚不明确,本研究显示,甲状旁腺激素治疗可提高老年大鼠上颌骨和胫骨骨密度,升高BIC、TA、TCB、TW、CBLW 值,升高种植体周围骨组织ALP、OPN、OCN mRNA 水平,降低IL-6 mRNA水平,给予小剂量、间歇性甲状旁腺激素治疗后,可通过升高种植体周围骨组织ALP、OPN、OCN mRNA水平和降低种植体周围骨组织IL-6 mRNA 水平,促进成骨细胞功能,抑制破骨细胞增殖和功能,调节钙磷代谢作用影响骨代谢,增加老年大鼠的骨密度,改善骨结构,增加结合骨板,增加松质骨区骨量和骨小梁宽度,升高种植体骨结合率,从而有效提高种植体骨结合质量。甲状旁腺激素促进骨形成的机制可能与下列因素有关:甲状旁腺激素可通过促进成骨细胞释放多种生长因子,促进骨祖细胞增殖;通过刺激骨祖细胞分泌抗增殖素终止骨祖细胞增殖,从而促进骨祖细胞分化为前成骨细胞;通过抑制骨细胞表达硬骨素使骨衬里细胞转换为成骨细胞,加快成骨速度;抑制成骨细胞凋亡、延长成骨细胞寿命,从而促进骨形成[25]。甲状旁腺激素与骨质疏松关系密切,甲状旁腺激素可通过提高骨密度、改善骨代谢指标改善骨质疏松相关疾病的治疗效果,老年患者往往存在骨质疏松,从而影响骨形成,不利于种植体骨结合,给予甲状旁腺激素治疗后可通过改善患者骨质疏松状态、提高骨密度、改善骨代谢指标,从而促进老年种植体骨结合质量。
综上所述,老龄骨密度下降,影响种植体骨结合质量,给予小剂量、间歇性甲状旁腺激素治疗可通过提高种植体周围骨组织成骨标志水平、降低破骨因子水平从而提高老年种植体骨结合质量。

