血清神经元特异性烯醇化酶与胃泌素释放肽前体水平评估小细胞肺癌疗效及预后的效果研究
夏国庆,韩一平
全球范围内,肺癌是位居肿瘤中死亡人数最高的疾病,而小细胞肺癌(small cell lung carcinoma,SCLC)占肺癌的15%~20%[1]。SCLC是一种增长迅速、早期转移的恶性肿瘤。尽管SCLC患者初始对放化疗治疗敏感性较高,但大部分患者在治疗后的6个月内会出现进展或复发[2]。目前对于SCLC的主要治疗方案是以铂类为基础联合其他药物的化疗方案及同步或序贯放疗。如何准确评估患者疗效目前尚无明确的标准,有研究显示血清中肿瘤标志物相对于实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)使用影像学数据来评估肿瘤疗效及预后更为简便和经济[3]。在SCLC研究中,神经元特异性烯醇化酶(neuron specific enolase,NSE)常用于SCLC的诊断和疗效监测[4]。近来胃泌素释放肽前体(pro-gastrin releasing peptide,Pro-GRP)亦被认为是SCLC诊断、疗效监测、预后的良好标志物[5]。本研究就化疗前后SCLC患者血清NSE、Pro-GRP水平与化疗后的疗效进行分析以评估其临床意义,为SCLC化疗的效果评估提供标志物。
本研究意义:
本研究着重于肿瘤标志物对于肿瘤患者治疗过程中的作用,选取小细胞肺癌(SCLC)中肿瘤指标神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(Pro-GRP)进行分析。通过对化疗前后NSE、Pro-GRP水平与SCLC疗效及预后的分析,有助于对临床中更为方便、简洁地获取SCLC患者疗效及预后的结果提供了一种思路,以望未来进一步为临床工作带来帮助。
1 对象与方法
1.1 研究对象 选取2015年7月—2016年7月上海长海医院呼吸内科收治并经纤维支气管镜肺活检、纤维支气管针吸活检或CT引导下细针穿刺术等方式病理证实为SCLC患者103例。患者既往未行手术或放化疗治疗,在本院行4~6周期的初始化疗治疗。化疗方案为依托铂苷+卡铂/顺铂。排除标准:已接受过药物、放疗治疗;初始评估不能耐受化疗方案。
1.2 方法 患者化疗前及化疗后空腹采集静脉血标本2 ml检测肿瘤标志物。血清NSE、Pro-GRP水平分别采用电化学发光免疫分析法(ECLIA)和化学发光微粒子免疫检测技术(CMIA)测得。所有患者在首次住院时行全面评估,包括胸部增强CT、骨核素扫描或正电子发射断层显像(PET)、颅脑增强磁共振成像(MRI),后依据VLAG分期评定肿瘤分期[6]:局限期(limited disease,LD)定义为病变限于一侧胸腔,包括纵隔淋巴结、锁骨上淋巴结;广泛期(extend disease,ED)为病变超过一侧胸腔,且包括恶性胸腔积液。每2个化疗周期通过胸部CT评估患者病情变化,疗效以RECIST标准进行评估[3],包括完全缓解(CR)、部分缓解(PR)、病情稳定(SD)、病情进展(PD)。
1.3 随访 通过电话、门诊等方式进行随访。随访间隔时间为3个月,末次随访时间为2017-07-31,终点事件为死亡或截至随访时间。记录患者无疾病进展期(progress free survival,PFS),定义为患者初次诊断时间至化疗期间出现PD的时间或在治疗期间未出现PD的最后一次随访时间。
1.4 统计学方法 采用SPSS 21.0软件进行统计学分析,符合正态分布的计量资料以(x ±s)表示;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料的分析采用χ2检验;相关性分析采用Spearman相关;单因素分析采用Kaplan-Meier方法和Log-rank检验;采用多因素Cox风险比例回归模型分析SCLC患者预后的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 103例患者中男88例(85.4%),女15例(14.6%);年龄41~86岁,平均年龄(60.5±8.8)岁,〈65岁77例(74.8%),≥65岁26例(25.2%);吸烟指数〈400支年30例(29.1%),≥400支年73例(70.9%);美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)活动状态(performance status,PS)评分〈1分22例(21.4%),≥1分81例(78.6%);肿瘤分期:LD 37例(35.9%),ED 66例(64.1%);肿瘤转移:无52例(50.5%),有51例(49.5%)。化疗周期结束后CR 7例(6.8%),PR 18例(17.5%),SD 53例(51.4%),PD 25例(24.3%)。
2.2 不同疗效患者化疗前后NSE、Pro-GRP水平CR+PR患者化疗前与化疗后NSE、Pro-GRP水平比较,差异均有统计学意义(P<0.05);SD患者化疗前与化疗后NSE、Pro-GRP水平比较,差异均有统计学意义(P<0.05);PD患者化疗前与化疗后NSE、Pro-GRP水平比较,差异均无统计学意义(P>0.05)。
CR+PR、SD、PD患者化疗前NSE、Pro-GRP水平比较,差异均无统计学意义(P>0.05);CR+PR、SD、PD患者化疗后NSE、Pro-GRP水平比较,差异均有统计学意义(P<0.05,见表1)。
2.3 SCLC患者化疗前、后NSE、Pro-GRP水平与疗效的相关性 经秩相关检验,化疗前NSE、Pro-GRP水平与疗效无相关关系(rs=0.019,P=0.845;rs=0.171,P=0.086)。化疗后NSE、Pro-GRP水平与疗效存在相关关系(rs=0.342,P<0.001;rs=0.350,P<0.001)。
2.4 化疗后不同NSE、Pro-GRP水平者疗效分布 103例患者化疗周期结束后,NSE〈参考范围上限(ULN)者69例,≥ULN者34例;Pro-GRP<ULN者51例,≥ULN者52例。NSE〈ULN与NSE≥ULN者疗效分布比较,差异有统计学意义(P<0.05);Pro-GRP<ULN与Pro-GRP≥ULN者疗效分布比较,差异无统计学意义(P>0.05,见表2)。
2.5 不同临床特征的SCLC患者PFS比较 不同性别、年龄、吸烟指数、ECOG PS评分、化疗前NSE水平、化疗前Pro-GRP水平者PFS比较,差异均无统计学意义(P>0.05);不同肿瘤分期、有无肿瘤转移、化疗后NSE水平、化疗后Pro-GRP水平者PFS比较,差异均有统计学意义(P<0.05,见表3)。
2.6 多因素Cox风险比例回归分析 以患者预后为因变量(赋值:生存=0,死亡=1),以性别(赋值:男=1,女=2)、年龄(连续变量)、吸烟指数(赋值:〈400支年=1,≥400支年=2)、ECOG PS评分(赋值:〈1分=1,≥1分=2)、肿瘤分期(赋值:LD=1,ED=2)、肿瘤转移(赋值:有=1,无=2)、化疗前NSE(赋值:〈ULN=1,≥ULN=2)、化疗前Pro-GRP(赋值:〈ULN=1,≥ULN=2)、化疗后NSE(赋值:〈ULN=1,≥ULN=2)、化疗后Pro-GRP(赋值:〈ULN=1,≥ULN=2)为自变量进行多因素Cox风险比例回归分析,结果显示,肿瘤分期、化疗后NSE水平是SCLC患者预后的影响因素(P<0.05,见表4)。
3 讨论
通过非侵入性手段从血液中收集的肿瘤标志物可作为肿瘤分泌或人体对肿瘤存在的反应性分泌物质。同时肿瘤标志物对肿瘤的诊断、疗效监测、预后评估具有一定帮助。尽管肿瘤标志物不用于无症状肺癌的检测,在SCLC研究中肿瘤标志物对患者的诊断、预后、疗效的监测和疾病复发的早期发现提供了重要帮助[7]。肿瘤标志物水平常能反映SCLC患者肿瘤负荷情况,提供有关对化疗效果和生存时间的有效信息[8]。NSE被认为是各种神经系统和神经内分泌组织癌症的一种标志物,例如恶性黑素瘤、精原细胞瘤、肾癌、类癌、生殖细胞瘤、未成熟畸胎瘤、甲状腺髓样癌和SCLC[9]。长期以来NSE被认为是诊断SCLC的重要标志物。20世纪90年代期间由MIYAKE等[10]和TAKADA等[11]第1次对Pro-GRP在肺癌患者中的有用性进行了尝试,研究结果表明,Pro-GRP在SCLC诊断中灵敏度较高,其中LD患者为67%~73%,ED患者为79%~80%,而在鳞状细胞肺癌和腺癌患者中,其诊断灵敏度较低,为3%~14%。

表2 化疗后不同NSE、Pro-GRP水平者疗效分布比较〔n(%)〕Table 2 Distributions of chemotherapy responses in SCLC patients by NSE and Pro-GRP levels
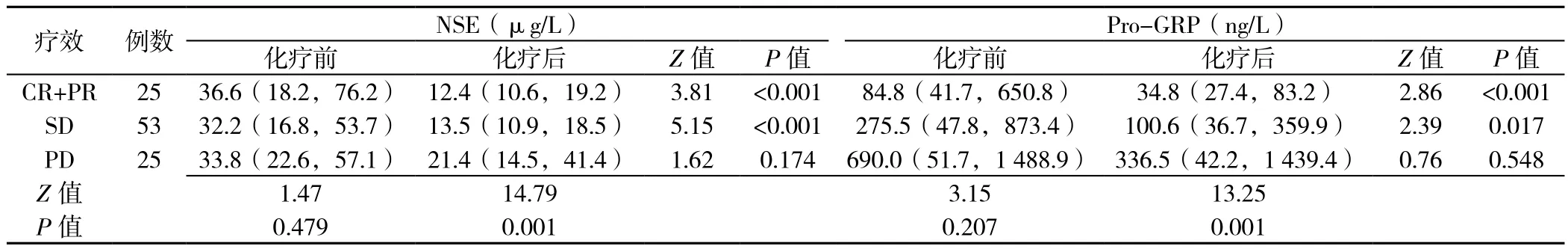
表1 不同疗效患者化疗前后NSE、Pro-GRP水平比较〔M(P25,P75)〕Table 1 Comparison of NSE and Pro-GRP levels before and after chemotherapy in SCLC patients by the level of response

表3 不同临床特征的SCLC患者PFS比较〔M(P25,P75),月〕Table 3 Comparison of PFS among SCLC patients with different clinical characteristics

表4 SCLC患者预后的影响因素的多因素Cox风险比例回归分析Table 4 Multivariate Cox's regression model survival analysis of prognostic factors in SCLC patients
在NSE对SCLC疗效的监测中,有研究提示在治疗期间监测NSE水平的变化有助于评估患者对治疗的反应,所有经过首次规范化治疗后获得CR的患者,其基线NSE水平均降到参考范围内[12-13]。同时在Pro-GRP对SCLC化疗效果的研究报道中显示,化疗后无应答患者Pro-GRP水平高于应答期患者,而化疗效果好的患者在化疗期间可以观测到明显的Pro-GRP水平下降[14]。且有关于血清Pro-GRP与影像学证据对SCLC的疗效研究显示,检测Pro-GRP水平对辨别早期治疗疗效有较好的作用[15]。本研究中化疗后CR+PR以及SD患者NSE、Pro-GRP水平较化疗前下降,而PD患者化疗前后两者水平变化无明显差异,提示化疗后NSE、Pro-GRP水平的变化与疗效可能存在一定的联系。肿瘤标志物常反映肿瘤的负荷情况,对于化疗后仍有较高Pro-GRP水平,YONEMORI等[16]认为可能提示体内仍有肿瘤残留,HUANG等[17]对SCLC的研究也提示疗效较好的SCLC患者Pro-GRP和NSE水平下降。虽然现有研究中NSE、Pro-GRP虽对SCLC有较好的敏感性和特异性[18],然而在本研究结果中各个疗效组间化疗前NSE、Pro-GRP水平无差异。同时现有研究并不支持将单一肿瘤标志物水平的高低作为肿瘤分期的标准[19],并且患者在入组时所处状态不一、肿瘤的异质性及生物标志物检测方法的不一等均可能是本研究中化疗前肿瘤标志物与疗效无统计学差异的原因。本研究还发现,化疗后的NSE、Pro-GRP水平与患者的疗效存在一定相关性,提示化疗后NSE、Pro-GRP水平是反映化疗效果的良好指标。
本研究单因素分析研究了临床上各种因子与SCLC生存时间PFS的关系,包括:性别、年龄、ECOG PS评分、肿瘤分期、有无肿瘤转移及肿瘤标志物水平,仅有肿瘤分期、有无肿瘤转移、化疗后肿瘤标记物水平组中存在差异。在关于SCLC预后的研究中显示,肿瘤分期是一项较好的预测患者预后的因子[20]。本研究中LD和ED患者PFS分别为10.0个月和7.4个月(P<0.05),LD患者预后明显好于ED患者。很多报道反映血清肿瘤标志物对SCLC预后存在一定作用。WÓJCIK等[21]研究显示治疗前升高的NSE水平对于LD患者是一项不利的预后指标,HIROSE等[22]的报道亦反映治疗后血清NSE水平对复发的SCLC患者是一项较好的预后因素。相对于NSE而言,Pro-GRP对SCLC诊断的灵敏度较高,而对于预后的预测价值仍存在争议。SHIBAYAMA等[23]研究显示,血清Pro-GRP诊断SCLC的灵敏度高于NSE(64.9%与43.0%,P<0.001),但NSE较Pro-GRP对总生存期有更大的影响作用。同时亦有研究显示Pro-GRP的过度表达会导致SCLC肿瘤细胞的生长和增殖,高水平的Pro-GRP可能是预后的不良因素[24]。对于Pro-GRP水平对SCLC预后的影响需要进一步大规模的研究验证。本研究单因素分析中化疗前标志物水平高低与预后无统计学差异,可能与化疗前的肿瘤标志物水平在疗效间无明显差异有关。多因素生存分析显示仅化疗后NSE水平与PFS相关,FIZAZI等[13]研究在多变量分析中证实SCLC患者接受1周期化疗后血清NSE水平是其独立的危险因素。在该研究中当1周期化疗后NSE≤12.5 μg/L时,SCLC患者中位生存时间和2年生存率为15.3个月、21%;而当NSE〉12.5 μg/L时其分别为8.1个月、15%。化疗后Pro-GRP水平与预后无统计学关联,提示在SCLC预后方面NSE是更好的预示因素。
本研究同样存在几处不足之处:本研究为回顾性单中心研究,样本量较小;对于NSE、Pro-GRP参考范围上限的选取因各研究所用试剂盒不同缺乏统一的标准。同时因为Pro-GRP水平检测上限为5 000 ng/L,有3例患者化疗前Pro-GRP水平高于检测上限故在统计过程中可能存在偏差。
综上所述,检测NSE、Pro-GRP水平对于评估SCLC患者化疗效果有着很好的监测作用,而化疗后NSE水平对SCLC预后有一定的预示作用。
作者贡献:夏国庆、韩一平进行文章的构思与设计,研究的实施与可行性分析,论文的修订;夏国庆进行数据收集及整理,统计学处理,结果的分析与解释,撰写论文;韩一平负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

