基因芯片技术对结核分枝杆菌利福平及异烟肼的耐药性检测研究
孙桂英,赵 刚,沈 燕,徐密琴,高胜利,俞 净,钮志林
(苏州市吴江区第一人民医院感染科,江苏苏州 215200)
结核病是因感染结核分枝杆菌(Mtb)而发生的并具有传染性的慢性疾病,可累及全身各种器官,最为常见是以肺部受累形成的肺结核病。根据WHO的2016年结核病年度报告显示[1],肺结核病在2015年的全球新发病例高达1 040万例,死亡病例为140万例,超过HIV;同年我国新发生肺结核病91万例,仅次于印度(238万例)与印尼(102万例)位列全球第3位,死亡病例约3.5万。当前,我国是全球22个结核病高负担国家及27个耐多药(MDR)结核病高负担国家之一[2]。自1993年WHO宣布“全球结核病紧急状态”以来,多个国家及地区陆续出现了1例或多例MDR结核病。全球有3.9%的新发病例和21%的复诊患者患有MDR结核病[1]。结核病耐药已成为全世界结核病疫情控制的巨大阻碍。建立有效且快速的Mtb耐药检测方法对临床合理用药及结核病疫情控制意义重大。长期以来,传统罗氏比例法由于操作简单、经济、方便、易于推广等因素而被广泛应用于Mtb药敏试验,并被视为结核病诊断的“金标准”。但该方法耗时较久,步骤繁琐,已很难满足当前对MDR结核病诊断及时性的需求。伴随着Mtb耐药分子机制的阐明,几种快速检测结核病耐药的分子药敏检测技术得以问世,其中基因芯片技术日益受到重视。与此同时,近年来受耐药率不断升高的影响,利福平(RFP)与异烟肼(INH)这一经典的抗结核病一线药物组合在苏州吴江地区的治疗效果有所降低。本研究采用基因芯片技术对Mtb的耐药性进行检测,并与传统罗氏比例法药敏试验结果进行对比,同时采用DNA测序验证,旨在探讨基因芯片法对苏州地区Mtb临床分离株RFP与INH耐药性快速检测的实用价值。
1 资料与方法
1.1一般资料 选择2016年5月1日至2018年12月31日在苏州市吴江区第一人民医院感染科发现的痰液标本涂片阳性的结核病患者。以无菌容器连续3 d采集所有患者的第1口晨痰2~5 mL并及时送检。
1.2试剂与仪器 晶芯®系列试剂或仪器均购自博奥生物公司,包括核酸快速提取仪(ExtractorTM 36)、芯片洗干仪(SlideWasherTM 8)、芯片杂交仪(BioMixerTM Ⅱ)、微阵列芯片扫描仪(LuxScanTM10K-B)、Mtb耐药基因检测试剂盒与菌种鉴定试剂盒;实时PCR扩增仪(美国伯乐),改良罗氏培养基(海博生物),PNB与TCH菌种鉴定培养基。
1.3方法
1.3.1罗氏培养药敏试验 严格按照《结核病诊断实验室检验规程》[3]进行试验操作。采用2倍于痰标本量的标本消化液进行样本前处理,接种至改良罗氏培养基后进行恒温(37 ℃)培养,观察到阳性培养结果后即行比例法药敏试验及菌种鉴定,阴性培养结果延长培养时间,最长不超过8周。将临床分离Mtb的初生长2周菌落研磨并配成菌悬液,浓度1 mg/mL,梯度稀释,目标浓度分别为10-2mg/mL与10-4mg/mL,分别满环沾取并接种至含RFP(40 μg/mL)与INH(0.2 μg/mL)的药敏试验培养基,同时采用PNB与TCH培养基鉴定菌种。所有样本完成以上处理后均进行恒温(37 ℃)培养,4周后观察结果。本研究以Mtb标准菌株H37RV为质控菌株。
1.3.2基因芯片检测 选择RFP耐药基因rpoB及INH耐药基因katG与inhA作为本次检测的目标基因,检测Mtb中以上基因启动子的野生型(wt)及多种突变型(mt),具体实验操作严格按照试剂盒说明书及实验室操作标准程序进行。(1)采用核酸快速提取仪进行核酸提取;(2)在提取好核酸的离心管中加入PCR扩增试剂进行PCR扩增;(3)在PCR扩增反应结束后对标本进行芯片杂交,扩增产物按说明书加杂交缓冲液加入芯片,放入56 ℃水浴箱2 h;(4)芯片杂交结束后,将芯片按照说明书所配置好的洗涤液进行洗涤,洗涤后进行干燥;(5)采用微阵列芯片扫描仪对干燥后芯片进行扫描,软件读取信号并自行判读结果。
1.3.3DNA测序验证 对经罗氏比例法检测的Mtb阳性菌株,进行3个目标基因耐药相关区域扩增产物的DNA测序,具体测序工作由博奥生物公司完成,采用第一代DNA测序技术双脱氧链终止法进行核酸测序。
1.4统计学处理 采用SPSS统计学软件进行数据分析,对配对计数资料进行交叉制表下的χ2检验分析两种检验方式是否存在差异,P<0.05为差异有统计学意义;采用Kappa检验分析两种检验方法的结果一致性,Kappa≥0.75为一致性良好。
2 结 果
2.1标本检测情况 本研究共纳入300例痰液涂片阳性肺结核患者的共计900份痰标本,排除31份(3.44%)培养阴性及7份(0.78%)培养污染标本后对862份标本进行了药敏试验与菌种鉴定。862份标本中有4份(0.46%)药敏试验失败,5份(0.58%)菌种鉴定为非结核分枝杆菌(NTM),最终有853份可用于药敏分析。900份痰标本中,基因芯片检测未检测到Mtb的有11份(1.22%),NTM9份(1.00%),结果不能判定的有17份(1.89%),最终有863份可用于药敏分析。综合药敏试验与基因芯片检测结果,最终有829份标本的检测结果可用于药敏检测结果的比较。

表1 基因芯片检测Mtb RFP和INH耐药相关突变位点情况
注:密码子改变一栏中的数字前后字母分别为wt与mt碱基
2.2基因芯片检测Mtb耐药基因相关突变位点 基因芯片检出rpoB突变型菌株109株,包括单一位点突变108株与双位点突变1株。突变频率最高的2个位点分别为531位点[56.88%(62/109)]与526位点[23.85%(26/109)]。基因芯片检出katG/inhA突变型菌株162株,包括katG315单一位点突变112株[69.14%(112/162)],inhA-15单一位点突变47株[29.01%(47/162)],katG315位点与inhA启动子区域双突变3株[1.85%(3/162)]。见表1。

表2 基因芯片与罗氏比例法检测RFP、INH及MDR的结果比较(n)
2.3基因芯片与罗氏比例法检测RFP、INH及MDR 基因芯片与罗氏比例法检测RFP耐药及MDR的效果相近(均P>0.05),对INH耐药的检测差异有统计学意义(P<0.05),见表2;以罗氏比例法为金标准,对基因芯片检测RFP、INH耐药及MDR的评估见表3。
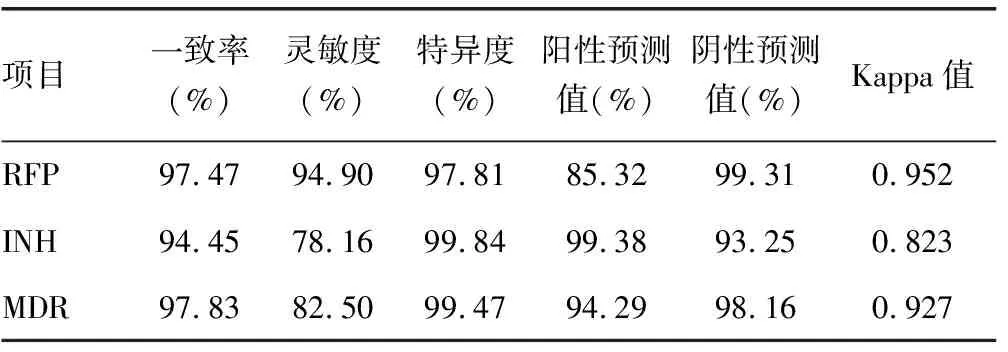
表3 基因芯片检测RFP、INH及MDR的效果评价
注:本研究中,将对RFP与INH均耐药定义为MDR
2.4基因芯片技术与DNA测序的对比 以DNA测序结果作为金标准,基因芯片检测RFP耐药结果不一致为4株,检测准确率为99.52%(825/829);检测INH耐药结果不一致为2株,检测准确率为99.76%(827/829),相关分离菌株检测结果的不一致基因位点见表4。
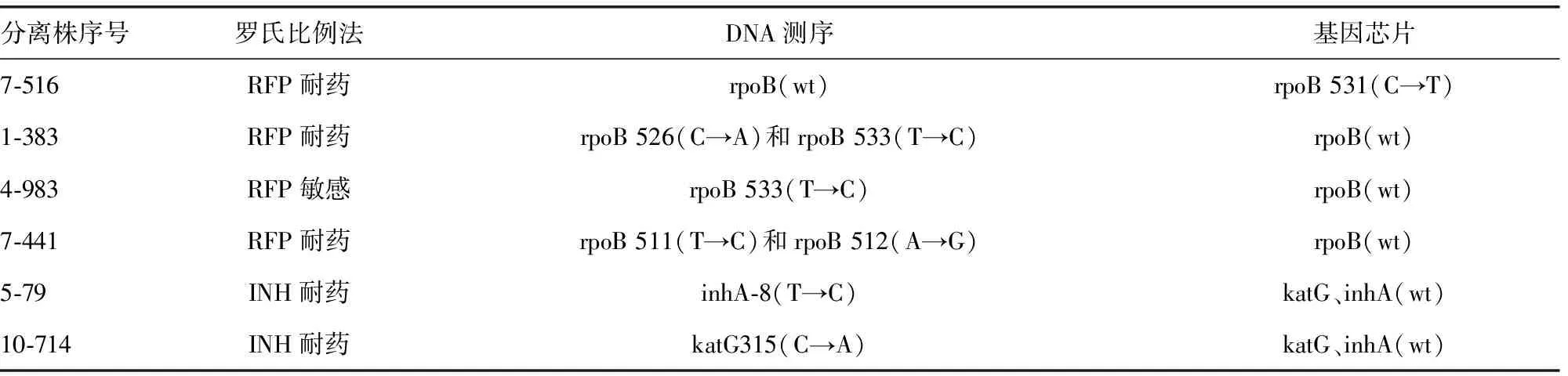
表4 基因芯片技术与DNA测序结果对比
3 讨 论
随着全程督导化学治疗策略的逐步开展,我国个别地区结核病疫情开始有所缓解,但全国总体形式严峻依旧,区域化流行趋势差别仍然存在[4]。鉴于本院所属苏州吴江地区的RFP与INH耐药结核病病例逐年增多的趋势明显,寻求一种及时、准确的耐药性检测方法对有效控制本地区耐多药结核病的流行与传播具有重要的现实意义。与传统方法相比,生物芯片技术具有快速、结果可靠、重复性好、通量高、可以在一个反应中检测成千基因表达的特点,为Mtb的实验室诊断开拓了新的途径,更满足了当前临床快速检测之需求[5]。
研究表明[6-7],95%以上的RFP耐药与rpoB基因变异有关。本研究选择了几种rpoB基因常见突变位点(511、513、516、526、531、533位点),考察与苏州吴江地区RFP耐药的相关性。基因芯片检测结果表明,本地区RFP耐药基因rpoB的突变类型包括511(T→C)、513(A→C或C→A)、516(G→T或A→G或A→T)、526(A→G或A→T或C→G或C→T)、531(C→T或C→G)、533(T→C)等单位点突变以及511与516的双位点突变,其中的531(C→T或C→G)与526(A→G或A→T或C→G或C→T)为主要突变类型,突变率分别为56.88%与23.85%。KatG基因315位点突变与inhA基因-15位点突变不仅普遍存在于耐药Mtb中,同时也与INH耐药高度相关。基因芯片检测结果表明,本地区INH耐药基因的主要突变类型为KatG315(G→A或G→C),突变率达69.14%,与吉林省(68.55%)[8]相似,但与青岛(44.83%)[9]及青海(75.5%)[10]等地区明显不同,提示KatG315突变存在一定地域差异。后经DNA测序验证,基因芯片检测RFP与INH耐药相关基因突变位点不一致分别为4株与2株,检测准确率分别为99.52%与99.76%。表明本次采用基因芯片检测Mtb RFP和INH耐药相关突变位点的结果是可靠的,总体提示rpoB531、526位点突变及katG315位点突变可能是促成苏州吴江地区RFP和INH耐药病例增多最为关键的分子机制。
本研究中,基因芯片与罗氏比例法药敏试验检测RFP耐药及MDR效果相近,对INH耐药的检测结果存在明显差异,由于罗氏比例法药敏试验为金标准,故初步认为基因芯片对INH耐药检测的一致性可能不及RFP与MDR。具体效果:以罗氏比例法为金标准,基因芯片检测RFP耐药的符合率为97.47%,灵敏度为94.90%,特异度为97.81%,阳性预测值为85.32%,阴性预测值为99.31%,Kappa值为0.952;检测INH耐药的符合率为94.45%,灵敏度为78.16%,特异度为99.84%,阳性预测值为99.38%,阴性预测值为93.25%,Kappa值为0.823;检测MDR的符合率为97.83%,灵敏度为82.50%,特异度为99.47%,阳性预测值为94.29%,阴性预测值为98.16%,Kappa值为0.927。由此可见,基因芯片检测RFP耐药及MDR的效果是值得肯定的,但检测INH耐药的符合率、灵敏度、阴性预测值以及Kappa值均相对偏低,其中灵敏度明显偏低,Kappa值低也进一步印证了其与金标准检测一致性存在一定不足。分析原因可能包括以下几方面:(1)非基因突变的原发性耐药造成对INH的耐药性,现已探明的机制为多层Mtb胞外包被与活性多药外排离子泵构成了屏障机制,继而对药物运输产生干扰[11-12];(2)非KatG与inhA基因(如ahpC、KasA、ndh等)的突变也与INH耐药具有一定相关性[13];(3)KatG与inhA基因中除本研究选择315及-15位点的极少数其他位点突变也可能引起INH耐药[14-15]。但总体来看,74.52%的灵敏度尚在可接受范围,同时基于检测的及时性优势,笔者认为基因芯片在苏州吴江地区临床INH耐药菌株的快速诊断价值不应被忽视。
综上所述,rpoB531、526位点突变与katG315位点突变可能是苏州吴江地区Mtb产生RFP和INH耐药的关键性分子机制,基因芯片技术能快速且高准确度地检测出以上位点的突变情况,值得在本地区推广应用于RFP和INH的耐药性检测。但基因芯片技术尚不能检出所有的基因突变位点,本研究中其对INH耐药的灵敏度相对偏低,提示现阶段该技术还必然存在某些局限,但可作为传统药敏试验的重要补充。本课题组拟在后续研究中酌情增加相关基因位点进行检测,以期进一步提高本地区对RFP和INH耐药性检测的敏感度。

