妊娠期糖尿病和妊娠期高血压患者血清IGFBP-3、Lp-PLA2对胎儿生长发育的影响
陶丽静 ,李小花,朱妙珊
(惠州市第二妇幼保健院检验科,广东惠州 516001)
妊娠期糖尿病(GDM)是指孕妇妊娠期间新确诊的糖尿病,我国GDM的发生率约为5%[1]。GDM孕妇羊水过多、巨大儿、新生儿低血糖等发生率增加,对孕产妇及新生儿的负面影响较大[2]。妊娠期高血压(HDCP)是妊娠20周后出现血压≥140/90 mm Hg,我国发生率约9%,病理生理改变基础为血管的内皮细胞受损进而发生功能障碍[3]。GDM、HDCP的发生严重影响孕产的健康、胎儿及新生而的生长发育。人胰岛素样生长因子结合蛋白3(IGFBP-3)由位于染色体7p12.3的 IGFBP-3编码,蛋白合成主要发生在肝脏,以依赖或不依赖胰岛素样生长因子的方式调节机体的生长发育,有研究发现脐血内IGFBP-3的水平与新生儿体质量呈正相关[4]。人脂蛋白相关磷脂酶 A2(Lp-PLA2)蛋白主由位于染色体6p12.3的PLA2G7基因编码,与脂代谢紊乱、炎性反应的发生密切相关[5]。有研究指出孕产妇血清Lp-PLA2的水平不仅反应孕产妇的自身健康状况,与新生儿的生长发育也密切有关[6]。此次研究,通过检测GDM、正常妊娠及HDCP 3组妊娠早、中、晚及足月分娩时新生儿脐血中IGFBP-3、Lp-PLA2的表达,研究检测结果与新生儿体质量的关系。
1 资料与方法
1.1一般资料 选择2018年4月到2019年3月来本院进行分娩的90例足月孕妇纳入本次课题研究,其中GDM组30例、正常妊娠组30例、HDCP组30例。GDM诊断标准:根据美国糖尿病协会2011年的最新GDM诊断指南,患者妊娠期间首次发现糖尿病,且糖耐量测试患者两次或两次以上空腹血糖≥5.8 mmol/L,并于产后恢复。正常妊娠组孕妇身体质量指数≤24,无妊娠并发症及其他内外科疾病。HDCP诊断标准:根据第七版《妇产科学》诊断指南,妊娠20周后孕妇首次出现舒张压≥90 mm Hg和(或)收缩压≥140 mm Hg。GDM组:孕妇年龄25~41岁、平均(30.34±5.12)岁,胎龄37~41周、平均(39.11±1.98)周。正常妊娠组:孕妇年龄25~39岁、平均(28.12±4.77)岁,胎龄37~40周、平均(38.25±1.52)周。HDCP组:孕妇年龄25~40岁,平均(29.35±4.93)岁,胎龄37~40周、平均(38.97±1.65)周。入选对象均为初产妇,签署实验相关知情同意书,并通过医学伦理委员会的审批。3组的年龄、孕周等一般资料无统计学差异(P>0.05),具有可比性。
1.2方法 所有研究对象在产前检查时分别于妊娠孕早期(第16~18周)、孕中期(第26~28周)、孕晚期(第37~40周)阶段空腹抽取5 mL静脉血,以及取5 mL新生儿的脐血,置于普通管中,待其凝固后,常温4 000 r/min离心10 min,留取上清存于-20 ℃冰箱内保存以待统一检测。血清IGFBP-3、Lp-PLA2的检测采用酶联免疫吸附法(ELISA),所用试剂盒购于上海广锐生物技术有限公司,所有操作步骤严格遵循试剂说明书标准进行。
1.3观察指标 检测GDM组和正常妊娠组妊娠时早、中、晚期以及新生儿脐血中的血清IGFBP-3、Lp-PLA2表达水平。因HDCP于妊娠20周后才能诊断,检测HDCP妊娠时中、晚期以及胎儿脐血中的血清IGFBP-3、Lp-PLA2的表达水平。比较3组孕妇的新生儿出生后体质量以及妊娠结局。

2 结 果
2.13组孕妇不同时期血清IGFBP-3水平 GDM组妊娠早、中、晚期血清IGFBP-3的水平分别为(3 023.77±546.86)ng/mL、(3 190.03±594.96)ng/mL、(4373.89±704.61)ng/mL,3组间比较血清IGFBP-3水平差异均有统计学意义(F=42.44,P=0.00),其中两两比较结果发现,妊娠早、中期孕妇血清IGFBP-3的水平差异无统计学意义(P=0.30),妊娠晚期血清IGFBP-3的表达与妊娠早、中期均有显著差异(P=0.00)。正常妊娠组早、中、晚期血清IGFBP-3的水平分别为(3 013.96±520.91)ng/mL、(3 172.04±554.72)ng/mL、(3 901.75±649.74)ng/mL,3组间比较血清IGFBP-3的水平比较差异有统计学意义(F=20.16,P=0.00),其中两两比较结果发现,妊娠早、中期孕妇血清IGFBP-3的水平比较差异无统计学意义(P=0.29),妊娠晚期血清IGFBP-3的与妊娠早、中期比较,异均有统计学意义(P=0.00)。HDCP组中、晚期血清IGFBP-3的水平分别为(3 129.27±494.37)ng/mL、(3 497.04±541.23)ng/mL,2组间比较血清IGFBP-3的水平水平比较差异有统计学意义(t=2.75,P=0.01)。妊娠早期,GDM组和正常妊娠组血清IGFBP-3的水平比较差异无统计学意义(t=0.07,P=0.94)。妊娠中期,3组血清IGFBP-3的水平比较差异无统计学意义(F=0.10,P=0.91)。妊娠晚期,3组血清IGFBP-3的水平比较差异无统计学意义(F=14.31,P=0.00),见图1。

图1 3组孕妇不同时期血清IGFBP-3表达水平
2.23组孕妇不同时期血清Lp-PLA2水平 GDM组妊娠早、中、晚期血清Lp-PLA2的水平分别为(140.15±15.47)ng/mL、(221.36±28.69)ng/mL、(268.08±40.65)ng/mL,3组间比较血清Lp-PLA2的水平比较差异有统计学意义(F=52.67,P=0.00),其中两两比较结果发现,妊娠早、中、晚期孕妇血清Lp-PLA2的水平比较差异有统计学意义(P<0.05)。正常妊娠组早、中、晚期血清Lp-PLA2的水平分别为(136.77±15.07)ng/mL、(154.93±21.29)ng/mL、(178.55±22.47)ng/mL,3组间比较血清Lp-PLA2的水平比较差异有统计学意义(F=33.31,P=0.00),其中两两比较结果发现,妊娠早、中、晚期孕妇血清Lp-PLA2的水平比较差异有统计学意义(P<0.05)。HDCP组中、晚期血清Lp-PLA2的水平分别为(255.48±35.17)ng/mL、(315.80±43.60)ng/mL,血清Lp-PLA2的水平比较差异有统计学意义(t=34.78,P=0.00)。妊娠早期,GDM组和正常妊娠组血清Lp-PLA2的水平比较差异无统计学意义(t=0.856,P=0.396)。妊娠中期,3组血清IGFBP-3的水平比较差异有统计学意义(F=20.84,P=0.00)。妊娠晚期,3组血清Lp-PLA2的水平比较差异有统计学意义(F=25.25,P=0.00),见图2。
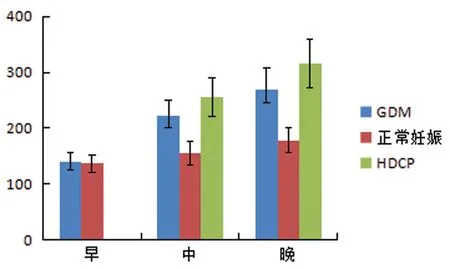
图2 3组孕妇不同时期血清Lp-PLA2表达水平
2.33组孕妇新生儿脐血中的IGFBP-3、Lp-PLA2的表达水平 GDM组、正常组、HDCP组新生儿IGFBP-3的水平分别为(1 303.76±262.41)ng/mL、(892.83±193.51)ng/mL、(617.41±170.88)ng/mL,3组间比较脐血中IGFBP-3的水平比较差异有统计学意义(F=29.52,P=0.00),其中两两比较结果发现,GDM组、正常组、HDCP组新生儿脐血中IGFBP-3的水平比较差异均有统计学意义(P<0.05)。GDM组、正常组、HDCP组新生儿Lp-PLA2的水平分别为(18.19±6.39)ng/mL、(16.52±4.81)ng/mL、(19.73±7.99)ng/mL,3组间比较脐血中IGFBP-3的水平比较差异无统计学意义(F=1.81,P=0.84),其中两两比较结果发现,GDM组、正常组、HDCP组新生儿脐血中IGFBP-3的表达均无显著差异(P>0.05),见图3。
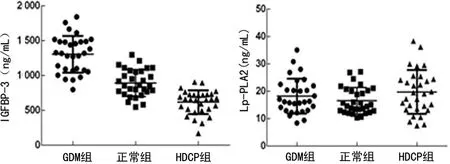
图3 3组孕妇新生儿脐血中的IGFBP-3、Lp-PLA2的表达水平
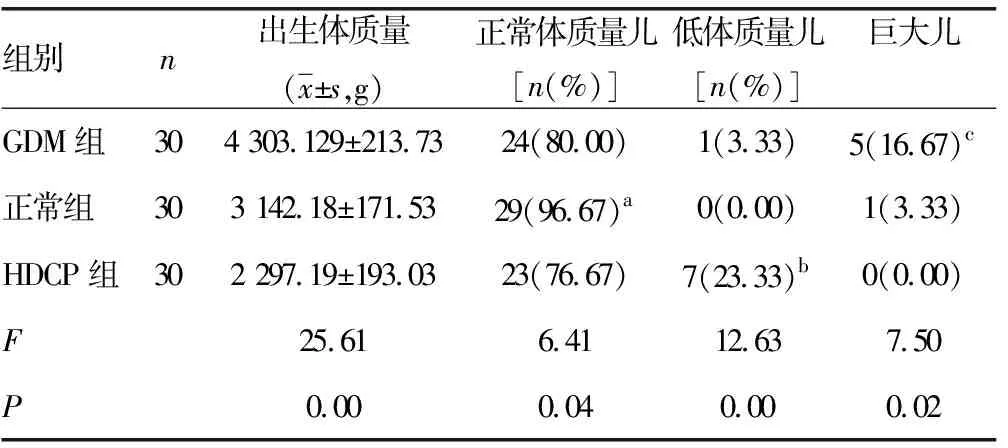
组别n出生体质量(x±s,g)正常体质量儿[n(%)]低体质量儿[n(%)]巨大儿GDM组304 303.129±213.7324(80.00)1(3.33)5(16.67)c正常组303 142.18±171.5329(96.67)a0(0.00)1(3.33)HDCP组302 297.19±193.0323(76.67)7(23.33)b0(0.00)F25.616.4112.637.50P0.000.040.000.02
注:与正常组比较,aP<0.05;与HDCP组比较,bP<0.05;与GDM组比较,cP<0.05
2.43组孕妇新生儿出生体质量比较 GDM组新生儿体质量显著重于正常组及HDCP组(P<0.05),巨大儿的出生率也明显高于正常组及HDCP组(P<0.05),HDCP组低体质量新生儿出生率明显高于其他两组(P<0.05),正常组的正常体质量新生儿出生率明显高于其他两组(P<0.05),见表1。
3 讨 论
随着人们生活水平的提高以及医疗水平的进步,GDM及HDCP的发病率逐渐增长,若控制不佳会影响孕产妇健康状况及新生儿的生长发育。引起GDM的发病因素有很多,如胰岛素抵抗、脂质代谢紊乱、遗传、免疫等[7]。HDCP的发病与血管内皮受损导致的功能障碍、滋养细胞凋亡、免疫炎症等因素密切相关[8]。因此,妊娠期间及分娩后,寻求能反应胎儿生长发育的有效生化指标,能够预测胎儿的生长发育情况,为及时采取有效的措施提供依据。
IGFBP-3是一种低分子的多肽类物质,共含有264个氨基酸,是妊娠晚期IGF-1的最主要调节蛋白,由肝脏合成和分泌[9]。IGFBP-3对IGF-1的调节是双向的,当机体IGFBP-3浓度增高时,一方面过量的IGFBP-3与IGF-1结合成一个相对分子质量约150×103的复合物,游离、发挥功能的IGF-1降低,从而细胞及组织的生长受抑制;另一方面IGFBP-3与IGFs结合后,IGF-1避免被酶类代谢消耗,半衰期延长,IGFs的作用增强,从而促进细胞的生长及分化[10]。此外,IGFBP-3还可以通过不依赖IGFs的方式调节细胞的生长发育。目前发现水解IGFBP-3的酶有激肽释放酶样丝氨酸蛋白酶、组织蛋白酶、基质金属蛋白酶[11]。本次研究发现,GDM、正常妊娠及HDCP的母血IGFBP-3的表达水平在妊娠早、中期表达比较无显著差异,在妊娠晚期的表达具有显著差异,说明IGFBP-3的水平主要在妊娠晚期合成,且GDM组的IGFBP-3水平高于正常组及HDCP组,HDCP组IGFBP-3的水平最低。此外,GDM组中新生儿脐血中IGFBP-3的水平最高、HDCP组最低。3组新生儿的体质量比较发现,数据具有显著差异,GDM组新生儿体质量最大,HDCP组体质量最低,且GDM组巨大儿的出生率也明显高于其他两组,HDCP组低体质量新生儿出生率明显高于其他两组。这些数据表明妊娠晚期母血及脐血中IGFBP-3的水平可能影响新生儿的生长发育及参与巨大儿及低体质量新生儿的出生。目前大部分研究主要侧重于GDM孕妇中IGF系统的表达与胎儿出生情况的研究,本研究结果与国内梁辉标教授等人的结论也基本一致[12]。本研究还系统性地总结了HDCP孕妇血清与新生儿脐血内IGFBP-3的表达,临床评价价值更广。
Lp-PLA2属于血管特异性炎症酶,由巨噬细胞、肥大细胞、T细胞等分泌,与低密度脂蛋白(LDL)结合形成复合体储存在体内[13]。Lp-PLA2以不依赖于钙离子的方式蛋白水解细胞内氧化卵磷脂后,形成促炎介质氧化型游离脂肪酸及溶血型卵磷脂,刺激炎症因子及黏附分子,趋化单核细胞、巨噬细胞等在血管内膜的聚集,诱导血管内皮受损,参与HDCP的形成[14]。有研究发现Lp-PLA2是诱导2型糖尿病患者发生血管病变的重要因素。GDM中Lp-PLA2表达增加的可能原因是:GDM患者发生胰岛素抵抗,且这种抵抗伴随孕周的增长而加重。加重的胰岛素抵抗反应使得孕妇处于应激状态,激活机体的Lp-PLA2活性[15]。本次研究发现,GDM、正常妊娠及HDCP的母血Lp-PLA2的水平在妊娠早、中、晚期有显著差异,且GDM组的Lp-PLA2水平高于正常组,HDCP组Lp-PLA2的水平最高。此外,GDM组、正常组、HDCP组新生儿脐血中IGFBP-3的表达均无显著差异。3组新生儿的体质量比较发现,HDCP组的低体质量新生儿出生率明显高于其他两组。这些数据表明妊娠期血清Lp-PLA2的水平在一定程度可反映孕妇的健康状态,可能以某种方式抑制新生儿的生长发育进而导致低体质量新生儿的发生。关于Lp-PLA2的研究,目前研究者们主要探讨其与HDCP患者的关系及临床意义,此次研究在HDCP中Lp-PLA2的结论与国内杨智等结论基本一致[16]。此外,本研究进一步探讨了GDM孕妇及新生儿脐血中Lp-PLA2的意义及其对新生儿体质量的影响。
妊娠晚期母血及脐血内IGFBP-3对胎儿宫内的生长发育及巨大儿的形成具有重要作用,母血Lp-PLA2的表达以某种方式抑制新生儿的生长发育进而导致低体质量新生儿的发生,具有一定的临床评价价值。
4 结 论
本文报道了母血及脐血中IGFBP-3的表达、母血Lp-PLA2的水平与胎儿宫内发育密切相关,具有临床评价价值。以往侧重在GDM探讨IGFBP-3的表达、HDCP中探讨Lp-PLA2的表达,此次研究,较为全面及系统的探讨了在GDM、HDCP、正常孕妇及脐血中IGFBP-3、Lp-PLA2的水平及其对新生儿体质量的影响。

