中和热测定装置的创新设计
张盘斌 常国旗 徐立娟
体系与环境只要存在温度差就一定可以发生热传递导致热量散失,且温度差越大,热量散失就越快越多。《化学反应原理》一课的开设时间是每学年的第一学期(大约在每年的10月份),此时,在北方的很多地区温度已经比较低了,酸碱中和反应放出的热量会使反应体系的温度升高,但环境的温度较低,传统装置虽然采取了保温措施,但是与环境温度差较大,热量散失仍然较快,给中和热测定带来不可避免的较大误差。为此,笔者设计了一种新的测定装置减小实验误差。
一、理论部分
在中和热的测定实验中产生的误差主要是由热量的传递所导致的,而热量传递的主要因素是由反应体系与环境的温度差所决定,如果设计一个装置,能使中和反应发生的体系中温度升高的同时,环境的温度也对应升高,即可减小反应体系与环境的温度差,达到一个动态的保温效果从而减小误差。如果控制不好环境温度的变化也有可能产生正误差。这样如何控制环境的温度变化就显得尤为重要,即要让环境的温度随着反应体系温度的升高而升高且接近反应体系的温度。为此笔者设计了一个新装置,让等量的酸和碱在内外两个容器中同时进行反应,外面的中和反应放出的热量会对里面的反应体系起到保温的效果,容器内外的反应释放出的热量相同,温度同时升高,减小了环境与反应体系间的温度差即可减少热传递从而减小误差,由于是内外温度同时升高且外面的保温反应的温度始终不会超过反应体系的温度,所以就不会产生正误差,新装置和传统装置分别如图1、图2所示。

图1 新装置
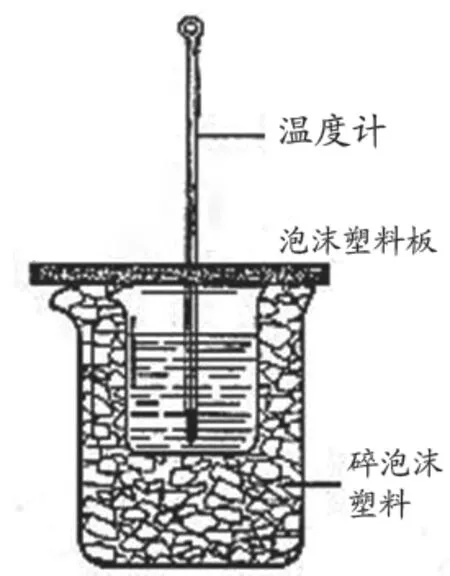
图2 传统装置
新装置的外层的反应放出的热量使温度升高,对内层的反应起到动态保温的效果,减小误差。内外两层反应物的量相等放出的热量一样多,但外层溶液浓度小,反应速率慢,外层温度接近且略低于内层温度,所以不会产生正误差。
传统装置会随着反应的进行,反应体系的温度升高,但环境温度较低。温差增大,热传递加快,反应产生的热量会散失,测定出的温度变化量偏小,造成较大的误差。
二、实验部分
1.实验用品
0.25 mol/L的盐酸溶液、0.30 mol/L的氢氧化钠溶液、0.5 mol/L的盐酸溶液、0.55 mol/L的氢氧化钠溶液、大试管、广口瓶、100 ℃温度计、橡胶塞、打孔器、传统中和热测定装置。
2.实验装置
具体的实验装置如图3所示,设置了新装置和传统装置做对比。

图3 实验装置
3.实验步骤
用两套不同的装置分别进行3次实验,并将实验数据记录在表1、表2中。

表1 新装置的实验数据

表2 传统装置的实验数据

表2 (续)
4.实验数据处理
(1)取3次测量所得数据的平均值作为计算依据(见表3、表4)。

表3 新装置的实验数据的平均值
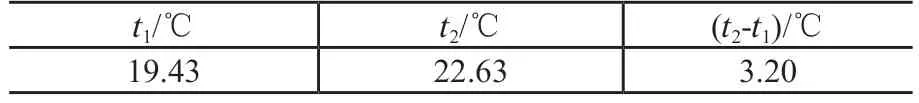
表4 传统装置的实验数据的平均值
(2)依据Q=mcΔt进行计算,近似地认为实验所用酸、碱溶液(稀溶液)的密度和比热容与水相同,并忽略实验装置的比热容,则:
50 mL盐酸的质量m1=50 g,50 mL氢氧化钠溶液的质量m2=50 g,中和反应后所得溶液的比热容为4.18 J/(g·℃)。50 mL0.5 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液发生中和反应放出的热量为:(m1+m2)·c·(t2—t1)=0.418(t2-t1)
生成1 mol H2O时的反应热为:

(3)通过以上公式可以计算两种装置下所测得的中和热。
新装置:ΔH=-56.51 kJ/mol
传统装置:ΔH=-53.50 kJ/mol
文献值:ΔH=-57.3 kJ/mol
比较发现,新装置测定出的中和热更接近文献值,误差较小。若该装置能批量生产并应用在教学中,会提高课堂演示效率,也能培养学生的化学核心素养。

