三种检测方法对浸润性膀胱癌患者行膀胱部分切除术后复发的预测价值
梅延辉 武玉海 门婷婷 李刚 牛文杰 刘少青
1 滨州医学院附属医院泌尿外科256600 山东滨州
2天津医科大学第二医院泌尿外科
膀胱癌是临床上最常见的泌尿系统恶性肿瘤,国内发病率在(1.4~3.8)/10 万人,存在地域差异和性别差异,近年来其发病率逐渐升高[1]。外科手术是治疗膀胱癌的首选方案,但对于浸润性膀胱癌,术后复发风险较高,如何预测和降低术后复发是临床工作的重点和难点[2-3]。近年来研究发现,血清可溶性细胞间粘附分子(soluble intercellular adhesion molecule 1,sICAM-1)、肿瘤特异性生长因子(tumor specific growth factor,TSGF)及 癌 胚 抗 原(carcinoembryonic antigen,CEA)检测对膀胱癌的诊断和疗效评估同样具有较高灵敏度,但其在膀胱癌复发监测方面的研究较少[4-5]。我们分析了75 例行膀胱部分切除联合化疗治疗的浸润性膀胱癌患者临床资料,重点探讨sICAM-1、TSGF 及CEA 检测在预测浸润性膀胱癌术后复发方面的应用价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2012 年1 月-2016 年12 月滨州医学院附属医院泌尿外科与天津医科大学第二医院泌尿外科收治的膀胱部分切除联合化疗的肌层浸润性膀胱癌患者为研究对象,纳入标准:①新发膀胱癌,经病理学检查确诊为肌层浸润性膀胱癌;②术前检查未发现盆腔内及远处转移;③因患者身体因素或个人意愿选择膀胱部分切除治疗;④可耐受手术治疗,且术前未行抗肿瘤治疗;⑤随访时间大于3 个月。排除标准:①合并其他肿瘤;②存在泌尿系统感染、结石患者;③近期接受侵入性泌尿系统检查或手术者;④存在其他脏器严重疾病者;⑤未按要求接受治疗或围术期资料不完整者。共筛选出75 例符合标准的患者纳入研究,其中男41 例,女34 例,年龄54~79 岁,平均(70.53±6.57)岁。肿瘤单发者46 例,多发者29 例;肿瘤直径0.6~5.7 cm,平均(3.24±1.22)cm,多发肿瘤者以最大肿瘤为标准;TNM 分期:Ⅱ期40 例,Ⅲ期35 例;组织分化情况:高、中分化45 例,低分化30 例。
1.2 研究方法
1.2.1 治疗方法 所有研究对象接受膀胱部分切除术。全麻后取平卧位,下腹部正中切开腹壁,于腹膜外侧显露膀胱壁,经导尿管吸出膀胱内液体,用纱布保护切口周围组织;在膀胱外朝病灶部位逐层分离,用血管钳在距肿瘤2 cm 处钳住膀胱壁,边游离边切开膀胱,找到并切除肿瘤及其周围2 cm 正常膀胱壁,避免挤压肿瘤导致肿瘤细胞扩散。术后24 h 内接受吡柔比星(辉瑞制药,国药准字H20045983)30 mg+5%葡萄糖注射液50 mL 膀胱灌注化疗,每周1 次,8 周后改为每4 周1 次,连续灌注1 年。术后半月开始行GC方案化疗,第1、8、15 天给予吉西他滨(豪森,国药准字20030104)1.0 g/m2静脉滴注;第2 天给予顺铂(齐鲁制药,国药准字H37021358)25 mg/m2静脉滴注,28 d 为1 个疗程,行4 个疗程。
1.2.2 随访 自化疗完成后开始随访,患者每3个月门诊复查评估肿瘤复发情况,随访截止至2018 年12 月。复发判定标准:行膀胱镜及影像学检查发现复发肿瘤,对于疑似复发者采集病理标本检查确诊。根据随访2 年内是否复发将研究对象分为复发组和未复发组。
1.2.3 观察指标 所有研究对象于化疗完成后抽取晨起空腹外周静脉血5 mL,室温静置30 min,采用低温离心机3 000 r/min(离心机半径=10 cm)离心10 min,取血清置于-80℃待检;分别采用酶联免疫吸附法检测血清sICAM-1 和TSGF 水平,配套试剂购于德国SIEMENS 公司;采用电化学免疫法检测CEA 水平,检测试剂购于罗氏公司,严格依据说明书进行检验操作。
1.3 统计学方法
2 结果
2.1 随访结果
75 例浸润性膀胱癌患者均顺利完成手术,术后无切口种植,无切缘阳性。75 例患者均完成随访,其中26 例患者出现复发(34.67%),其中第1年 复 发 者17 例(22.67%),第2 年 复 发 者9 例(12.00%);复发部位:原位22 例,非原位4 例。
2.2 复发与未复发患者临床特征比较
复发组与未复发组患者在性别、年龄、肿瘤数目以及肿瘤直径方面比较,差异无统计学意义(P>0.05);复发组中,TNM 分期Ⅲ期和低组织分化程度患者比例显著高于未复发组(P<0.05)。见表1。
2.3 复发组与未复发组患者血清sICAM-1、TSGF 及CEA 水 平 比 较
复发组患者血清sICAM-1、TSGF 及CEA 水平均高于未复发组,差异有统计学意义(P<0.05)。见表2。
2.4 多因素Logistic 回归分析
Logistic 回 归分析显示,血清sICAM-1、TSGF 及CEA 水平高是浸润性膀胱癌患者术后复发的独立危险因素(P<0.05)。见表3。
2.5 血 清sICAM-1、TSGF 及CEA 对 浸 润 性 膀 胱癌复发的预测价值
sICAM-1、TSGF 及CEA 预测浸润性膀胱癌复发的AUC 分别为0.822、0.857、0.852,三者最佳临界值为58.37 ng/L、73.51 U/mL、9.48 μg/L,预测灵敏度为69.2%、73.1%、76.9%,特异度为93.9%、91.8%、87.8%。见表4。
3 讨论
浸润性膀胱癌是一种常见膀胱癌类型,具有低分化、恶性程度高和预后差的特点。根治性膀胱切除术是治疗浸润性膀胱癌的标准术式,但该手术需要膀胱全切和尿流改道,对患者生活质量影响较大,且部分患者难以耐受,因此保留膀胱术仍是临床上的常用术式[6]。保留膀胱术虽能改善患者症状、控制疾病进展和保留膀胱功能,但患者术后复发率较高[7]。据统计,肌层浸润性膀胱癌患者行保留膀胱手术后2 年复发率达50%以上,且10%~15%的复发膀胱癌患者病情存在不同程度的恶化[8]。分析膀胱癌复发的危险因素有助于指导临床选择合适手术方案,及早采取干预措施和改善预后效果。我们分析本资料75 例浸润性膀胱癌患者临床特征发现,随访期间26 例患者复发,其中17 例为治疗后1 年内复发,说明治疗后1 年是浸润性膀胱癌复发的高峰期,应密切关注。另外,复发患者与未复发患者在性别、年龄、肿瘤数目以及肿瘤直径方面无明显差异,但复发组患者肿瘤TNM 分期在Ⅲ期和低组织分化程度患者所占比例显著高于未复发组,说明肿瘤分期以及组织分化程度与浸润性膀胱癌术后复发密切相关。
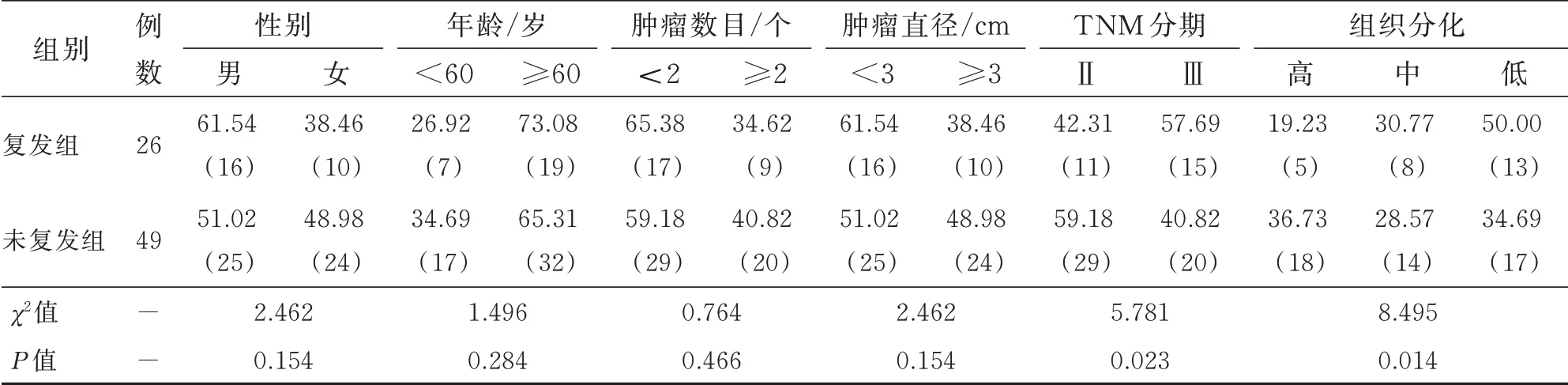
表1 复发与未复发患者临床特征比较 %(n)
表2 复发与未复发患者血清sICAM-1、TSGF 及CEA 水平

表2 复发与未复发患者血清sICAM-1、TSGF 及CEA 水平
组别复发组未复发组t 值P 值例数26 49--sICAM-1/(ng·L-1)59.42±16.32 39.29±12.85 5.870 0.000 TSGF/(U·mL-1)80.62±18.91 55.09±13.24 6.925 0.000 CEA/(μg·L-1)11.55±3.04 7.25±2.55 6.482 0.000
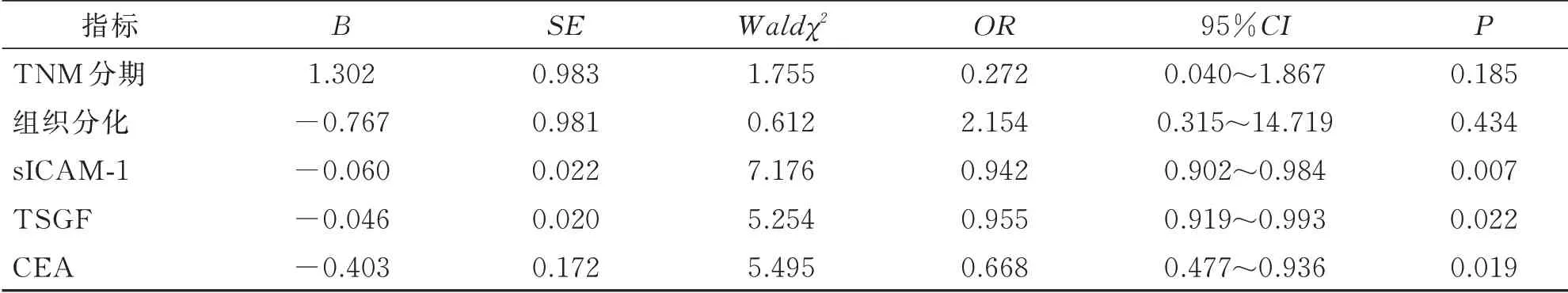
表3 多因素Logistic 回归分析
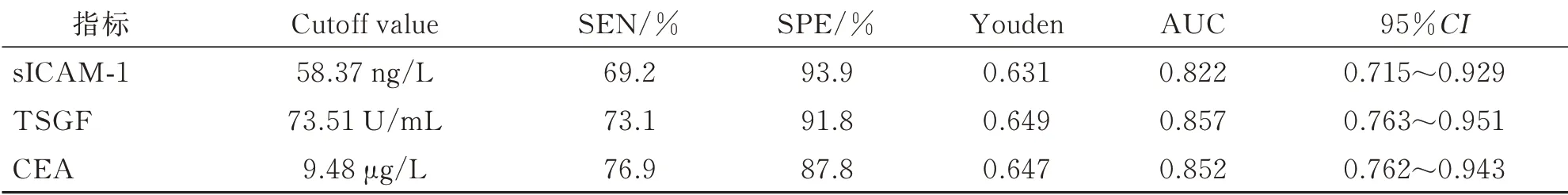
表4 sICAM-1、TSGF 及CEA 对浸润性膀胱癌复发的预测价值
相关报道显示,多种细胞因子参与肿瘤细胞信号传导以及生长活化过程,在肿瘤细胞的增殖分化和转移过程中起关键作用,观察其表达情况不仅提高了膀胱癌的诊断率,同时也有助于对患者预后进行评估[9]。sICAM-1 为免疫球蛋白家族成员,参与肿瘤免疫应答过程,在肿瘤细胞生长、侵袭和转移过程中发挥重要作用[10];TSGF 是肿瘤形成及毛细血管增殖过程中释放到外周血中的小分子物质,属于新型恶性肿瘤标志物[11];CEA 是黏膜上皮细胞所分泌的糖基化蛋白,可用于肺癌、卵巢癌、胰腺癌等多种肿瘤疾病诊断和监测[12]。sICAM-1 是一种糖基化修饰的单链糖蛋白,广泛分布于人体白细胞、淋巴细胞、单核细胞以及血管内皮细胞等,参与免疫和炎症反应过程[13]。大量研究发现,sICAM-1、TSGF 及CEA参与包括膀胱癌在内的多种恶性肿瘤的发生、发展过程,同时也可作为乳腺癌、肝癌、宫颈癌患者预后的判断指标[13-14]。本研究结果显示,复发组患者血清sICAM-1、TSGF 及CEA 水平显著高于未复发组,提示sICAM-1、TSGF 及CEA 高表达与浸润性膀胱癌的复发有关,三者可能参与浸润性膀胱癌的术后复发的调控过程。Logistic 回归分析显示,在排除肿瘤分期及分化程度干扰后,血清sICAM-1、TSGF 及CEA 水平高是导致浸润性膀胱癌患者术后复发的独立危险因素。肿瘤的复发不仅与TNM 分期和组织分化程度有关,而且受手术及放化疗的影响,个体间存在较大差异。sICAM-1、TSGF 及CEA 等生物因子在肿瘤进展过程中起着重要作用,分析术后及化疗后血清sICAM-1、TSGF 及CEA 表达情况更有助于判断肿瘤细胞活性,预测肿瘤复发[15-16]。本研究绘制ROC 曲线分析发现,sICAM-1、TSGF 及CEA预测浸润性膀胱癌复发的AUC 分别为0.822、0.857、0.852,说明三项指标对浸润性膀胱癌的预测具有良好应用价值;根据Youden 指数得出sICAM-1、TSGF 及CEA 预测患者复 发 的 最 佳 临界值分别为58.37 ng/L、73.51 U/mL、9.48 μg/L,且预测灵敏度为69.2%、73.1%、76.9%,特异度为93.9%、91.8%、87.8%,提示血清sICAM-1、TSGF 及CEA 水平监测可作为预测浸润性膀胱癌患者术后复发的有效手段。
综上所述,肿瘤分期高和组织分化程度低是浸润性膀胱癌患者术后复发的危险因素,监测血清sICAM-1、TSGF 及CEA 水平有助于早期预测术后复发,从而指导临床医生采取有效的干预措施。

