配方奶粉中添加2'-岩藻糖基乳糖对小鼠消化吸收功能影响
潘丽娜,李泽,郁欢欢,毛筱,韩知妍,王建武
(1.澳优乳业(中国)有限公司澳优食品与营养研究院,长沙410005;2.中南大学湘雅公共卫生学院,长沙 410005)
0 引 言
低聚糖,是人成熟乳汁中除乳糖和脂类外质量浓度最高的固体物质。而在其它哺乳动物的乳汁中,这些低聚糖的质量浓度较低[1]。人初乳中HMOs质量浓度为22~23g/L[2],比牛乳约高20倍[3]。被认为是人类母乳和婴儿配方食品之间最大的组成差异[4],具有益生元和膳食纤维的功效。2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)是人乳中最常见的岩藻糖基乳糖[5],在母乳中的质量浓度接近于2g/L[6-8],占总 HMOs的30%[9-10],同样具有益生元的特性[11]。近年来,2’-FL拥有了GRAS[12]并通过了欧盟适用于配方奶粉的安全性评价[13]。国内还没有关于其对消化吸收产生影响的相关研究。因此,本研究旨在以BALB/C小鼠为动物模型,研究饲粮中添加2’-FL对动物生产性能、血液生化指标、养分利用程度的影响,为如何改善婴幼儿奶粉配方提供可靠的理论参考。
1 实验
1.1 材料设备
低聚糖成分为2’-岩藻糖基乳糖(2’-FL),白色粉末状。配方奶粉。
氨基酸标准品(分析纯),乙腈(色谱纯)、磷酸二氢钾、氢氧化钠、氢氧化钾、硼酸、盐酸(分析纯)。
K9840型自动凯氏定氮仪,CS-T300型全自动生化分析仪,A200i型半自动纤维分析仪(ANKOM),H1650R型台式高速冷冻离心机,MB-530型多功能酶标分析仪,LC-20A型液相色谱仪。
1.2 试验动物与试验条件
BALB/C小鼠6~8周龄,共60只,初始体质量(22.66±1.08)g,试验动物饲养于中南大学SPF级动物实验室,温度21~23℃,相对湿度50%~60%,12h光照/12h黑暗。
1.3 方法
1.3.1 动物的分组及处理
6~8周龄的60只BALB/C小鼠随机分为3个处理组,即生理盐水组(空白对照组)、质量分数为1g/kg的2’-FL低剂组和质量分数为2g/kg的2’-FL高剂组。每个处理20只,每笼饲喂5只,即每个处理组有4个重复。实验期间,各组小鼠给足奶液(按照奶粉与温水6∶1调制),每12h更换1次,保证奶液的新鲜程度,每次更换奶液时,量取剩余奶量并记录。为了保证小鼠的营养供应,给予奶液的同时,给予饲料,奶饲比例为7∶3。2’-FL用UP水配制,当日现配现用,每日清晨灌胃。
1.3.2 样品采集
从实验期第8天起,每天上、下午各采集2次,收集每笼BALB/C小鼠的新鲜粪便,清理粪便中毛等杂物,混合均匀,加入0.5mL10%硫酸拌匀,置于-20℃冰箱保存。连续收集粪样20d,将饲料样和粪样置于65℃烘箱中烘干,粉碎,过40目筛,装入自封袋中,待测。
实验第28d小鼠空腹过夜,次日早上称重,摘眼球采血。用EDTA抗凝管采集的血样于试管架上静止30min后,以转速为3000r/min离心15min,取血浆,-20℃保存,用于测定血浆中的游离氨基酸;含有草酸钾/氟化钠的采血管采集的血液样本,-20℃保存,用于测定血液葡萄糖(GLU);用普通血清管采集的血样于试管架上静止30min后,以转速为3000r/min离心15min,取血清,-20℃保存,测定其他血清生化指标。
1.4 样品的检测
1.4.1 生长性能的测定
记录幼龄小鼠每日采食量、初始重和第28天末重,计算平均日增重(ADG)、平均日采食量(ADFI)及料肉比(F/G)。
1.4.2 血清生化指标
血浆中的游离氨基酸采用全自动氨基酸分析仪测定;胰岛素(Ins)和胰岛素样生长因子1(IGF-1)采用MB-530多功能酶标分析仪测定;血清中尿素氮(BUN)采用日立7020全自动生化分析仪测定。
1.4.3 营养物质消化率的测定
小鼠预饲3d,生长实验期为28d,从生长实验期第8d开始,连续20d收集全粪,-20℃保存。饲料与粪样中水分质量分数参照GB/T6435-2006的方法测定;能量值参照ISO9831-1998的方法测定;粗脂肪质量分数参照GB/T6435-2006的方法测定;粗蛋白质量分数参照GB/T6432-1994的方法测定;粗纤维质量分数参照GB/T6434-1994的方法测定;粗灰分质量分数参照GB/T6438-2007的方法测定;AIA质量分数参照GB/T23743-2009的方法测定;Ca质量分数参照GB/T6436-2002中的高锰酸钾法测定;Pi质量分数参照GB/T6437-2002中磷钒钼酸比色法测定。
使用酸不溶灰分(AIA)作为指示剂,计算养分表观消化率。计算公式为

式中:M1为饲粮中指示剂质量分数;M2为粪中指示剂质量分数;N1为饲粮中养分质量分数;N2为粪中养分质量分数。
1.5 统计方法
计量资料以均数±标准差表示,采用SPSS18.00软件包进行数据处理。若数据呈现正态分布,且各组间方差齐,则采用单因素方差分析(one-wayANOVA)处理,结果用平均数±标准差表示,并用LSD法进行多重比较。以P≤0.05为差异有统计学意义。
2 结果与讨论
2.1 添加2’-FL的配方奶粉对小鼠的生产性能的影响
经单因素方差分析,对照组与2’-岩藻糖基乳糖组在平均日增重、平均日采食量和料肉比方面差异不显著(P>0.05),如表1所示。有研究显示[14-15]2’-FL组和对照组的体质量相似,这与本文得出的2’-FL对小鼠生长性能的影响无统计学意义的研究结果一致。可能原因为配方奶粉不是小鼠的最佳饲料而产生的结果。
2.2 添加2’-FL的配方奶粉对小鼠血清生化指标影响
动物机体的健康状况及营养代谢直接影响着血液的生化参数,因此这些生化指标反映了机体的生理机能情况[16]。氨基酸是构成机体免疫系统的基本物质,氨基酸及其代谢产物在调节机体免疫代谢的相关过程中有着不可替代的作用。同时氨基酸的质量浓度也反映着蛋白质的利用情况。对血浆游离氨基酸水平的测定结果,进行单因素方差分析。结果显示,对照组与2’-岩藻糖基乳糖组相比,血浆中游离氨基酸,天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr))、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr)、缬氨酸(Val)、异亮氨酸(Ile)、苯丙氨酸(Phe)、亮氨酸(Leu)、赖氨酸(Lys)差异均无统计学意义(P>0.05)。本次血浆游离氨基酸结果没有统计学意义,可能是因为只有当供给量超过需要量时,血浆中的氨基酸浓度才会上升。
质量分数为1g/kg的2’-FL低剂组和质量分数为2g/kg的2’-FL高剂组的小鼠血中胰岛素质量浓度与对照组相比,升高了 23.9%(P>0.05)及 48.7%(P<0.05)。类胰岛素因子水平也分别提高了56.9%和6.6%,但差异不显著(P>0.05)。质量分数为1g/kg的2’-FL低剂组,尿素氮水平虽有下降趋势,下降了17.59%,但差异不显著(P>0.05),结果如表2所示。血浆尿素氮是反映饲粮蛋白质利用效率的有效指标[17]。本研究中,尿素氮结果和与表3中蛋白质的表观消化率结果一致,表明配方奶粉中添加2’-FL,对蛋白的消化吸收能力无影响。高剂量组与对照组相比,血中胰岛素质量浓度增加,血糖浓度有下降趋势,但没有统计学意义。可能因为2’-FL具有难消化的特性,不能被胃和小肠消化吸收,对血糖的影响较小。

表1 添加2'-FL的配方奶粉对小鼠的生产性能的影响
2.3 营养物质消化率
养分表观消化率的测定可以比较直观的反映饲粮的可消化性及动物的消化能力[18-19]。营养物质主要被小肠绒毛吸收,低聚糖可以改善肠道黏膜形态,提高十二指肠、空肠的绒毛高度,增加了小肠的吸收面积,促进营养物质的消化吸收[20]。2’-FL可被双歧杆菌利用,提高肠道内双歧杆菌的丰度,双歧杆菌可促进肠道分泌消化酶,维持肠道内的酸性环境[21],从而提高养分物质的利用率。由表3可以看出,与对照组相比,2’-FL组各养分的表观消化率均高于对照组。其中质量分数为1 g/kg的2’-FL低剂组、质量分数为2 g/kg的2’-FL高剂组粗脂肪表观消化率分别提高10.0%(P<0.05)、4.47%(P>0.05)。总能的表观消化率分别提高了22.4%(P<0.05)、10.5%(P>0.05)。
低聚糖具有膳食纤维结合金属离子的作用,不能被胃和小肠吸收,到达大肠后被微生物发酵分解后,同时释放了出了钙、镁等矿物质。低聚果糖产生的短链脂肪酸会降低了肠道pH值,增加钙、镁等矿物质溶解度,使其以离子形式存在。短链脂肪酸还能刺激黏膜细胞生长,提高肠黏膜对矿物质的吸收能力[22]。由表3可以看出,质量分数为1 g/kg的2’-FL低剂组、质量分数为2 g/kg的2’-FL高剂组钙的表观消化率与对照组相比分别提高了18.3%(P<0.05)、9.9%(P>0.05)。磷的表观消化率中,质量分数为1 g/kg的2’-FL低剂组、质量分数为2 g/kg的2’-FL高剂组较对照组分别提高了19.0%(P<0.05)、7.4%(P>0.05)。
3 结论
小鼠饲粮中添加2’-FL可以增加血中胰岛素的含量,提高营养物质粗脂肪、总能、钙和磷的消化利用率,但对小鼠的生长性能无影响。对于婴幼儿,配方乳粉中添加2’-FL是否会能提高婴幼儿对营养物质的表观消化率有待进一步验证。
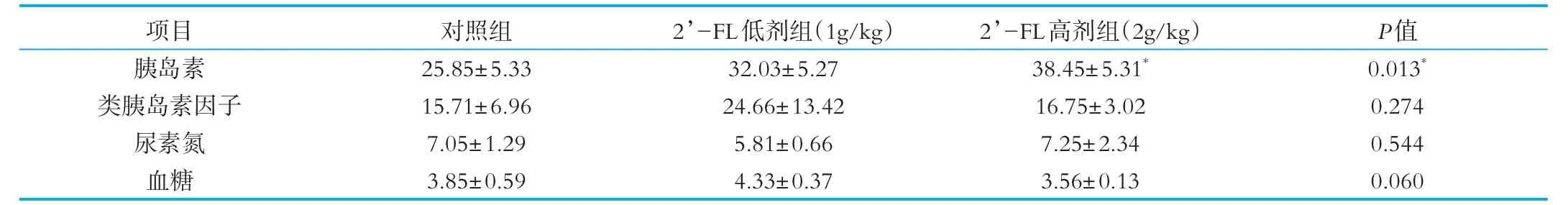
表2 添加2'-FL的配方奶粉对小鼠血清生化指标的影响

表3 添加2'-FL的配方奶粉对小鼠养分表观消化率%的影响

