ARFI技术评估不同深度乳腺良恶性病灶的价值
崔亚云,隋秀芳,叶 磊,张 杰,王 磊
最新的癌症统计学概述中提出乳腺癌是全球女性最常见的癌症,也是导致女性癌症死亡的主要原因[1],我国乳腺癌的发病率和死亡率逐年升高,是45岁以下女性最常见的癌症死因[2],其预后跟临床分期有很大的关系。乳腺原位癌患者五年生存率高达98.6%,而浸润性乳腺癌五年生存率是83.8%。当乳腺癌患者出现远处转移的时候,五年生存率只有23.3%[3]。因此,尽早、准确地诊断是治疗乳腺癌的关键[4]。
钼靶X线摄片及常规超声检查是诊断乳腺疾病常用的方法,随着科技的不断进步,这些方法的诊断乳腺疾病标准也不断改进,仍然不可避免地具有局限性。声脉冲辐射力成像技术(acoustic radiation force impulse,ARFI)是一种新兴的、有前景的成像技术,是基于评估组织硬度的成像方式, 包括声触诊组织成像技术 (virtual touch imaging,VTI)及声触诊组织定量技术 (virtual touch quantification,VTQ)[5]。该研究探讨ARFI技术在诊断乳腺良恶性疾病上的价值,以及对于深度不同的乳腺病灶,ARFI技术的参数是否会发生明显变化。
1 材料与方法
1.1 病例资料选取2015年1月~2018年11月于中国科学技术大学附属第一医院进行乳腺超声检查发现病灶,并经细胞学穿刺或外科手术得到病理结果的109例患者,共109个病灶,患者年龄23~80(47±3.91)岁,均为女性。所有检查都是在患者知情同意情况下进行。选择患者需根据如下标准:① 为了避免测量VTQ值的取样框包含正常乳腺腺体、周围脂肪及明细的液性成分,病灶的实质部分应该大于6 mm×5 mm[6];② 剔除二维超声图像上显示为明显的囊性病灶;③ 对病灶没有做过任何治疗。
1.2 仪器与方法使用西门子 S2000彩色多普勒超声诊断仪,9L4线阵探头(4~9 MHz),配备ARFI技术。本次研究由两名高年资且受过正规ARFI技术培训的医师完成。
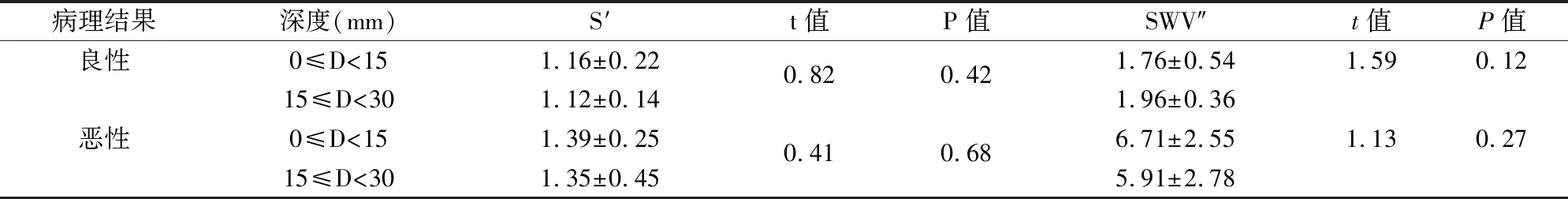
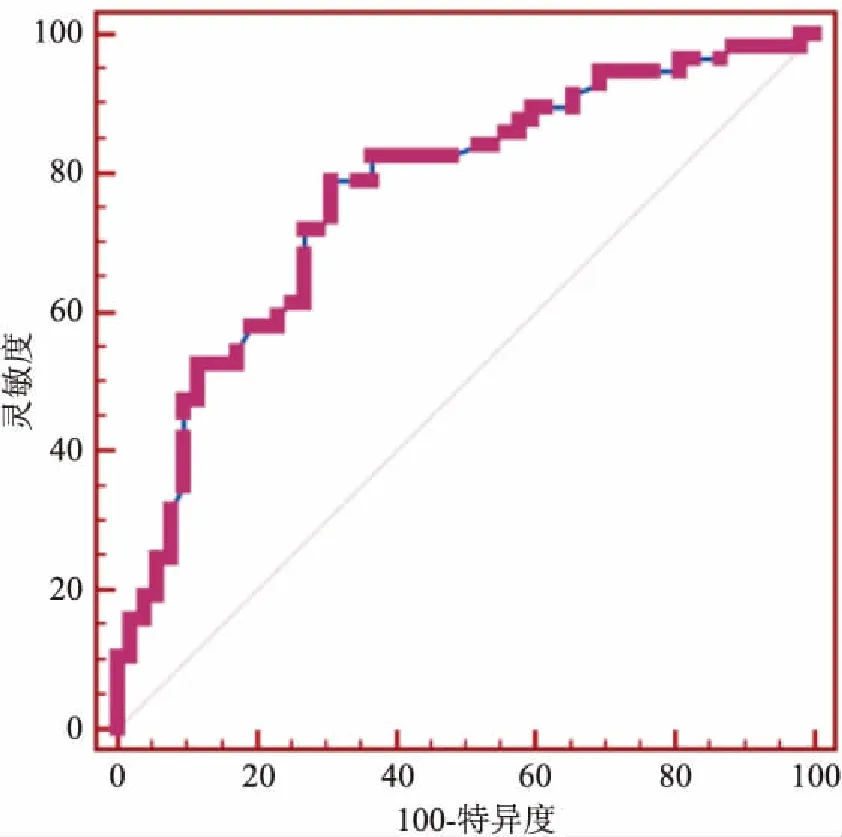
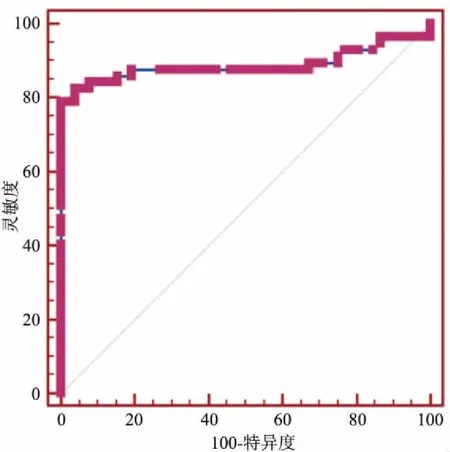
首先嘱患者平躺于检查床,两臂上举并充分暴露乳房。一名医师(A)在常规超声下找到显示病灶的最佳切面,探头轻贴皮肤,不可施压。嘱患者屏气,启动VTI,测量肿块VTI面积及灰阶面积,计算二者比值S。接着启动VTQ,将取样框放于肿块中央,避免纳入囊性部分及钙化灶,探头轻贴皮肤,嘱患者屏气,按下update键,记录测量深度及剪切波速度(shear wave velocity,SWV)数值,同样的方法再重复4次,共记录5个SWV数值。保持同一深度不变,轻移探头,测量病灶周围正常腺体的SWV′值5次。再由另一名医师(B)同样方法测得肿块的VTI面积与灰阶面积比S,病灶SWV及正常腺体SWV′各5次。分别计算A与B所测得两次S的平均值S′及10个SWV及SWV′平均值,从而进一步计算病灶SWV的平均值与正常腺体SWV′平均值的比值SWV″。最后根据病灶距离皮肤表面的深度不同,将所有良性病灶及恶性病灶分别分为0 mm 机器设定VTQ模式下SWV测值范围为0~9 m/s。当反复测定SWV均为X.XX,排除方法上的影响,则判断为病灶硬度超过9 m/s,便于数值统计,将其记录为9 m/s[7]。 2.1 病理结果本次研究中的109例乳腺病灶,经病理学诊断,良性病灶52例,恶性病灶57例,其病理类型及对应例数见表1。 2.2 乳腺病灶VTI面积与灰阶面积比S′结果恶性病灶的面积比S′大于良性病灶的S′,差异有统计学意义(t=4.16,P<0.001),见表2、图1。S′在诊断乳腺恶性病灶的ROC曲线下面积为0.77(95%CI:0.68~0.86),诊断阈值(截点值)为1.18,见图2;敏感度、特异度、阳性预测值、阴性预测值、约登指数分别为78.95%、69.23%、73.77%、75%、0.48,见表3。 2.3 乳腺病灶与同深度腺体的剪切波速度比值SWV″结果恶性病灶的速度比值SWV″大于良性病灶SWV″,差异有统计学意义(t=11.63,P<0.001),见表2、图1。SWV″在诊断乳腺恶性病灶的ROC曲线下面积为0.89(95%CI:0.81~0.96),诊断阈值(截点值)为2.93,见图3;敏感度、特异度、阳性预测值、阴性预测值、约登指数分别为78.95%、100%、100%、81.25%、0.79,详见表3。 表1 109例病灶病理类型及对应例数 表2 良恶性肿块的面积比S′与剪切波速度比值SWV″的比较 表3 良恶性肿块的面积比S′与剪切波速度 2.4 不同深度的乳腺病灶面积比S′与剪切波速度比SWV″的比较良性病灶深度在0~15 mm及15~30 mm的病灶,面积比S′与剪切波速度比SWV″,P值分别为0.42、0.12,差异均无统计学意义;恶性病灶深度在0~15 mm及15~30 mm的病灶,面积比S′与剪切波速度比SWV″,P值分别为0.68、0.27,差异均无统计学意义,见表4。 图1 良性及恶性病灶的VTI及VTQ图像A、B:分别为良性及恶性病灶的VTI图像;C、D:分别为良性及恶性病灶的VTQ图像表4 良性病灶及恶性病灶的S′与SWV″在两组之间分别比较 病理结果深度(mm) S′ t值P值SWV″t值P值良性0≤D<151.16±0.220.820.421.76±0.541.590.1215≤D<301.12±0.141.96±0.36恶性0≤D<151.39±0.250.410.686.71±2.551.130.2715≤D<301.35±0.455.91±2.78 图2 乳腺病灶VTI面积与灰阶面积比S′的ROC曲线 图3 乳腺病灶与同深度腺体的剪切波速度比值SWV″的ROC曲线 二维及彩色多普勒超声操作简单、安全无创、价廉,是乳腺包块的首选检查技术[8],但其并不能反映组织内部软硬度。超声弹性成像技术不仅提供了病灶形态学上的信息,还能让检查医师了解到组织的弹性[9]。 Ophir et al[10]首次提出弹性成像概念,根据组织自身的弹性特性进行成像,组织弹性系数越大,引起的应变相对较小,表示其硬度较大。Krouskop et al[11]研究了乳房内各组织的弹性系数由小到大依次为脂肪组织、正常乳腺组织、乳房纤维组织、导管内原位癌、导管浸润癌。基于弹性系数的不同,弹性成像有助于乳腺病灶内部性质的诊断。 传统的弹性成像发展较为成熟的是压迫式弹性成像技术。它是一种定性的评价方法,且应变图像的采集需要外力加压实现,而压力的大小对弹性评分有一定的影响[12]。ARFI是在弹性成像基础上发展起来的一项新技术。这种技术不需要外部加压,利用调制的聚焦超声波作为激励机制,组织受力后产生位移。这种位移可以反映局部软组织的粘弹性能。因此,ARFI成像能够视觉上定性和定量计算,且迄今已在众多应用中根据其粘弹性特征划定深部组织结构[13]。 本研究为排除方法学误差,由两名医师分别对病灶及正常腺体的剪切波速度进行测量。通过计算病灶在VTI上的面积与灰阶面积比值及在VTQ上的剪切波与周围正常腺体剪切波速度的比值,避免了不同操作方式及病灶深度等因素对结果的影响,提高了准确性。从结果中可以得出:恶性病灶面积比S′大于良性病灶,SWV″也大于良性病灶。可能由于恶性病灶一般呈浸润性生长,在灰阶图像上显示边界不清,形态不规则,而VTI图像是在弹性系数的基础上建立的,能更为清晰地显示恶性病灶的边界,其在VTI上显示的面积比灰阶图像上的大。在操作中发现恶性病灶在VTI图像上的边界比良性病灶在VTI图像上显得更清晰,可能是因为恶性病灶与周围正常腺体的声阻抗差别较大,弹性系数也有明显差别,这与王荣 等[14]的研究结果相符。恶性病灶的SWV值大于良性病灶,原因可能在于恶性病灶快速生长,内部出现坏死、液化、钙化、纤维化修复等,声阻抗增加,这些都会使剪切波速度增高。 不同深度的良性、恶性病灶S′及SWV″之间差异无统计学意义,提示不同深度病灶的S′、SWV″参数值比较稳定,主要由于本研究采用比较比值的方法,这样即使深度不同对弹性结果有一定影响,经过比值处理后会提高数值的稳定性。 虽然本次研究在设计上尽可能地排除了一些主观因素的影响,但仍存在一些局限性:① 样本量不够大且病理类型比较单一,恶性病灶大多病理诊断为浸润性导管癌,良性病灶多数为纤维腺瘤;② 本次研究分组只分成以上两组,需要收集更多病例,将分组分的更细,增加组内病例;③ 本研究中参数S′及SWV″在诊断恶性病灶时数值较稳定,接下来需做进一步探讨以制定定量标准。 总之,ARFI技术是基于超声弹性成像发展起来的新技术,能够定性和定量的获得病灶信息,有助于诊断乳腺疾病的良恶性,为临床诊治工作提供有力地帮助。
2 结果

3 讨论

