ARL2在宫颈癌组织中的表达及对宫颈癌细胞表型的影响
彭瑞清,王 杨,孙 颖,王 凊,胡志东
宫颈癌是妇科常见的肿瘤之一,是严重威胁女性健康的常见恶性肿瘤,据国际癌症中心统计,全球每年新发宫颈癌人数约49.3万,死亡27.4万,其中85%以上发生在低收入和中等收入国家[1]。2015年中国子宫颈癌新发病例约9.89万例,死亡病例约3.05万例[2]。目前对于宫颈癌的治疗多采用手术、放疗及辅助化疗等方法,5年生存率始终在50%左右。因此,进一步寻找宫颈癌早期的分子标志物及潜在的治疗分子靶点成为临床的热点。
本实验前期发现ADP-核糖基化样因子2(ADP ribosylation factor like protein 2,ARL2)在宫颈癌组织中表达水平明显升高。ARL2是一种单体的GTP结合蛋白,为ADP-核糖基化因子(ADP-ribosylation factor,ARF)亚家族成员之一[3]。ARL家族广泛的存在于各种真核生物中,但其结构和功能高度保守,在生物体中有着重要的病理生理功能[4]。在肿瘤领域,ARL2扮演着癌基因或抑癌基因的角色,成为治疗的靶点。做为ARL家族中比较有代表性的成员,ARL2的研究虽然有了一些成果,但ARL2在宫颈癌中的研究却少见报道。现采用RNA 干扰ARL2 的表达,探讨其对宫颈癌细胞的生长、侵袭以及迁移能力的调节作用,以期为阐明宫颈癌发生和转移的机制提供基础。
1 材料与方法
1.1 主要材料
1.1.1细胞和组织 HeLa细胞和C33A细胞购自天津赛尔生物技术有限公司;含10%胎牛血清、100 IU/ml青霉素、100 μg/ml链霉素的RPMI 1640,置于细胞培养箱中培养(培养条件:37 ℃,5%CO2)。15对经病理学检查确诊的人宫颈癌组织及其对应正常宫颈组织标本为天津医科大学总医院中心实验室保存。
1.1.2试剂 RPMI 1640细胞培养液、胰蛋白酶和胎牛血清(美国GIBCO公司)、脂质体lipofectamine 2000、兔源抗-GAPDH抗体、无血清培养基Opti-MEM(德国SIGMA-ALDRICH公司),兔源抗-ARL2抗体、HRP标记羊抗兔IgG抗体(北京OFT公司),SuperRX感光胶片(FUMINGWEI公司)。
1.2 方法
1.2.1质粒转染 采用Lipofectamine 2000脂质体转染法,分成两组进行实验:对照质粒siR-Ctrl(pSilencer 2.1)转染、干扰质粒siR-ARL2(pSilencer/ARL2-shRNA)转染。转染前1 d 1×106/ml传代HeLa细胞、2×106/ml传代C33A细胞,待细胞生长至60%~80%时,以转染细胞。
1.2.2实时荧光定量PCR技术检测ARL2 mRNA的表达 采用TRIzol试剂(日本TaKaRa公司产品)从15对宫颈癌组织和正常组织标本中提取总RNA,所有操作按说明书在去RNA酶的条件下进行,分光光度法测定RNA浓度;采用M-MLV逆转录酶(Promega, Madison, WI) 逆转录合成cDNA。以β-actin基因作为内参照,按照说明书于Bio-Rad Real-time PCR 仪上检测ARL2 mRNA的表达水平;分别用不同引物进行实时定量PCR反应,所用引物全由北京赛维生物技术有限公司化学合成。实时荧光PCR反应的循环参数为:① 预变性,94 ℃、3 min,② 变性,94 ℃、30 s,③ 退火,56 ℃、30 s,④ 延伸,72 ℃、30 s,②~④步共40个循环。采用2-ΔΔCt方法计算ARL2与内参基因β-actin的表达水平。
1.2.3Western blot法检测ARL2、GAPDH蛋白表达 转染培养48 h后,裂解细胞,制备蛋白样品。总蛋白经过电泳分离,半湿电转移形成印迹后,先后将膜置于含对应一抗和二抗的5%脱脂奶粉中封闭2 h和避光缓速摇动作用1.5 h。漂洗3次,ECL显色,ARL2蛋白的相对含量采用ARL2目的蛋白与GAPDH内参蛋白积分光密度的比值进行表示。
1.2.4免疫组化方法检测ARL2蛋白的表达 5组宫颈癌组织和癌旁正常组织标本经甲醛固定、石蜡包埋处理后制成厚度为4 μm的切片;脱蜡,梯度乙醇水化并用PBS冲洗,抗原修复后再次采用PBS冲洗切片,DAB显色,苏木精复染后梯度乙醇脱水,透明后用中性树胶封片。结果判定:切片随机编号,双盲阅片。光学显微镜观察,阳性着色呈棕黄色,根据不同抗原的细胞定位,其棕黄色位于细胞不同的位置。
1.2.5MTT检测细胞生长活性 以每孔6 000个(C33A细胞每孔11 000个)将转染36 h的HeLa细胞接种至96孔板,每组5孔,共3个孔板。每24 h随机选择一组,利用MTT法,在570 nm波长处测各接种孔的吸光度值(A570)。
1.2.6集落形成能力检测 转染后48 h,将HeLa细胞以每孔150个(C33A以每孔300个)接种在12孔板上,每组接种3个复孔。孵箱中培养10~12 d,集落形成标准:细胞数≥50个,培养结束条件:集落之间发生互相融合,甲醇固定细胞,室温染色,冲洗后观察。
1.2.7体外侵袭检测 选用孔径为8 μm的24孔Transwell小室,Matrigel凝胶用无血清PRMI 1640稀释成为2 mg/ml,包被Transwell小室的上室部,在滤膜上表面加入40 μl,培养形成胶状。取5×104个转染后的HeLa细胞(1.5×105个转染后的C33A细胞)置于1.5 ml EP管中,2 000 r/min离心5 min,并以200 μl RPMI 1640培养液重悬细胞后加入Transwell小室中的上室,并将600 μl的胎牛血清培养液加入到下室。37 ℃、5%CO2条件下培养24 h,将未穿过滤膜的肿瘤细胞去除,甲醇中固定1 min,染色后揭下滤膜,采用封片剂将其封于载玻片上,使用显微镜统计穿过小室底膜的细胞数量,方法如下:每室随机选取5个视野并拍照计数穿过小室底膜的细胞,计算得出平均值。重复实验3次。
1.2.8划痕实验 选取24孔板,每个孔内接种HeLa细胞数约为6×104个,转染后培养24 h,用移液枪头贴着直尺,垂直于板底呈一字型划痕,分别在划痕后的0、24、48 h显微镜下测量划痕的宽度。重复实验3次。

2 结果
2.1 ARL2在人体宫颈癌组织和癌旁组织中的差异性表达实时定量PCR结果显示,在15对宫颈癌组织中,ARL2表达水平与癌旁正常组织比较升高了3.2倍(P<0.05),见图1。
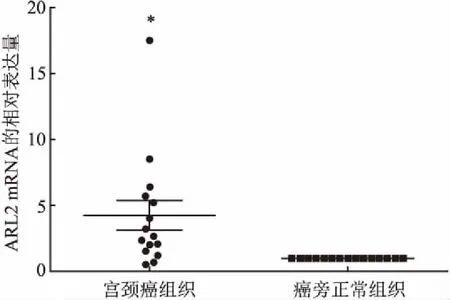
图1 ARL2 mRNA在15对宫颈癌和癌旁组织中的差异性表达与癌旁正常组织比较:*P<0.05
2.2 免疫组化方法检测结果ARL2在5组宫颈癌组织中表达阳性(阳性率为83.3%),癌旁正常组织中均为阴性,表明ARL2在宫颈癌组织中的表达水平明显高于癌旁正常组织,见图2。
2.3 Western blot法检测ARL2蛋白的表达由图3可以看出,与转染siR-Ctrl组比较,RNA干扰48 h后siR-ARL2组有较明显的降低,siR-ARL2组中蛋白表达水平在HeLa细胞中下降了约59%[(1.00±0.07)vs(0.41±0.06)],在C33A细胞中下降了60%[(1.00±0.11)vs(0.40±0.05)],差异有统计学意义(t=5.6、5.3,P<0.05)。提示RNA干扰ARL2后,其在宫颈癌细胞中表达明显下降,证明干扰质粒是能有效抑制宫颈癌细胞中ARL2基因的表达的。
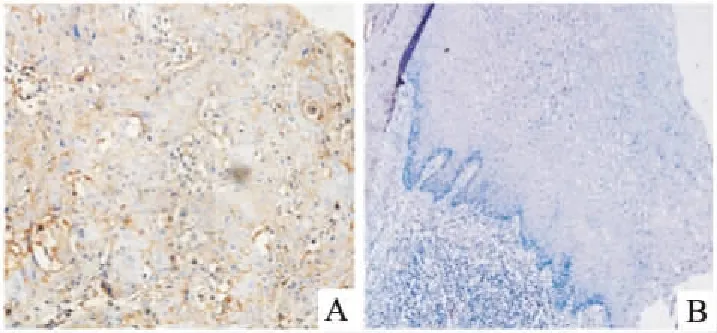
图2 ARL2在宫颈癌组织和癌旁 组织中的表达差异 DAB染色×100 A:宫颈癌组织;B:癌旁组织
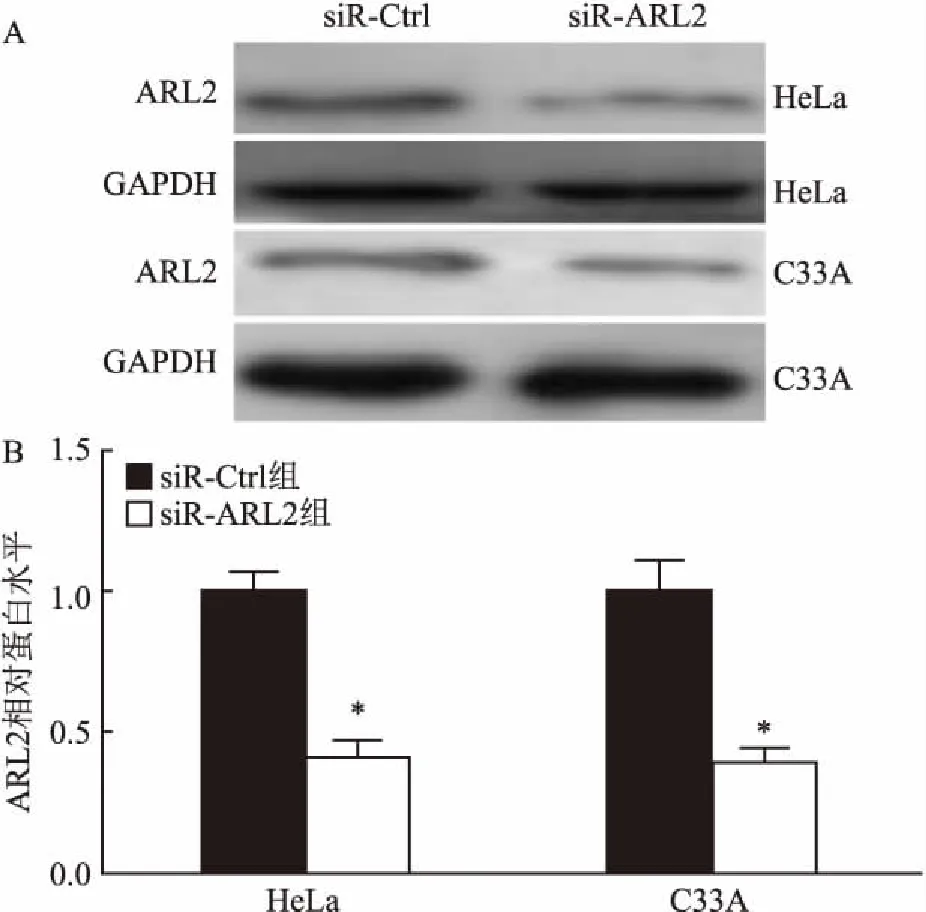
图3 Western blot法检测siR-ARL2质粒的有效性
A:瞬转siR-ARL2质粒及其对照后ARL2蛋白表达水平代表图;B:定量分析图;与siR-Ctrl组比较:*P<0.05
2.4 RNA干扰后细胞生长活性的变化从MTT实验结果可以看出,与对照组比较,转入siR-ARL2及其对照后,细胞的生长活性有明显的减弱,如图4所示,HeLa细胞下降了约28%[(1.00±0.05)vs(0.72±0.04)],C33A细胞中下降了约22%[(1.00±0.06)vs(0.78±0.04)],差异有统计学意义(t=2.6、2.3,P<0.05)。提示RNA干扰ARL2基因后减弱了宫颈癌细胞的生长活性。
2.5 RNA干扰后宫颈癌细胞集落形成能力的变化在HeLa细胞和C33A细胞中转染siR-ARL2及siR-Ctrl后分别进行集落形成实验,如图5所示,与转染siR-Ctrl的对照组比较,转染siR-ARL2组的细胞集落形成率明显下降,HeLa细胞下降了约36%[(66.00±0.73)vs(42.33±0.21),t=4.7,P<0.05],C33A细胞中下降了约60%[(35.60±0.39)vs(14.30±0.31),t=6.2,P<0.05],说明siR-ARL2抑制宫颈癌细胞的集落形成能力。

图4 MTT实验分析siR-ARL2对宫颈癌生长活性的影响与siR-Ctrl组比较:*P<0.05
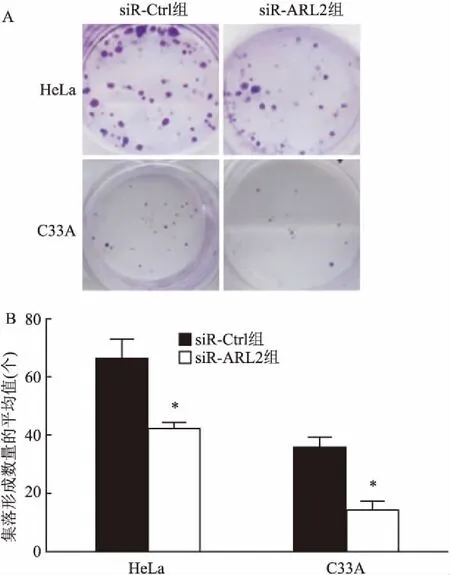
图5 集落形成实验分析siR-ARL2对宫颈癌集落形成的影响
A:各组细胞集落形成结晶紫染色代表图;B:结晶紫染色后集落计数的定量分析;与siR-Ctrl组比较:*P<0.05
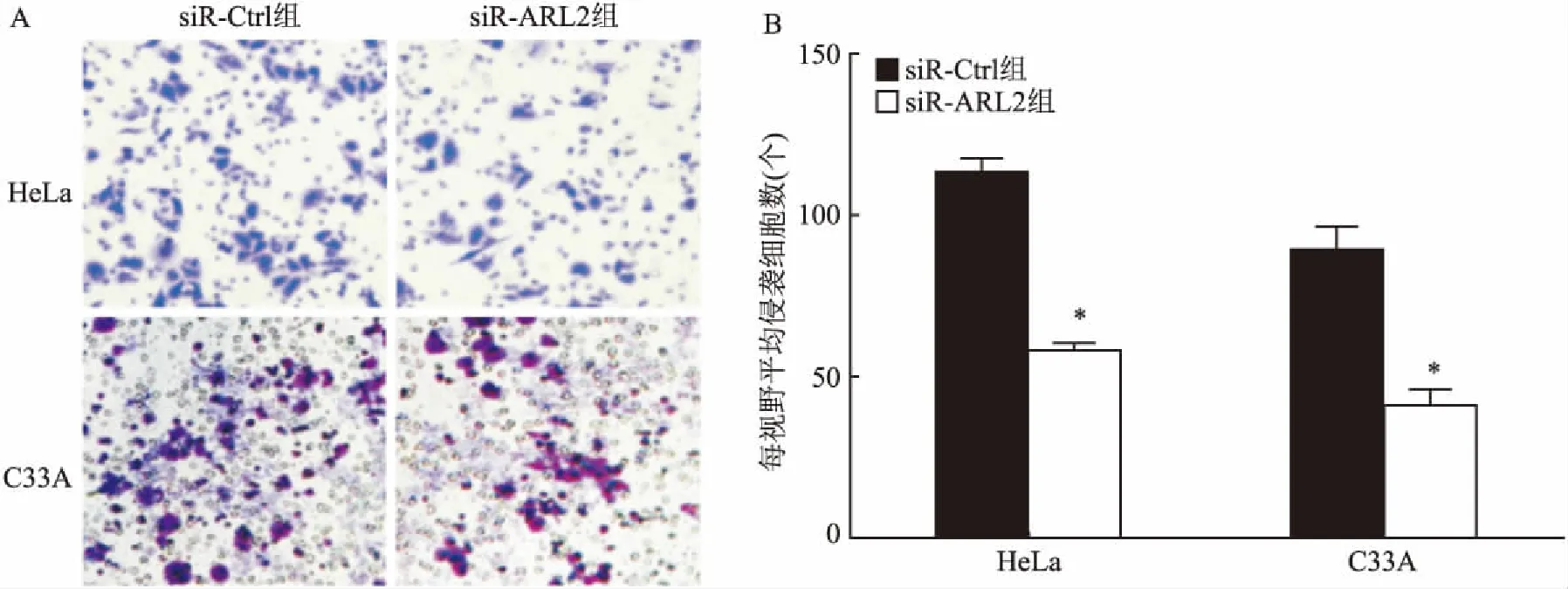
图6 Transwell侵袭实验检测siR-ARL2对宫颈癌细胞侵袭能力的影响A:显微镜下侵袭实验每组的代表图×400;B:显微镜下每个视野平均侵袭细胞数的定量分析;与siR-Ctrl组比较:*P<0.05

图7 HeLa细胞在转染不同的质粒下迁移的距离图A:显微镜下细胞划痕实验每组不同时间的代表图;B:划痕宽度的相对定量分析;与siR-Ctrl组比较:*P<0.05
2.6 干扰ARL2后宫颈癌细胞侵袭能力分析分别在HeLa细胞和C33A细胞中转染siR-Ctrl及siR-ARL2后进行Transwell侵袭实验,结果与对照组比较,实验组中宫颈癌细胞的侵袭能力受到了非常大的抑制,HeLa细胞下降了约49%[(113.00±3.83)vs(58.00±2.41),t=5.2,P<0.05],C33A细胞中下降了约54%[(89.00±4.50)vs(41.00±1.92),t=5.7,P<0.05],说明siR-ARL2能够抑制宫颈癌的侵袭。见图6。
2.7 siR-ARL2后宫颈癌细胞迁移能力的变化RNA干扰后的细胞划痕实验显示,HeLa细胞转染干扰质粒细胞划痕后24 h及48 h迁移的距离明显大于转染对照组迁移的距离(F=19.75,P<0.05)。提示RNA干扰ARL2后HeLa细胞的迁移能力降低。见图7。
3 讨论
宫颈癌居妇科恶性肿瘤病死率前列,尽管早期宫颈癌预后较好,但是仍有许多患者死于宫颈癌的转移和复发[5]。全世界每年约有500 000新发宫颈癌病例,超过1/3的患者死亡[6]。近年来,尽管宫颈癌手术治疗的效果逐渐得到改善,但癌细胞的侵袭和转移严重影响了相关治疗的效果,在分子水平上寻找肿瘤靶向治疗已逐渐被临床实践所认识。
ARL2是一种GTP酶,它能快速结合GTP或GDP分子,不依赖于脂类[7],当与GTP或GDP结合时,ARL2在不同条件扮演不同的角色。ARL2以ARL2-GDP 的形式结合微管蛋白辅助因子D(tubulincofactor D,TBCD)并调节微管动力学[8]。ARL2-GTP与ARL2结合因子(BART)形成线粒体复合体[9],维持线粒体形态、运动、ATP水平和线粒体融合。
Long et al[10]通过荧光素酶报告证实在结肠癌中,miR-214通过与ARL2 3′UTRs结合调控ARL2表达,Western blot和qRT-PCR也证实miR-214抑制ARL2的蛋白和mRNA表达,与ARL2 siRNA作用相似,这些结果表明miR-214通过ARL2的3′UTRs直接负调控ARL2,抑制结肠癌细胞的生长和转移,进而促进癌细胞死亡。在胰腺癌细胞中,ARL2-GTP通过诱导肌动蛋白-细胞骨架重排从而抑制Ras同源物基因家族成员A(Ras homolog family member A,RhoA)的活性,促进胰腺癌细胞侵袭。而BART可与ARL2-GTP结合,抑制ARL2的功能,减少肌动蛋白细胞骨架的重排,增加胰腺癌细胞中活性RhoA的含量,进而抑制肿瘤细胞的侵袭性[11]。在乳腺癌细胞中,高表达ARL2 的乳腺癌细胞中蛋白磷酸酶PP2A催化亚单位(PP2Ac)含量显著增加,低表达ARL2乳腺癌细胞中PP2Ac含量显著降低,与对照组比较,两组细胞中PP2Ac基因水平无显著性差异[12]。本文通过siRNA诱导的RNA干扰显著抑制了ARL2基因的表达,降低了宫颈癌细胞的生长、侵袭以及迁移能力,逆转了宫颈癌细胞的恶性表型,尽管其内在的具体分子机制尚不明确,但是为宫颈癌的基因诊断以及后期的基因治疗提供了新的思路和方法。

