bpV(pic)对血管性痴呆模型大鼠行为学及海马p-PKB(Ser473)表达的影响
袁美春,李海霞,张志锋
血管性痴呆(vascular dementia,VD)是一种多由脑血管病引发的获得性认知功能障碍疾病。该疾病发病率高,较难治愈,社会危害性大,主要病理学改变为神经元凋亡、坏死脱失等,尤其是与学习、记忆功能相关的海马神经元受到损伤后会引起认知功能障碍[1-2]。过氧钒化合物[双过氧二钾(吡啶-2-羧基)氧代钒酸盐,dipotassium bisperoxo(pyridine-2-carboxyl)oxovanadate,bpV(pic)]是一种钒氧化合物,同时也是一种常见的人第10号染色体缺失性磷酸酶(phosphate and tension homology deleted on chromosome ten,PTEN)抑制剂[3],可通过抑制PTEN磷酸酶活性提高蛋白激酶B (protein kinase B,PKB)的活性[4-5]。有报道[6]表明,通过抑制PTEN可发挥一定的神经保护作用。该文将探讨bpV(pic)对VD模型大鼠在Morris水迷宫(morris water maze,MWM)行为学、神经元病理形态学及神经元细胞内天冬氨酸特异性半胱氨酸蛋白酶3剪切体(cleaved-cysteine-aspartic proteases, cleaved-caspase-3)和第473位丝氨酸磷酸化PKB[p-PKB(Ser473)]水平的影响及机制。
1 材料与方法
1.1 实验动物SPF级SD 雄性大鼠36只,体质量为250~300 g,温度为23 ℃~25 ℃,湿度为60%~80%,由湖北医药学院动物实验中心提供。
1.2 主要试剂bpV(pic)购自美国Sigma-Aldrich公司;caspase-3、α-tubulin、p-PKB (Ser473)和t-PKB一抗抗体购自美国Santa Cruz公司。
1.3 主要方法
1.3.1动物实验分组及VD模型制备 动物分组:将36只成熟雄性SD大鼠随机分成4组:Sham组、Sham+bpV(pic)组、VD 组、VD+bpV(pic)组。
模型制备:VD组和VD+bpV(pic)组动物采用改良的双侧颈总动脉结扎法来复制VD损伤模型。术前动物要禁食12 h,不禁水,用含70%N2O和30%O2的4%异氟烷麻醉SD大鼠,然后将动物仰卧位固定于手术板上,颈部剪毛备皮、消毒、颈部开口分离寻找左侧颈总动脉,结扎左颈总动脉,缝合各层组织并喷注适量青霉素注射液,保温护理动物。术后1周行右侧颈总动脉结扎,方法如前。Sham组和Sham+bpV(pic)组仅分离颈总动脉,不结扎。
右侧颈总动脉结扎术后第2天Sham+bpV(pic)组和VD+bpV(pic)组动物予以连续21 d灌胃bpV(pic) (1 mg/kg,每天1次,每次10 ml),其他两组同时等量同法注射无菌生理盐水。然后进行MWM检测实验,包括连续5 d的定位航行实验和第6天的空间探索实验。行为学检测完毕后,立即麻醉动物,灌注取脑,分别进行后续的HE染色和Western blot 检测实验。
1.3.2MWM 动物经相关药物处理21 d后,行MWM行为学检测实验。该实验用于检测评估动物的空间学习记忆能力。该装置由一圆柱形不锈钢水池、一个可移动平台和一套图像采集及处理系统组成。水池直径150 cm,高70 cm;平台直径14 cm,高30 cm,实验时水面高度要高于此平台1 cm。
实验包括定位航行实验和空间探索实验。定位航行实验要连续进行5 d,该实验用大鼠在水中找到平台的逃避潜伏期长短来检测其学习能力。每次定位航行的时间设定最多为120 s,若在规定时间120 s内未找到平台,则可诱导至平台上停留15 s。空间探索实验(取走平台后)则用动物在规定时间120 s内处在原平台所在区域象限内的时间与总时间之比来测试大鼠记忆能力。
1.3.3HE染色 动物脑组织经生理盐水灌注取材后,用刀片切取约5 mm厚的海马组织,用预先配好的10%福尔马林固定。将组织放入包埋盒中用流水冲洗约30 min,从低浓度到高浓度用不同浓度的乙醇溶液对组织进行脱水,经二甲苯透明处理,用石蜡包埋组织,将包埋好的蜡块组织固定于切片机上进行切片,厚度为6 μm,然后经45 ℃恒温烘烤至干燥。切片烘干后经二甲苯脱蜡,从高浓度到低浓度乙醇溶液至水处理,最后用苏木精染色液进行染色处理。染色完毕后,再经无水乙醇脱水和二甲苯树胶封片,烤干冷却后可在病理切片显微镜上观察拍照。
1.3.4蛋白提取及Western blot 收集各组动物脑组织加RIPA裂解液冰上裂解15 min;于4 ℃、12 000 r/min离心15 min,取上清液;加5×sample buffer,于100 ℃煮10 min;冷却后用BCA法测所提各组蛋白液浓度。经SDS-PAGE电泳,用PVDF膜转膜90 min,用5%脱脂奶粉封闭1 h,孵一抗(caspase-3、α-tubulin、p-PKB、t-PKB,1 ∶500),4 ℃ 过夜,二抗室温孵育2 h,用ECL 发光试剂盒显影检测蛋白。

2 结果
2.1 定位航行实验检测bpV(pic)对VD模型动物空间学习能力的影响第1天实验,4组动物寻找平台的时间差异无统计学意义(P>0.05)。与Sham组比较,Sham+bpV(pic)组动物寻找平台的潜伏期时间差异无统计学意义(P>0.05),VD组和VD+bpV(pic)组寻找平台的时间延长(F=33.2,P<0.05)。若与VD组比较,VD+bpV(pic)组动物寻找平台的时间差异无统计学意义(P>0.05)。第3~5天的实验,与Sham组比较,Sham+bpV(pic)组动物寻找平台的潜伏期时间无统计学差异(P>0.05),而VD组和VD+bpV(pic)组动物寻找平台的时间提高(P<0.05)。若与VD组比较,VD+bpV(pic)组动物寻找平台的时间缩短(P<0.05)。见图1。
2.2 空间探索实验检测bpV(pic)对VD模型动物空间记忆能力的影响Sham组和Sham+bpV(pic)组动物在规定时间内处于目标区域现象的时间比例差异无统计学意义(P>0.05)。而VD组和VD+bpV(pic)组动物在目标现象的时间比例减少,两者分别与Sham组比较,差异均有统计学意义(F=51.04,P<0.05)。若VD+bpV(pic)组与VD组比较,VD+bpV(pic)组动物在目标现象的时间比例增加,差异有统计学意义(F=51.04,P<0.05)。见图2。
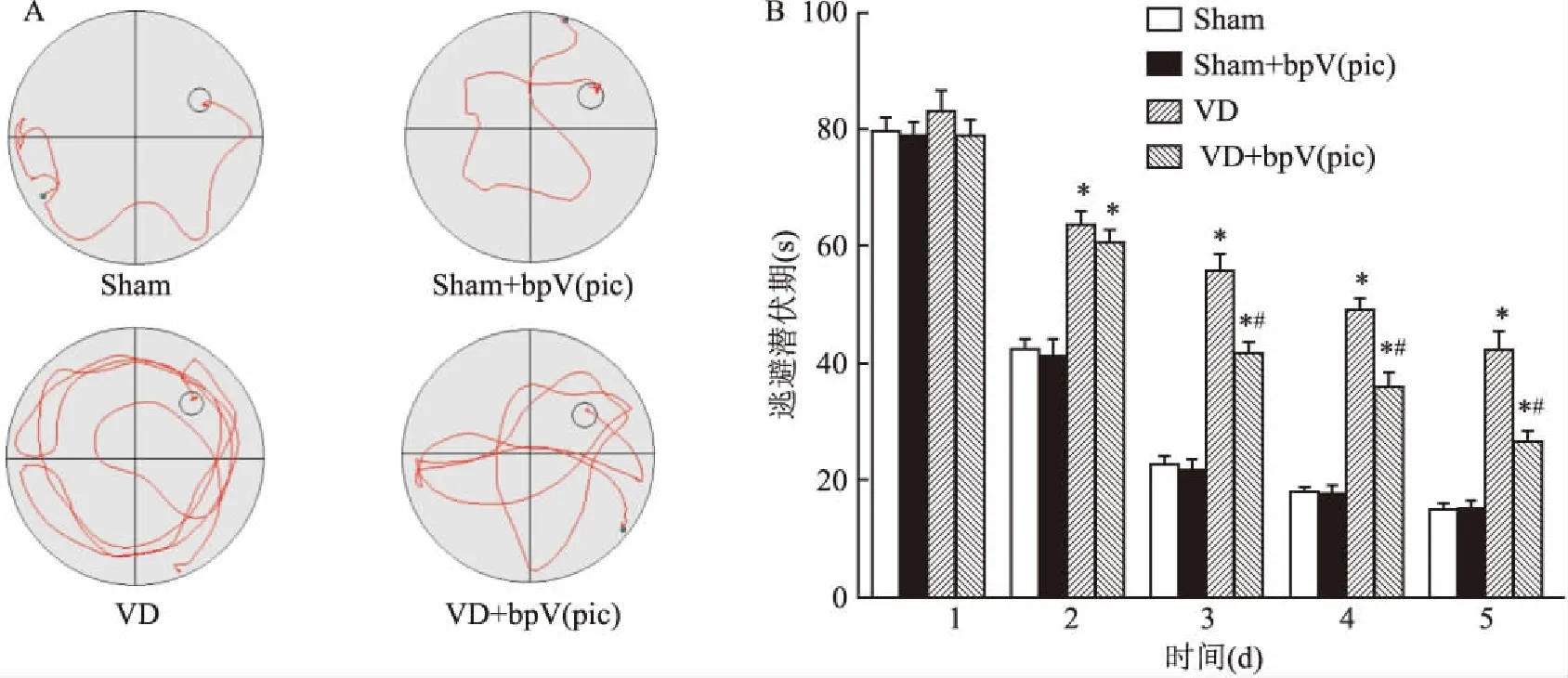
图1 大鼠Morris水迷宫定位航行实验(n=9)
A:各组大鼠Morris水迷宫定位航行轨迹图;B:各组大鼠Morris水迷宫定位航行逃避潜伏期的比较;与Sham组比较:*P<0.05;与VD组比较:#P<0.05
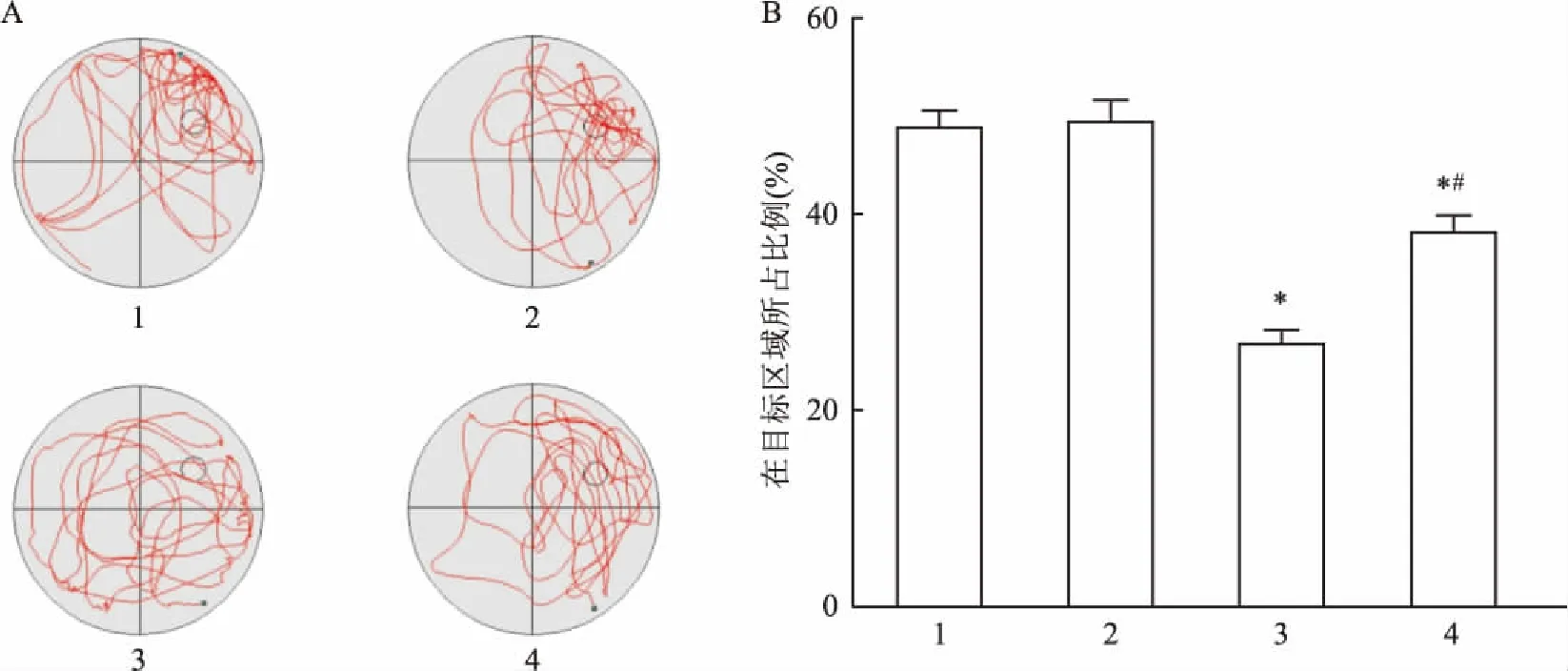
图2 Morris水迷宫空间探索实验(n=9)
A:各组大鼠Morris水迷宫中空间探索轨迹图;B:各组大鼠Morris水迷宫中在目标区域所占比例的比较;1: Sham组;2:Sham+bpV(pic)组;3: VD模型损伤组;4: VD+bpV(pic)组;与Sham组比较:*P<0.05;与VD组比较:#P<0.05
2.3 HE染色检测bpV(pic)对VD模型大鼠海马神经元形态学的影响Sham组和Sham+bpV(pic)组神经元细胞染色均匀、分界清晰,整体结构层次完整整齐。VD组神经元胞体肿胀,胞质深染,细胞核皱缩,细胞排列紊乱,整体不够整齐。与VD模型组比较,VD+bpV(pic)组神经元的病理形态学改变明显减轻,虽然小部分细胞有深染和皱缩,但基本接近Sham组状态。 见图3。
2.4 Western blot检测bpV(pic)对VD模型动物海马组织cleaved-caspase-3水平的影响与Sham组比较,Sham+bpV(pic)组神经元cleaved-caspase-3表达水平差异无统计学意义(P>0.05);而VD组和VD+bpV(pic)组神经元内的cleaved-caspase-3水平均升高(F=26.56,P<0.05);但与VD组比较,VD+bpV(pic)组神经元内cleaved-caspase-3的表达水平降低(F=26.56,P<0.05)。见图4。
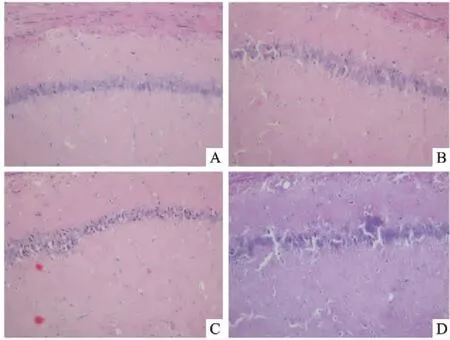
图3 大鼠CA1区海马神经元病理形态学变化 HE×200 A:Sham组;B:Sham+bpV(pic)组;C:VD组;D:VD+bpV(pic)组
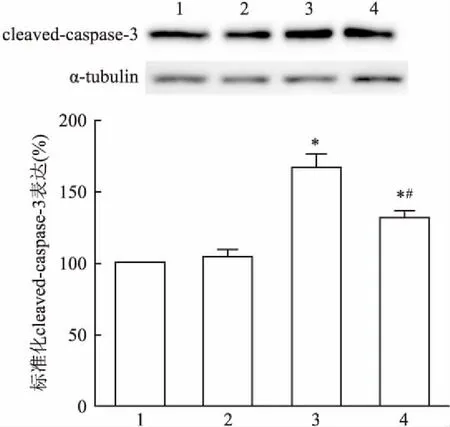
图4 Western blot 检测各组大鼠海马神经元cleaved-caspase-3表达(n=9)
1: Sham组;2:Sham+bpV(pic)组;3:VD模型损伤组;4:VD+bpV(pic)组;与Sham组比较:*P<0.05;与VD组比较:#P<0.05
2.5 Western blot检测bpV(pic)对VD模型动物海马组织p-PKB(Ser473)水平的影响与Sham组比较,Sham+bpV(pic)组神经元内p-PKB(Ser473)水平差异无统计学意义(P>0.05),而VD组和VD+bpV(pic)组神经元内的p-PKB(Ser473)水平均降低(F=51.02,P<0.05);与VD组相比,VD+bpV(pic)组神经元内p-PKB(Ser473)的表达水平则升高(F=51.02,P<0.05)。见图5。
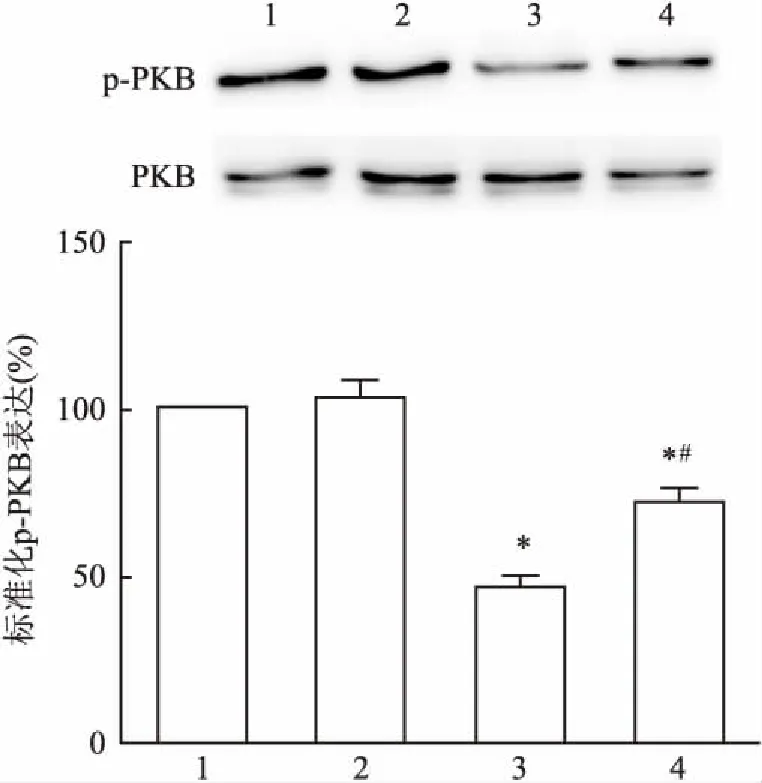
图5 Western blot 检测各组大鼠海马神经元p-PKB(Ser473)表达(n=5)
1:Sham组;2:Sham+bpV(pic)组;3: VD模型损伤组;4: VD+bpV(pic)组;与Sham组比较:*P<0.05;与VD组比较:#P<0.05
3 讨论
PTEN是一种以蛋白质和脂质为底物的双向磷酸酶,其可将磷脂酰肌醇3磷酸(phosphatidylinositol 3 phosphate,PIP3)去磷酸化为PIP2发挥脂质磷酸酶活性[7-8],而PIP2生成增多阻碍磷脂酰肌醇-3激酶 (phosphatidylinositol 3-kinase,PI3K) /PKB信号通路引起的促进细胞生长、代谢、迁移、分化及存活[8]。同时,本课题组前期研究[4-6,9]显示PTEN抑制对缺血性脑损伤具有一定保护作用。但PTEN抑制对VD模型动物的作用尚无报道,故本研究以VD模型大鼠为实验对象,探讨PTEN抑制剂bpV(pic)对模型动物在空间学习记忆能力、海马神经元病理形态学及海马神经元caspase-3凋亡蛋白和p-PKB(Ser473)水平的影响及初步作用机制。
本研究结果显示,在MWM的定位航行实验中,前2 d VD组和VD+bpV(pic)组间逃避潜伏期差异无统计学意义,第3天开始bpV(pic)可缩短VD模型动物寻找平台的逃逸潜伏期,表明bpV(pic)可提高模型动物的空间学习能力。在MWM的空间探索实验中,bpV(pic)可提高模型动物在目标区域象限的时间比例,表明bpV(pic)可提高模型动物的空间记忆能力。HE染色结果也表明bpV(pic)可减轻VD模型大鼠病理形态学损伤。以上结果表明,bpV(pic)对VD模型大鼠具有一定的保护作用。
VD主要病理学改变为海马神经元凋亡及坏死[1-2]。caspase-3是细胞凋亡过程中最主要的一种终末剪切酶,当细胞凋亡启动时,caspase-3可通过将多聚(ADP-核糖)聚合酶剪切成无功能状态,从而反向激活Ca2+/Mg2+依赖的核酸内切酶活性,导致核小体间DNA裂解,最终引起细胞凋亡[10-11]。所以本研究用Western blot检测动物海马神经元内cleaved-caspase-3的水平,结果显示bpV(pic)可降低VD动物海马神经元内cleaved-caspase-3水平,表明bpV(pic)可缓解VD模型大鼠的海马神经元凋亡。
PKB是一种丝/苏氨酸激酶。PKB磷酸化被激活后可参与人体多种生理生化过程[12-13]。首先,PKB是一种重要的促活因子,其可通过减少线粒体细胞色素C释放和阻断Fas依赖性的凋亡途径来抵抗细胞凋亡。另外,PKB还可失活一些如Bcl-2细胞死亡激动剂、Caspase-9促凋亡因子和间接激活B细胞淋巴瘤因子2( B-cell lymphoma factor 2, Bcl-2)发挥抗凋亡作用[14-15]。因此,提高PKB活性可能会降低神经元的凋亡率。本研究用Western blot检测动物海马神经元内p-PKB(Ser473)的水平,结果显示,bpV(pic)可提高VD动物海马神经元p-PKB(Ser473)水平,表明bpV(pic)可提高VD模型大鼠海马神经元PKB活性。由此可见,bpV(pic)降低动物海马神经元caspase-3可能与PKB激活[即p-PKB(Ser473)水平升高]有关,但其确切证据及详细机制有待进一步研究。

