电泳沉积纳米二氧化钛陶瓷涂层结构表征与性能研究*
康 浩 潘文平
(桂林市荔浦师范学校 广西 桂林 546600)
前言
对于带有电荷的胶体粒子,如若在外加电场作用下可向特定的电极定向移动,如果用导电基底材料作为与胶粒所带电荷相反的电极,便可利用胶粒的电动性质使纳米尺寸的胶体粒子电沉积在基底材料表面,前人用电泳方法进行了二氧化钛薄膜的制备尝试,虽然发现所制薄膜中的二氧化钛粒子较大,附着力不够强,而且与相同负载量的喷涂膜相比,这种电泳膜的光催化性能并没有显示出明显的优越性,但证实可快速实现二氧化钛在基底上大量均匀的负载,这一点具有较强的实用性。如果针对影响薄膜质量的各种可能的因素开展深入研究,有望开发出一种实用薄膜负载化技术。
由此可见,本课题试验研究设计从选择较好分散介质入手,着重比较备选分散介质配置出的同浓度(20 g/L)二氧化钛悬浮液的电导率及其悬浮性差异,并绘制相关时间段内的各悬浮液沉降曲线来表征Zeta电势大小即悬浮性好坏;利用选择出的分散介质配制二氧化钛悬浮液并调节pH值为0.9、1.5、4.6、5.2、8.5,保持浓度为20 g/L,沉积电压为100 V,分别进行电泳试验,考察pH对膜性能的影响;依此种控制变量法的方法逐步考察电泳时间、悬浮液浓度、沉积电压等工艺参量对电泳膜性能的影响规律,最终得出电泳膜性能较好的工艺参数;在单纯研究电泳工艺时,本试验还设想添加助剂PEG400,通过控制添加的浓度考察其对膜性能的影响,以提高工艺质量。对于光催化性本试验通过在不同烧结温度下分析二氧化钛晶型的转变(以XRD为表征手段)定性探讨了获得较高光催化活性时的烧结温度。
1 实验部分
1.1 实验所用原材料及仪器
本实验使用的化学药品有:纳米二氧化钛粉末、去离子水、无水乙醇(分析纯)、乙二醇(分析纯)、丙酮(分析纯)、冰乙酸(分析纯)、PEG400(化学纯)。
实验器材包括:50 mL烧杯若干、胶头滴管若干、精密pH值试纸、铜片、电子天平、DDS-11D型数显电导率测定仪、EPS 100核酸电泳仪、BW-GWL182高温烧炉、LD1-Y-2000型X射线衍射仪、XTL-IA(B)连续变倍体视显微镜。
1.2 实验方法
1.2.1 电导率测定
纯介质电导率测定:根据电导率仪原理,电导率是以数字表示溶液传导电流的能力。水的电导率与其所含无机酸、碱、盐的量有一定的关系,当它们的浓度较低时,电导率随着浓度的增大而增加;因此,该指标常用于推测水中离子的总浓度或含盐量。电导(G)是电阻(R)的倒数。当两个电极(通常为铂电极或铂黑电极)插入溶液中,可以测出两电极间的电阻R。根据欧姆定律,温度一定时,这个电阻值与电极间距L(cm)正比,与电极的截面积A(cm2)反比,即
R=ρ×(L/A)
其中ρ为电阻率,是长1 cm,截面积为1 cm2导体的电阻,其大小决定于物质的本性。据上式,导体的电导(G)可表示成下式:
G=1/R=(1/ρ)×(A/L)=K×(1/J)
其中,K=1/ρ称为电导率,J =L/A称为电极常数;电解质溶液电导率指相距1 cm的两平行电极间充以1 cm3溶液时所具有的电导。由上式可见,当已知电极常数(J),并测出溶液电阻(R)或电导(G)时,即可求出电导率。
首先选为校正档后,用去离子水清洗铂电极2次,插入水中校正DDS-11D型数显电导率测定仪显示值为介电常数;其次估计待测试剂的数值大小调节量程,调节温度为实际室温后,插入各纯介质试剂中待读数稳定后记录数值,测定完后再次用去离子水清洗铂电极,重复校正,重复测定。
20 g/L各悬浮液电导率测定:在150 mL烧杯中加入140 mL纯介质,称量2.8 g纳米二氧化钛粉末,配制20 g/L的各分散介质悬浮液,搅拌30 s,插入电极测定,清洗电极校正完毕后,重复测定。
20 g/L各澄清液电导率测定:将上述悬浮液静置24 h待分散体系沉降稳定后,测定其上层澄清液的电导率。
1.2.2 各分散介质配制20 g/L的二氧化钛悬浮液沉降百分比测定
称量烧杯质量和试样质量;经单位时间段(12 h)静置后测定干燥质量:100 mL烧杯中加入1 g二氧化钛粉末及50 mL分散剂,搅拌均匀后静置一定时间,第一组时间为12 h,以后每一组时间间隔递增12 h,到点后用吸液管缓慢吸出上层液,此过程中搅动不能太大以免使沉降层扰动,造成沉降百分比误差偏大。待吸尽后放入干燥箱中(恒温80 ℃)干燥直至完全干燥,最后称重;进行单位时间段(12 h)静置沉降百分比计算。
1.2.3 不同pH值下电泳沉积量测定
电泳仪工作原理:带电粒子在直流电场作用下于一定介质中所发生的定向运动,利用这一现象对化学或生物化学组分进行分离分析的技术称之为电泳。生物学上的重要物质如蛋白质、核酸等,在溶液中能吸收或给出氢离子从而带电。因此,它们在电场影响下,在不同介质中的运动速度是不同的。这样用电泳的方法就可以对其进行定量分析,或者将一定混合物分离成各个组分以及作少量制备。
铜片质量测定(1.7103g):事先用1∶5的浓硝酸清洁表面,清水漂洗后晾干称重。
电泳干燥后总质量测定:预热EPS 100核酸电泳仪10 min,配制10 g/L、20 g/L、30 g/L各分散剂悬浮液,用冰醋酸逐滴滴加调节各组试验所需pH值,就绪后插入石墨电极和铜片,保持3 cm间距,设定电泳时间和电压,待电泳结束后取出铜片,晾干称重,各组重复操作,记录称其质量。
1.2.4 不同悬浮液浓度下电泳沉积量测定
电泳干燥后总质量测定:采用1.5的pH值,控制电压选取为90 V、100 V、110 V,电泳时间为5 min,浓度选取为10 g/L、20 g/L、30 g/L、40 g/L,操作电泳仪重复上述实验步骤。
1.2.5 不同沉积电压下电泳沉积量测定
电泳干燥后总质量测定:在pH值为1.5,沉积时间为5 min的条件下,电压分别选取为80 V、90 V、100 V、110 V,浓度为10 g/L、20 g/L、30 g/L,重复上述实验步骤。
1.2.6 不同电泳时间下电泳沉积量测定
电泳干燥后总质量测定:维持沉积电压100 V,调节pH值为1.5,电泳时间各组调节为2 min、4 min、6 min、8 min、10 min,浓度选为10 g/L、20 g/L、30 g/L,重复上述实验步骤。
1.2.7 不同烧结温度对晶型影响
不同温度处理的粉体产生相变,利用XRD得到的衍射图谱进行物相定性分析,根据所含晶体的衍射角,经布拉格方程求得晶面间距,再估计出各衍射线的相对强度,最后与标准衍射花样经行比较鉴定其所含晶型。
2 实验结果与讨论
2.1 分散剂的选择及电导率测定
2.1.1 分散剂的选择
对于纳米氧化物粒子,如二氧化钛,根据其在溶液中pH值不同,可带正电、负电和中性[1]。当pH值较小时,粒子表面形成M-OH3+键,导致粒子表面带正电;当pH值较高时粒子表面形成M-O-键,使粒子表面带负电。在不同的pH值下分散剂中的粉体的表面化学特性就由吸附到颗粒表面的H+和OH-粒子所决定[2]。所吸附的带电粒子越多,其核电密度越大,Zeta电位绝对值亦越大,越有利于悬浮体系的分散稳定性。在浆料制备中,为获得高分散性及稳定性好的浆料,通常选用一些有机电解质来改善其悬浮性能[3]。据此,本试验选择的介质分别是:去离子水、无水乙醇、乙二醇、丙酮。
2.1.2 悬浮液配制及电导率测定
首先测定所选纯分散剂的电导率;其次在50 mL烧杯中分别配置浓度为20 g/L的不同分散介质二氧化钛悬浮液,测定其电导率后静置若干小时(约12 h),待悬浮颗粒充分沉降后测其上层澄清液电导率,所测数据如表1所示。
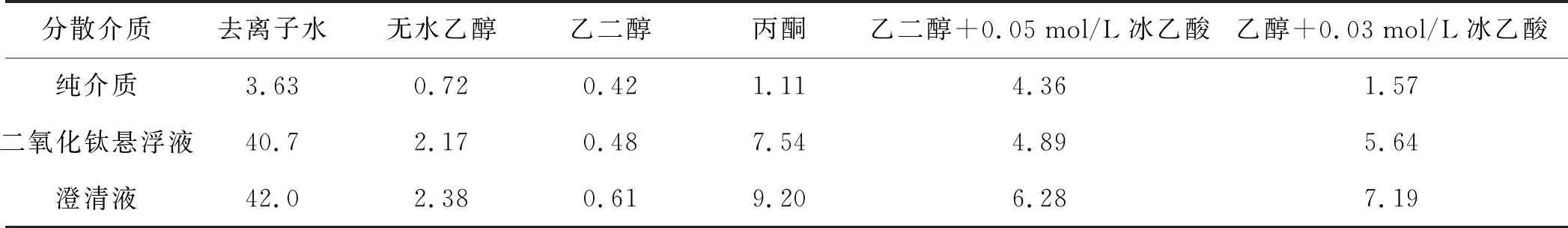
表1 纯介质、悬浮液及澄清液的电导率(μm/cm)

2.2 二氧化钛粉末在悬浮液中的分散性和稳定性
2.2.1 分散性
根据Deijaguin-Landau理论,悬浮液稳定性主要依靠聚结稳定性。聚结稳定性取决于固体粒子的静电排斥能与粒子间吸引能的相对大小,而静电吸引能决定于粒子半径和粒子间距,粒子排斥能则决定于粒子半径和ξ电势的平方[5]。去离子水是强极性分子,容易润湿非极性分子二氧化钛表面,使其分散。同时,水分子容易离解出一些H+和OH-,固体粉末粒子吸附这些离子而带上电荷,具有一定ξ电势,故悬浮性较好,丙酮的情况与此类似,而乙醇和乙二醇极性不强,不能很好地润湿二氧化钛表面,故荷电性差,团聚度大,分散性差。
2.2.2 悬浮稳定性
采用文献[6]的粉末沉降质量百分比方法对悬浮液的分散稳定性进行考察。称量50 mL烧杯质量和1 g试样,分别配置浓度为20 g/L不同分散剂的二氧化钛粉末的悬浮液,经不同时间的沉降后进行烘干处理,再次称量烧杯和试样质量,并计算出质量差,最后计算出沉降百分比,绘制沉降曲线。

图1 不同分散介质的悬浮液的沉降曲线
由图1可以看出,二氧化钛悬浮液在去离子水中分散稳定性最好,在丙酮中次之,在乙醇+0.03M冰醋酸和乙醇中很差。测量结果与上述分析的一致。但在后续的电泳试验过程中发现,如果采用去离子水作为分散剂,则所配制的悬浮液在电泳过程中,工作电极附近明显有大量气泡产生,所得到的电泳膜很粗糙且多孔,这很可能是电解水析氢造成的[7],故本试验采用分散稳定性次之的丙酮作为试验分散剂配制悬浮液进行后续电泳工艺的试验探讨。
2.3 pH值对电泳沉积的影响
为了考察悬浮液的pH值对电泳沉积的影响,试验保持悬浮液浓度为20 g/L,电泳沉积电压维持在100 V。在没有滴加冰醋酸时不管沉积电压高低、沉积时间长短均没有二氧化钛颗粒沉积,工作电流显示为零。向20 g/L的悬浮液中逐滴滴加冰醋酸,利用精密pH试纸测定pH值,分别为0.9、1.5、4.6、5.2、8.5;电泳时间选取为2 min、4 min、6 min、8 min,时间与沉积量曲线如图2所示。
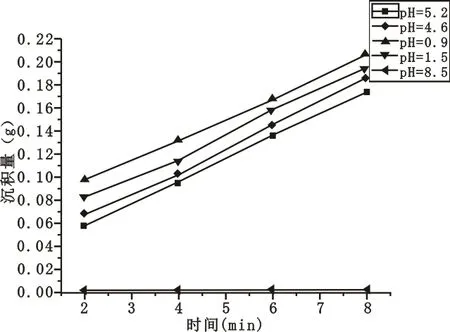
图2 不同pH值得到的二氧化钛沉积量曲线
从图2可以看出,在一定pH值下,二氧化钛沉积量均随时间的延长而增加。相同沉积时间下,随着pH值的减小沉积量会增大。当pH值为0.9时,工作电极附近有少量气泡产生,得到的膜层粗糙、多孔,这可能是析氢造成的[8]。在体视显微镜下观察沉积电压为100 V、时间5 min、浓度为20 g/L、pH值分别为0.9和1.5时的沉积膜表面可明显辨别,如图3和图4所示。

图3 pH值为0.9的沉积膜
向悬浮液中滴加少量冰醋酸时,悬浮液中H+的浓度增加,降低了悬浮液的pH值,同时也使悬浮液中的二氧化钛颗粒有更多可供吸附的H+。二氧化钛颗粒表面的活性点吸附悬浮液中的自由H+,自身变成带正电荷的粒子,在电场的作用下向阴极迁移,最终在铜片基体上放电沉积出来[9]。当悬浮液中没有自由H+或H+浓度很低时,即悬浮液pH值较高时,基本上得不到电泳沉积层。当悬浮液的pH值太低时,悬浮液中又有过多的自由H+,在阴极电泳沉积时又会发生严重的析氢现象[10]。

图4 pH值为1.5的沉积膜
2.4 悬浮液浓度对电泳沉积的影响
根据上述对pH值的讨论,为避免因pH值过低造成的析氢不良影响,后续试验采用1.5的pH值更为合理;控制电压为90 V、100 V、110 V,电泳时间为5 min,浓度为10 g/L、20 g/L、30 g/L、40 g/L,重复上述实验步骤,记录实验数据。二氧化钛沉积量与时间的关系图见图5。

图5 不同悬浮液浓度得到的二氧化钛沉积量曲线
由图5可见,在不同沉积电压下,悬浮液浓度越大,即悬浮液中含有更多的带正电的二氧化钛颗粒时,在外加电场作用下迁移到阴极附近的粒子数量也越多,沉积量越大,两者基本呈线性关系。在一定悬浮液浓度下,二氧化钛沉积量也随外加电压增大而增加。当电压为110 V时,得到的膜层表面比较粗糙且裂纹较多,这可能是电压过高易造成严重析氢的缘故[11]。见图6体视显微镜下所拍110 V得到的放大35倍膜层表面照片。
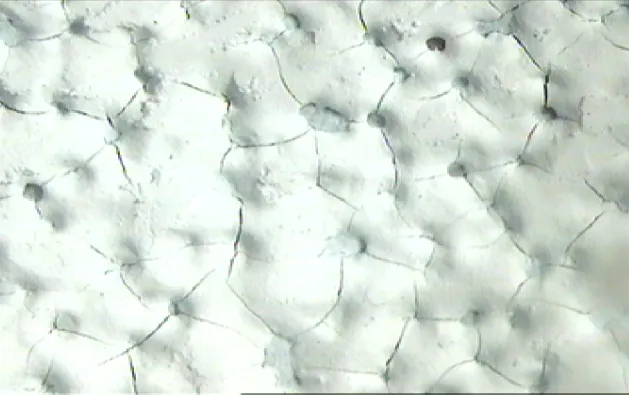
图6 U=110 V所得沉积膜在体视显微镜下表面放大35倍图像
2.5 沉积电压对电泳沉积的影响
在pH值为1.5,沉积时间为5 min的条件下,电压分别选取80 V、90 V、100 V、110 V,浓度分别选取10 g/L、20 g/L、30 g/L,重复上述实验步骤,记录实验数据。
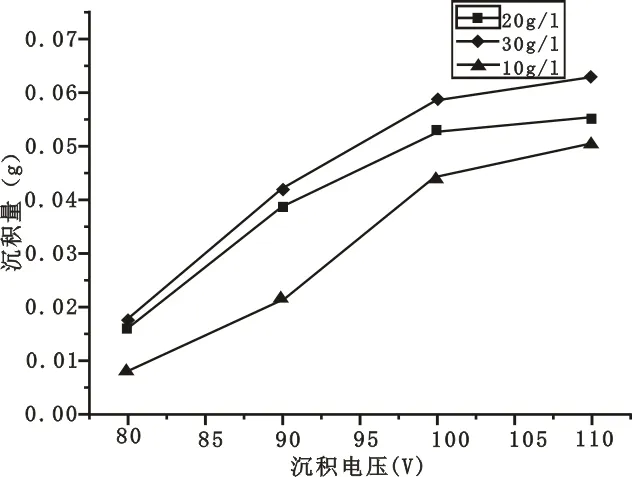
图7 不同沉积电压得到的二氧化钛沉积量曲线
由图7可见,在不同浓度的悬浮液中,二氧化钛沉积量都是随外加电压增大而增大,而且在相同沉积电压下,悬浮液浓度越大沉积量也越多。两电极之间的距离一定时,外加电压增大,也就意味着两电极之间的电场强度增强,则电场梯度增大,相当于产生了更大的驱动力,从而使悬浮液中更多的二氧化钛颗粒移向阴极,并在阴极表面放电沉积出来[12]。在电极两端电压为110 V时,工作电极表面也有少量气泡生成,并且得到的沉积层也呈多孔状,这也应该是由于阴极析氢造成的[13]。其体现如图8所示。

图8 U=110V所得沉积膜在体视显微镜下表面放大15倍图像
2.6 电泳时间对电泳沉积的影响
维持沉积电压为100 V,pH值为1.5,电泳时间设计为2 min、4 min、6 min、8 min、10 min,浓度为10 g/L、20 g/L、30 g/L,重复上述实验步骤,记录实验数据。
由此数据绘制不同电泳时间得到的二氧化钛沉积量与时间的关系曲线如图9所示。
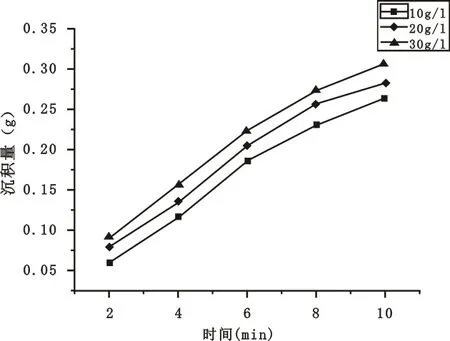
图9 不同电泳时间得到的二氧化钛沉积量曲线
由图9可见,在不同悬浮液浓度下得到的沉积量基本上都与时间呈线性关系,为求得沉积量与时间具体的函数关系,下面进行电泳沉积机理的探讨。
2.7 电泳沉积机理
关于电泳沉积的机理,Hamaker认为,在一定时间t(s)内,电泳沉积层的质量Y(kg)应该与悬浮液中粒子的电泳迁移率u(m2·V-1·s-1)、两电极之间的电场强度E(V/m)、悬浮液的浓度C(kg/m3)和工作电极的面积A(m2)成正比关系,因此得到了Hamaker方程式[14]:
(1)
由于在每次电泳沉积过程中都使两电极之间的电压U和距离d保持不变,而且得到的膜层厚度与电极距离相比几乎可以忽略,因此可以用两电极之间的电压除以两电极之间的距离来近似代替E,再将等式(1)右边的A移到左边,即得到单位面积膜层质量w(kg/m2)与各参数的关系为:
(2)
又由于C=C0m0/m,其中C,m分别表示t时悬浮液的浓度和悬浮液中粉末的质量,C0、m0分别表示初始悬浮液的浓度和悬浮液中粉末的质量。不难发现mt/m0近似为1,故有C=C0,因此公式(2)可以改写为:
(3)
可以看出图3和图4中的结果基本与公式(3)相一致。从图9可以看出,在不同悬浮液浓度下得到的沉积量基本上都与时间呈线性关系。从公式(3)也可以发现,右边各参数都是与时间无关的量,因此可以将公式(3)最终表示成为:
(4)
根据公式(4),图9中各曲线的斜率k=μC0U/d,因此有:
(5)
由图9中3条曲线线性拟合很容易得到他们的斜率,分别是1.668×10-5g/min·m2,1.740×10-5g/min·m2,1.758×10-5g/min·m2,由此可求出相应电泳迁移率值。
2.8 PEG400添加对沉积膜的影响
2.8.1 添加前后得到的沉积膜对比
设立两个试验组,一个空白组即未加PEG400,悬浮液浓度为20 g/L;一个为试验组,添加20 g/L的PEG400(2.8 g),悬浮液浓度亦为20 g/L。两组其他电泳参数保持一致,pH值为1.5、沉积电压U为100 V、电泳时间t为5 min,前后铜片不变,称重为1.701 4 g。电泳完成后再次称重,晾干铜片上有机溶剂后放到体视显微镜下放大45倍观察沉积层表面,如图10和图11所示。

图10 空白组体显下放大45倍表面观察

图11 试验组体显下放大45倍表面观察
从图10、图11可以看出,未加PEG400的空白组电泳得到的沉积膜上二氧化钛颗粒分布不是十分均匀,存在较多“褶皱”,这可能是悬浮液中纳米二氧化钛颗粒之间出现团聚造成的;对于添加了20 g/L的PEG400的试验组,从沉积层的附着性到均匀性都有较大的改善,且致密性较高,孔隙率很低。
从机理上分析,PEG是一种长链非离子表面活性剂,加进溶胶后很可能会进入胶团的扩散层或紧密层。M'pandou等详细研究了PEG对二氧化钛溶胶性质的影响,认为加入PEG所引起的胶体ξ电势降低不是因为电荷减少和表面点位降低,而是由于PEG进入扩散层导致滑移面向较低ξ电势处位移。这些溶胶电动性质的变化将会引起胶粒在电场下电泳速率和沉积机制的变化,这是导致电泳膜组成、结构、形貌变化的主要原因。
2.8.2 不同PEG400添加量所得沉积膜之比较
控制pH值为1.5,沉积电压为100 V,电泳时间为5 min,浓度为20 g/L,分别加入浓度为20 g/L、30 g/L、40 g/L、50 g/L、60 g/L的PEG400于悬浮液中,待电泳结束后晾干铜片、称重,记录膜层质量。变化曲线(如图12所示)与体视显微镜放大45倍照片如图13~图17所示。
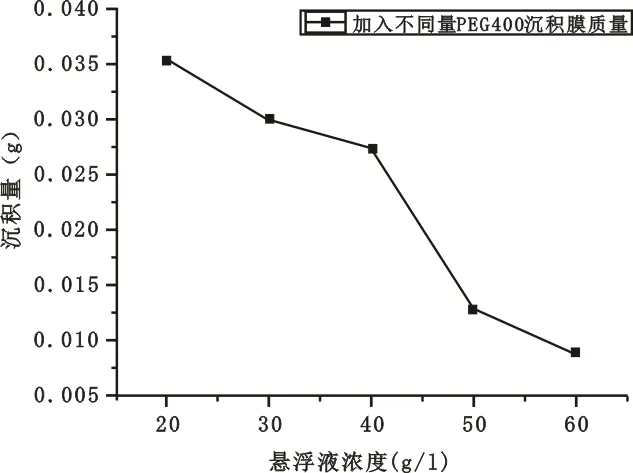
图12 不同浓度的PEG400对沉积量的影响曲线
从图12可以看出,随着PEG含量的增加,二氧化钛的沉积量单调减少;5个PEG添加浓度得到的沉积膜层的体视显微镜照片也反应出随着添加浓度的上升,沉积膜层变得稀疏,即致密性降低,但是可以看出其均匀性是在不断提高的。

图13 添加20 g/LPEG得到的沉积膜

图14 添加30 g/LPEG得到的沉积膜
这是因为添加PEG会使得二氧化钛溶胶粘度增加,双电层中滑移面外移,ξ电势下降,胶粒迁移率降低,这使得在相同电压和电泳时间内到达阴极表面的二氧化钛胶粒数量下降,也使得胶粒扩散层的电渗速度降低,从而导致胶粒的聚积速度减缓,沉积胶粒间的松散性提高。因此加PEG比不加得到的薄膜有相对较低的致密性,同时由于电场的定向作用使得胶粒能有序的排列,所以得到的膜相对均匀。

图15 添加40 g/LPEG得到的沉积膜

图16 添加50 g/LPEG得到的沉积膜

图17 添加60 g/LPEG得到的沉积膜
2.9 不同煅烧温度处理对二氧化钛晶型的影响
催化剂的煅烧温度不仅影响最终得到的催化剂粒径,同时还会影响催化剂的晶型和结构。锐钛矿型的二氧化钛粒子较金红石型具有更好的光催化性能,所以本实验旨在确定最佳温度以得到粒径合理的锐钛矿型二氧化钛粒子。
图18、图19、图20为不同烧结温度下所得催化剂粉体的XRD谱图。

图18 550 ℃烧结二氧化钛粉末X射线衍射图谱
从图18中可以看到,随着煅烧温度的不断升高,催化剂XRD的衍射峰逐渐变得尖锐,峰强度也逐渐增强,表明二氧化钛晶体发育逐渐完整,晶格结构也趋于完美。

图19 650 ℃烧结二氧化钛粉末X射线衍射图谱
由图19可知,温度达到650 ℃时出现了金红石型晶相,温度升高到750 ℃时(见图20),金红石晶相占多数,这可能会引起最终催化剂的光催化效果降低。因此,要获得粒度均匀、晶相完美的高纯纳米二氧化钛就必须严格控制煅烧温度。

图20 750 ℃烧结二氧化钛粉末X射线衍射图谱
3 结论
根据以上设计的试验和数据分析可以得出关于电泳沉积工艺和光催化性能的相关结论,现综述如下:
1)悬浮液配制过程中选用丙酮作为分散剂可以获得悬浮分散性和稳定性较好的浆料,且在电泳过程中不会出现严重的析氢现象;
2) 悬浮液中不加一定量的酸调节pH值,二氧化钛不能从丙酮悬浮液中电泳沉积出来,且随着pH值的降低沉积量增加;
3) 二氧化钛的电泳沉积量随悬浮液浓度、外加电压的增大和时间的延长都呈线性增加;
4) 根据试验结果、电泳实际效率并考虑到光催化性能的要求,确定各工艺参数:pH值为1.5、电压为100 V、悬浮液浓度为20 g/L、沉积时间为5 min;
5) 给二氧化钛溶胶中添加的PEG400可改变溶胶的电动性质,从而改变了膜的电泳沉积机制。适量的PEG400能引起的胶体ξ电势降低,从而导致胶粒的聚积速度减缓,沉积胶粒间的松散性提高,避免沉积时膜层出现的“褶皱”现象,使其均匀性提高;
6) 煅烧温度为550 ℃时,二氧化钛晶体发育逐渐完整,晶格结构趋于完美,为锐钛型晶相;煅烧温度达到650 ℃时出现了金红石型晶相,温度升高到750 ℃时,金红石晶相占多数,这可能会引起最终二氧化钛的光催化效果降低。

