不同超声条件重组油体乳液制备及其稳定性研究
李 杨 孙禹凡 谢凤英 闫世长 钟明明 齐宝坤
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
油体是植物种子中用来储存油脂的细胞器,为种子发芽后生长提供能量。油体是由磷脂及油体结合蛋白包裹的液态甘油三酯形成的球体结构,直径通常为0.5~2.5 μm。其中Oleosin蛋白是油体蛋白的主要成分,且蛋白含量最为丰富(占油体结合蛋白的80%~90%),是一类疏水、碱性小分子蛋白,分子质量通常为16~24 ku[1],在油体中起到稳定油体、阻止油体融合等作用[2],是一种良好的乳化剂,可在节省原料的基础上作为乳化剂形成稳定乳液[3]。文献[4]分析了油体结构模型,发现Oleosin蛋白的中间疏水区以锚式结构插入甘油三酯内部和磷脂疏水酰基端,其N端和C端分布其表面。由于这种特殊结构,它们在极端条件下也不会发生聚集,即使从种子中分离出来,也会保持稳定[5]。然而,正是由于这种稳定性,天然油体较难封装天然疏水性化合物,因而限制了其应用领域。
随着仿生技术的发展和油体研究的不断深入,文献[6]通过混合甘油三酯、磷脂酰胆碱和Caleosin蛋白成功制备出重组油体,但由于Caleosin蛋白占油体结合蛋白的2%~3%[7],因此制备途径过于繁琐复杂。为解决原料提取率低的问题,文献[4]将油体结合蛋白中的主要成分Oleosin蛋白代替Caleosin蛋白制备重组油体,但由于Oleosin含有较长的疏水肽段,在水中溶解性较差,重组油体在6 h后便出现严重的乳析和聚集现象。虽然之前有学者构建了重组油体,但稳定性不佳,进而限制了重组油体的应用。
超声是一种用于食品加工的新技术,具有安全、无毒、环保等特性[8]。根据其频率范围,超声可分为低功率和高功率超声[8]。低功率超声一直用于确保食品质量和安全性,而高功率超声则用于改变食品的功能特性,包括提高乳液的稳定性[9]。据文献[10-11]报道,超声不能改变蛋白的一级结构,但其二级结构会有微小的变化;超声可以展开部分蛋白的三级结构,将巯基和亲水基团暴露于蛋白表面,以提高蛋白质的溶解度,有利于乳液的形成。文献[12]研究表明,超声处理可以减小粒径,促进可溶性蛋白质聚集体的形成,并促进在油、水界面处形成更强的膜,以增加乳液的稳定性。因此,超声处理是辅助构建重组油体的一种有效手段。
本文采用超声手段辅助模拟天然油体结构,以甘油三酯、磷脂和Oleosin蛋白为原料构建重组油体,探究超声条件对构建重组油体乳液及稳定性的影响,明确重组的稳定和影响机制,以期为构建稳定的重组油体乳液提供理论基础,并为后期重组油体运载功能性物质提供研究基础。
1 材料与方法
1.1 材料与试剂
大豆(东农36号),东北农业大学大豆研究所提供;三羟甲基氨基甲烷盐酸盐(Tris-HCl),北京百奥莱博科技有限公司;蔗糖,天津科密欧化学试剂有限公司;异辛烷,天津市富宇精细化工有限公司;异丙醇、丁醇、甲醇、氯仿、丙酮、氢氧化钠,天津市天力化学试剂有限公司;尼罗红、尼罗兰,美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
KC-701型超微粉碎机,北京开创同和科技发展有限公司;SB25-12 DTD型超声波细胞破碎仪,宁波新芝生物科技股份有限公司;UV-2600/2700型紫外-可见分光光度计,岛津企业管理(中国)有限公司;Tanon-4800型全自动化学凝胶成像仪,上海天能设备有限公司;Nano-ZS90型粒度分析仪,英国马尔文公司;PHSJ-4A 型实验室pH计,中国上海雷磁公司;分析天平(0.000 1 g),北京赛多利斯仪器系统有限公司;FD5-3型冷冻干燥机,美国SIM公司; J-810型圆二色谱仪,日本JASCO公司。
1.3 方法
1.3.1油体及Oleosin蛋白的提取纯化
参照文献[13]的方法,并作适当修改。将大豆和水以液料比5 mL/g浸泡在蒸馏水中,在4~6℃条件下放置18~20 h。用组织捣碎机以18 000 r/min磨浆90 s,用4层脱脂纱布过滤除去豆渣,并收集滤液。向滤液中加入20%的蔗糖溶液,冰水浴搅拌15 min,并调节溶液pH值至11,转移到离心管中,在4℃条件下,19 000 r/min离心30 min,收集上层乳状物,并重复此步骤2次。最后收集的上浮物就是大豆油体富集物。最后提取得到的上层乳状物用去离子水清洗离心后即为大豆油脂体。放置于4℃冰箱中备用。天然大豆油脂体化学组成测定方法:含水率参考AOAC 930.15方法测定;游离脂肪酸含量参照AOCS Official Method Ca 5a-40方法测定;蛋白质含量参考AOAC 979.09方法测定;磷脂含量参考GB/T 5537—2008方法测定。每个样品测定3次。
根据文献[3]的方法进行Oleosin蛋白的纯化。将处理后的大豆油脂体与3倍体积的乙醚混合后,以10 000g离心10 min除去中性脂质,该过程重复3次。将获得的残渣再用氯仿/甲醇(体积比2∶1)混合后,以10 000g离心10 min从Oleosin蛋白中去除磷脂。使用3倍体积的冰丙酮沉淀蛋白,轻轻摇动后,将试管以10 000g离心10 min,收集沉淀即为Oleosin蛋白。最后将Oleosin蛋白置于氮气下以除去剩余的有机溶剂,冷冻干燥获得冻干的Oleosin蛋白用于进一步分析。
1.3.2Oloesin蛋白SDS-PAGE电泳
采用文献[14]的实验方式并稍作修改,SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)分离胶质量分数为15%,浓缩胶质量分数为5%。将Oleosin蛋白溶于水配制成质量浓度为3 μg/mL的溶液,取样品加上样缓冲液煮沸5 min。上样量15 μL,在80 V条件下运行30 min,进入分离胶后增至120 V。采用考马斯亮蓝溶液凝胶染色后进行脱色。
1.3.3重组油体乳液制备
经测得天然油体的蛋白质质量分数5.65%、磷脂质量分数3.67%、甘油三酯质量分数40.79%、含水率49.89%,故本实验依照天然油体的组成构建重组油体,具体方法如下:将225 mg/mL Oleosin蛋白与150 mg/mL磷脂酰胆碱混合于50 mL锥形瓶中搅拌2 h后,加入1.8 g/mL大豆油,在1 000 r/min条件下粗均3 min,再将超声波处理器的钛探头(直径0.636 cm)插入液面下,距离锥形瓶底部1 cm处,频率20 kHz、输出功率分别为200、400 W下处理6、12、24 min,超声波处理时间4 s,间隔时间2 s,并每隔5 min向冰水混合物中加入冰块保持低温,以未经超声处理样品作为空白对照。
1.3.4乳化活性及乳化稳定性测定
乳化性的测定参照文献[15]的方法。将均质的乳状液用0.1% SDS溶液稀释100倍,在波长500 nm处用紫外分光光度计测定吸光度,并计算乳化活性指数(Emulsifying activity index,EAI)。静置30 min后测定吸光度,并计算乳化稳定性指数(Emulsion stability index,ESI)。乳化活性指数和乳化稳定性指数计算公式为
(1)
(2)
式中E1——乳化活性指数,m2/g
E2——乳化稳定性指数,min
N——稀释倍数,取100
C——乳化液形成前蛋白质水溶液中蛋白质质量浓度,g/mL
φ——乳化液中油相体积分数,%
A0——0 min时的吸光度
A30——30 min时的吸光度
1.3.5粒径、ζ-电位测定
采用Malvern Zetasizer Nano ZS型电位仪测定乳液ζ-电位,利用Malvern Mastersizer 2000型激光粒度仪测定乳液的液滴直径。稀释比(以体积计)约为1∶1 000,乳液液滴的平均粒径采用体积平均直径D4,3来表示。所有的测试均在25℃条件下进行,平行测定3次。
1.3.6激光共聚焦显微镜成像
激光共聚焦显微镜(Confocal laser scanning microscopy,CLSM)的成像根据文献[16]的方法并稍作修改,乳液样品的测定在室温(20℃)条件下进行,采用Ar/K和He/Ne双通道激光模式,激发波长分别是488 nm和633 nm。尼罗红和尼罗兰分别以液料比1 000 mL/g溶解在异丙醇里,制成染色液。1 mL乳液样品加入40 μL配制好的染色液,混合均匀,染色30 min,取一滴染色的乳液样品放在带凹槽的载玻片上,盖上盖玻片并用甘油密封。油镜进行图像采集,分辨率为1 024像素×1 024像素,图像采集的范围为5~45 μm(直径),避免玻片上污染物对图像的影响。
1.3.7絮凝指数测定
乳滴絮凝指数(Flocculation index,FI)的测定根据文献[17]的方法并稍作修改,将新制备和储存24 h的重组油体乳液分别在蒸馏水、1% SDS下稀释1 000倍,采用Malvern Mastersizer 2000型激光粒度分析仪对稀释后的乳液粒度进行测定,每个样品重复测定3次。测定参数设置为:测定温度25℃,颗粒折射率1.520,颗粒吸收率0.001,分散剂为水,分散剂折射率1.330。试验采用D4,3表征体积平均粒径,絮凝指数计算公式为
(3)
式中D4,3-water、D4,3-SDS——乳液在水和1% SDS分散剂中的体积平均粒径
1.3.8储藏稳定性测定
重组油体乳液储藏稳定性的测定参照文献[18]的方法。取新鲜乳液至10 mL透明玻璃瓶中,封口密闭,置于室温,避光储存每隔7 d观察一次,上层为乳析层,下层为清液层。乳层析指数(Creaming index,CI)计算公式为
(4)
式中Hc——下层清液高度,cm
Ht——整个乳化液的高度,cm
1.3.9圆二色谱分析
参照文献[19]的方法并稍作修改,将新鲜的重组油体乳液在室温下10 000g离心30 min,取出上层的乳化层,将乳化层与冷冻的丙酮(按液料比20 mL/g)在-18℃下反应2 h,离心分离(10 000g,15 min,4℃)得到沉淀的蛋白,之后用丙酮清洗5~6次,最后得到的蛋白沉淀进行冷冻干燥,得到界面蛋白的粉末。利用圆二色谱测定界面蛋白二级结构的变化,将样品溶于0.1 mol/L磷酸盐缓冲溶液中(pH值7.4),并用去离子水将样品浓度稀释到0.5 mol/L,25℃下,以100 nm/min扫描速率在190~260 nm范围内扫描,样品池光程为1 mm,分辨率0.1 nm。采用CD Pro曲线拟合软件对数据处理分析求得二级结构相对含量,每组样品重复测定3次。
1.4 数据统计分析
所有的实验进行3次,结果表示为平均数±标准差,利用SPSS 22.0软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异。采用Origin 9.1软件等进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 天然油体分析及Oleosin蛋白SDS-PAGE
天然油体含有较高含量的甘油三酯,属于一种高含油结构,仅需5.65%蛋白和3.67%磷脂的包裹即可保护油体的稳定,本实验依照天然油体的组成构建重组油体,具体添加量为:225 mg/mL Oleosin、150 mg/mL磷脂酰胆碱和1.8 g/mL大豆油,在0.1 mol/L磷酸盐缓冲溶液(pH值7.4)中进行油体的重组。
Oleosin蛋白SDS-PAGE图谱如图1所示,结果表明,采用文献[13]方法所提取的Oleosin蛋白除去了油体表面大部分的其他结合蛋白,其中24 ku被认为是Oleosin蛋白,通过凝胶成像仪表明Oleosin蛋白质量分数高达95.6%,满足实验纯度要求。
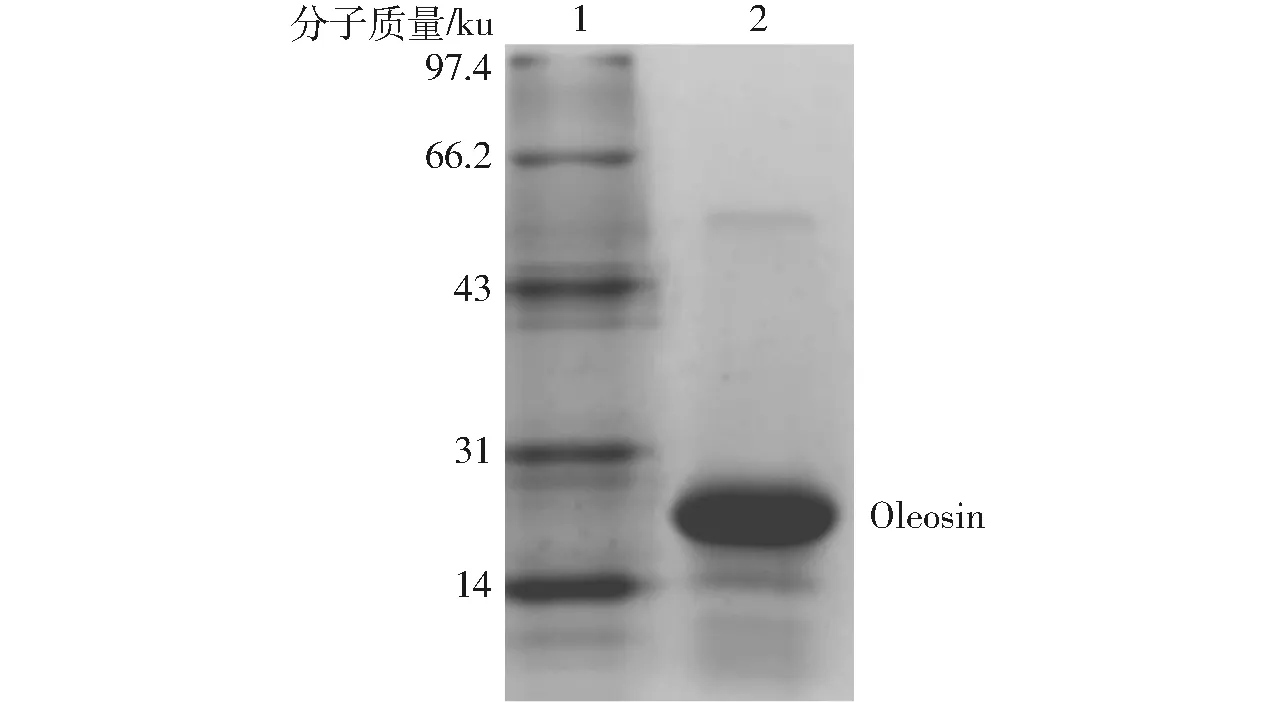
图1 Oleosin蛋白SDS-PAGE图谱Fig.1 SDS-PAGE of Oleosin
2.2 乳化活性及乳化稳定性分析
乳化活性及乳化稳定性是表征乳状液乳化特性及稳定状态的最重要指标之一。其中EAI表示的是重组油体乳液形成油-水界面的能力,ESI是指乳状液形成小液滴的稳定能力[20]。不同超声处理条件下重组油体的EAI和ESI如表1所示,与未经过超声处理的重组油体乳液相比,经过超声处理后,重组油体的EAI及ESI明显提高(P<0.05)。随着超声时间的延长,乳液的EAI和ESI也随之增加,这可能是由于重组油体表面电荷分布发生变化[21]。在200 W超声处理24 min时重组油体显示出最大的EAI(652.2 m2/g)和ESI(605.2 min),这是由于此条件下油-水界面层一部分被Oleosin蛋白占据,一部分被磷脂酰胆碱所占据,形成第1层稳定乳化膜;另外,超声作用使Oleosin蛋白的疏水基团充分暴露,与磷脂通过疏水相互作用形成第2层乳化膜,因此EAI及ESI显著提升。但当超声功率增加到400 W时,乳液的EAI和ESI不再升高反而降低,可能是由于超声处理使重油体的蛋白疏水基团暴露到极端环境中,出现一定程度的变性,形成不溶性蛋白质聚集体,由于聚集体表面电荷分布不均匀,因此吸附在油水界面层上的蛋白质含量下降,导致水包油型乳液乳化性降低。这与文献[21]的研究结果一致。

表1 不同超声处理制备重组油体乳液的EAI及ESITab.1 EAI and ESI of reconstruction oil body emulsion with different ultrasonic treatments
注:同列不同字母表示样品差异显著(P<0.05),下同。
2.3 重组油体粒径及微观结构分析
采用动态光散射技术探究不同超声条件制备重组油体乳液粒径分布情况,并利用激光共聚焦显微镜技术观察重组油体的聚集状态,结果如图2所示。数据显示,未经超声处理的样品粒径最大且出现了明显的聚集,但随着超声条件的改变,乳液的粒径减小,聚集现象有所改善。当超声功率为200 W时,随着超声时间的增加,重组油体乳液的平均粒径(表2)从448.3 nm减小到337.5 nm,这可能由于超声时间延长导致的湍流现象延长,该湍流可以使大多数液滴得到有效破碎,从而使粒径减小。当超声功率增加到400 W时,重组油体的粒径又增大,说明在该功率下可溶性蛋白聚集体通过共价键和非共价键结合重新聚集成不可溶性聚集体,弱化重组油体表面蛋白与磷脂酰胆碱间的疏水相互作用,导致乳液的稳定性降低。粒径分布图像呈现多峰分布的状态,400 W出现聚集现象,说明较高强度的超声处理会造成乳液无规律的聚集,不利于形成均一稳定的乳液。在200 W超声波处理时,湍流和微流效应增加分子间的碰撞和聚集,在空化作用下形成微小液滴,尤其是延长超声波时间至24 min后,变化更加明显,平均粒径只有337.5 nm,且共聚焦图像表明
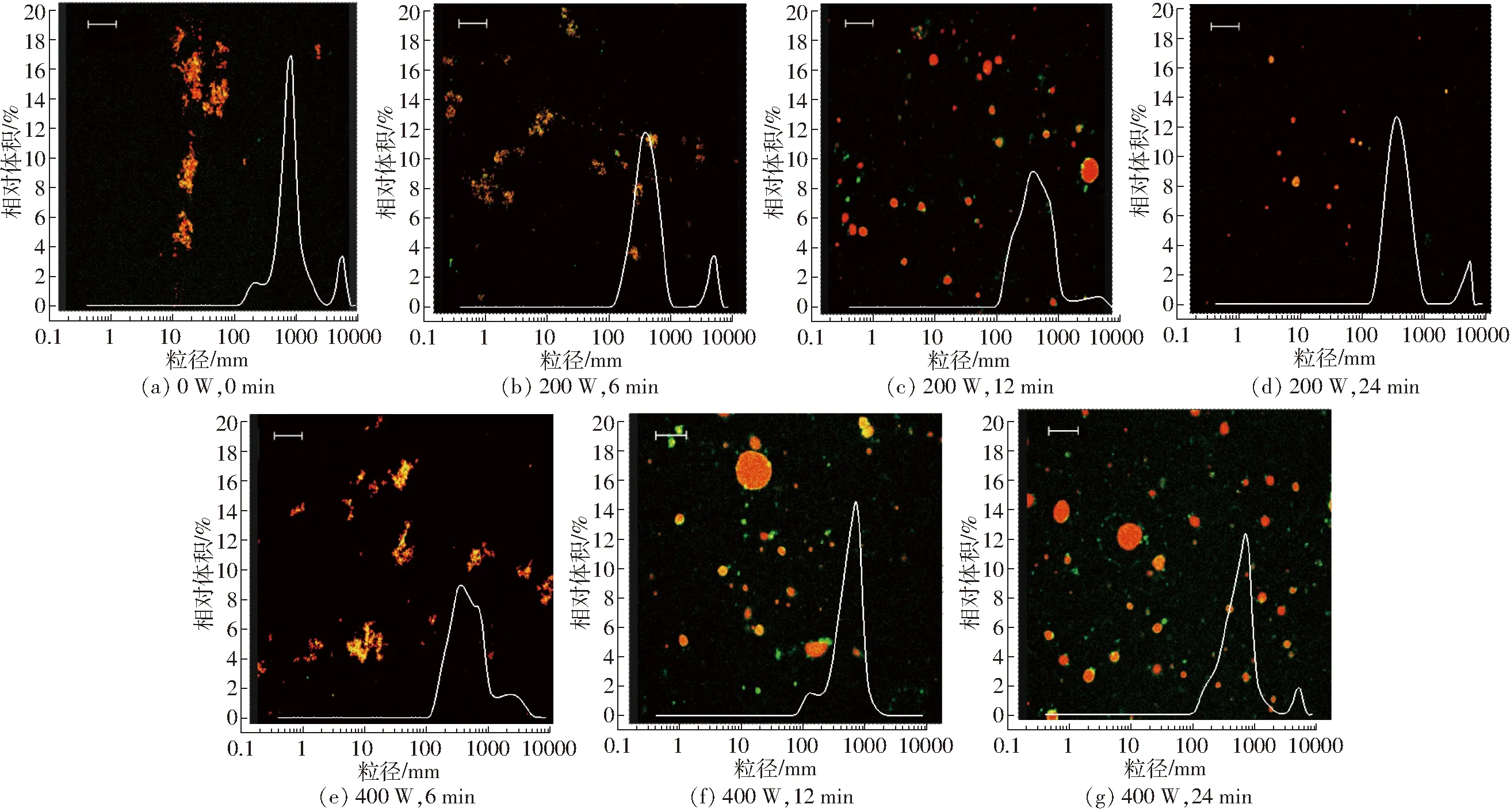
图2 不同超声条件下制备重组油体乳液激光共聚焦显微结构及粒径分布图Fig.2 CLSM and particle size distribution of reconstruction oil body emulsion with different ultrasonic treatments

超声功率/W超声时间/minD4,3/nm水SDS水(72h)SDS(72h)FI/%FI(72h)/%6(448.3±19.2)e(348.1±11.2)e(531.8±7.3)e(403.5±5.5)e(28.7±1.4)cd(31.8±0.1)d20012(399.9±2.7)f(318.5±11.0)f(465.6±5.6)f(362.4±7.9)f(25.6±3.4)d(28.5±4.3)e24(337.5±4.6)g(291.2±6.3)g(415.9±4.6)g(338.7±3.5)g(15.8±0.9)e(22.7±0.1)f6(761.0±21.5)b(553.9±14.7)b(850.2±9.6)b(603.5±10.3)b(37.3±0.2)b(41.0±0.8)b40012(602.9±10.3)c(457.8±7.7)c(720.6±5.3)c(527.4±7.1)c(31.7±0.1)c(36.7±0.8)c24(497.9±17.0)d(423.7±4.2)d(604.5±7.1)d(498.3±4.9)d(17.5±2.8)e(21.3±0.2)f00(1717.0±58.2)a(781.9±22.7)a(1978.2±30.4)a(853.5±15.2)a(119.6±1.2)a(131.8±0.5)a
乳液整体分布比较均匀,颗粒度明显较小,显示其稳定性最好,这与表2中重组油体乳液的D4,3及FI变化趋势一致。说明适当强度的超声处理可以加速重组油体乳液的形成,这与文献[22]结果一致。
2.4 重组油体的电位分析
乳液体系的稳定性可以通过ζ-电位的绝对值进行判断,绝对值越高,分散粒子间的排斥力越大,越不易发生相互碰撞产生聚集,呈现出稳定的乳液体系。反之,绝对值越低,粒子间越倾向于相互吸引而发生聚集[23]。由图3(图中不同字母表示样品差异显著,P<0.05)可知,未经过超声处理样品的ζ-电位绝对值最低为7.9 mV,经过超声处理后各样品的ζ-电位绝对值均明显增加。随着超声时间和超声功率的增加, 重组油体乳液的ζ-电位绝对值呈现增大的趋势,这与文献[24]研究结果相一致。随着超声处理时间的增加,重组油体乳液的ζ-电位绝对值增加,这可能是由于长时间的超声作用可以增强Oleosin蛋白与磷脂间的疏水相互作用,增加颗粒间的静电斥力,导致乳液稳定性增加[25]。其中在超声功率为200 W、超声时间为24 min时,重组油体乳液的ζ-电位绝对值最高, 表明在此条件下重组油体乳液表面有较高的静电斥力, 可防止液滴发生聚集, 此时制备的重组油体乳液具有较高的稳定性。
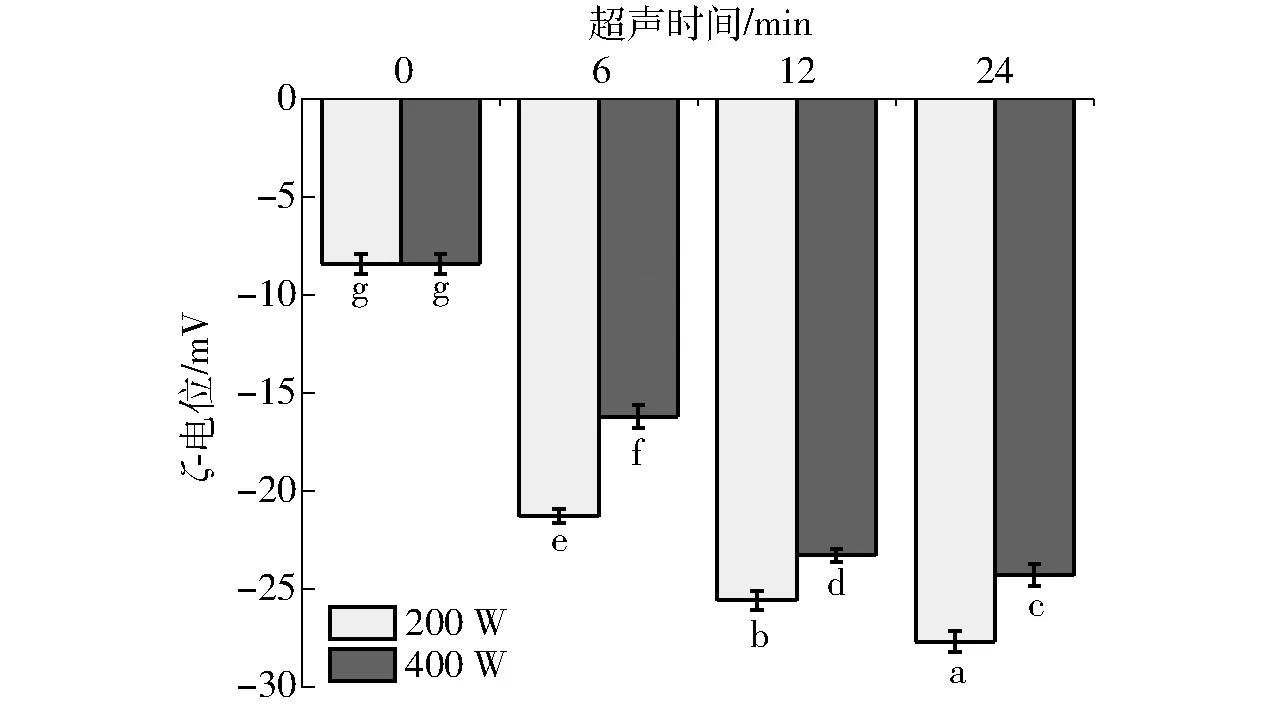
图3 不同超声处理制备重组油体乳液的ζ-电位变化Fig.3 Changes of ζ-potential of reconstruction oil body emulsion with different ultrasonic treatments
2.5 凝絮指数分析
除乳化能力外,油滴的凝絮状态是影响乳液稳定性的另一个重要指标,乳液的凝絮指数可以间接地表示乳化体系的稳定程度[26],表2为不同超声条件下制备重组油体的FI和D4,3的变化。所有样品的FI值均在72 h后出现增大的现象,这表明乳液72 h后均发生聚集现象。与未经过超声处理乳液相比,经超声处理的凝絮指数较小,且随着超声时间的增加,凝絮指数不断降低。在超声功率为400 W,超声时间为6 min时乳液凝絮指数最大,这说明在此时重组油体乳液最容易发生聚集,表现出较弱的抗凝絮稳定性,该现象可能是由于超声功率的增加导致油滴间相互作用力加强,Oleosin蛋白与磷脂酰胆碱之间的相互作用较弱,所形成的界面膜无法完全包裹油滴,使乳液不稳定。在超声条件为200 W、24 min时重组油体的FI最小,此时蛋白质内部分子骨链结构伸展适宜,与磷脂酰胆碱结合紧密,形成的重组油体界面膜最稳定,能完全包裹油滴,延缓乳液凝絮现象的发生,这与激光共聚焦显微镜及电位数据结论一致。
2.6 重组油体储藏稳定性分析
乳层析指数可以反映乳液在储存过程中的稳定性变化[27]。由图4可知,不同超声处理制备的重组油体乳液在室温储存28 d后出现不同程度的分层现象,这表明不同超声处理下制备的重组油体乳液储存稳定性各有差异。其中,未经超声处理的样品乳层析指数最大为46.3%,这与表2中乳液的絮凝指数变化趋势一致,说明乳液中的油滴发生了脂肪上浮现象[28]。相比之下,超声处理制备的重组乳液在储存期间显示较好的稳定性,当超声功率200 W、超声时间24 min时显示出最低的乳层析指数(25.5%),表明它具有最佳的稳定性。
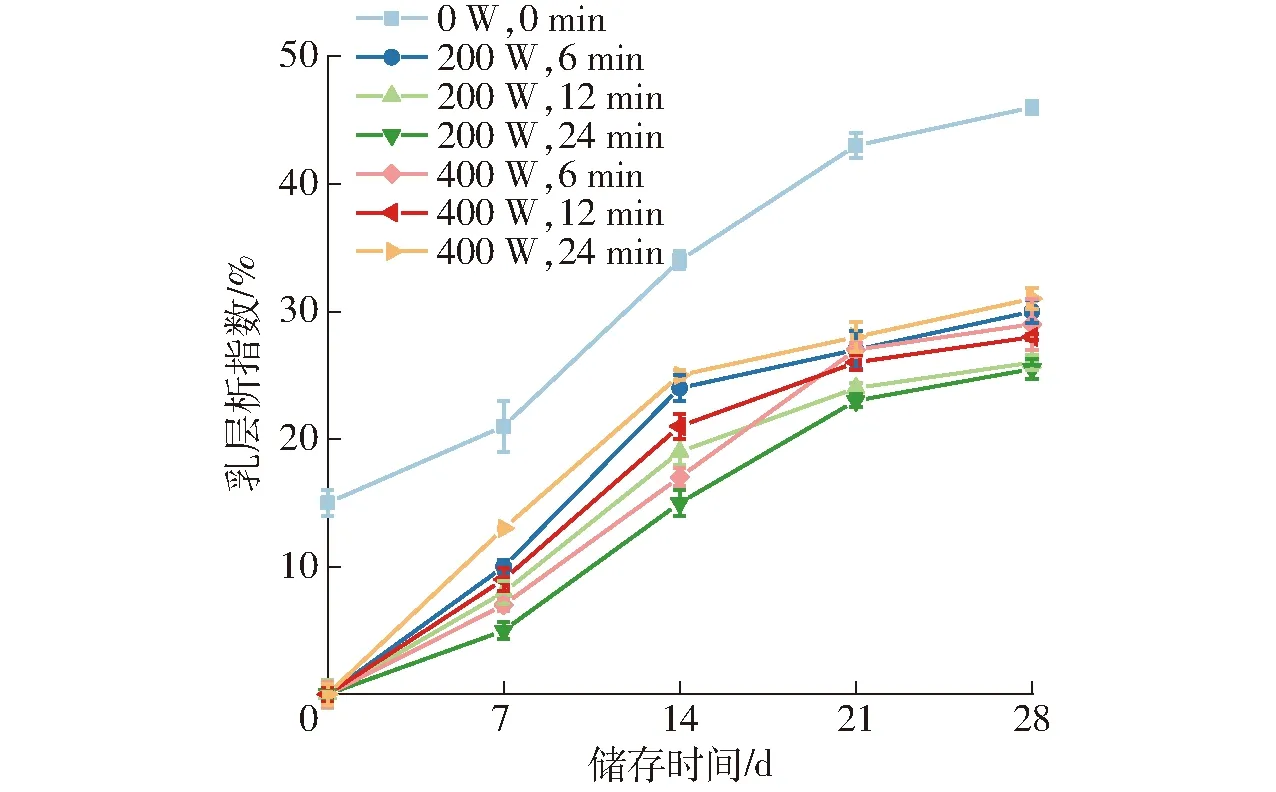
图4 不同超声处理制备重组油体乳液的乳层析指数变化曲线Fig.4 Changes of CI of reconstruction oil body estimated using circular dichroism spectra
2.7 圆二色谱分析
圆二色谱是一种精准分析蛋白质二级结构的常用手段,能够在蛋白液体中直接测定[29]。测定结果如表3所示。经过不同超声处理后,蛋白质的二级结构均发生了明显的变化,其柔性结构增加,蛋白质分子由无序变得有序,其中α-螺旋降低,β-折叠、β-转角和无规则卷曲升高,且相对含量变化较为明显,这与文献[30]的研究结果一致。文献[31]研究发现β-折叠在蛋白质二级结构中可促进蛋白聚集和网络结构的形成,因此随着超声功率的增加(400 W)重组油体中蛋白β-折叠结构相对含量增加较多,促进了乳液中表面蛋白空间结构伸展,有利于蛋白与蛋白之间的聚集,导致重组油体乳液的粒径部分增大,与本研究粒径的测定结果相一致。在超声波处理条件200 W、24 min时,超声处理表现出最小的α-螺旋相对含量(10.4%)和最高的β-折叠相对含量(33.0%),可能是由于Oleosin蛋白和磷脂酰胆碱在此条件下相互作用更完全,结合其他数据变化趋势表明这种结构的改变更有利于形成稳定的重组油体乳液。
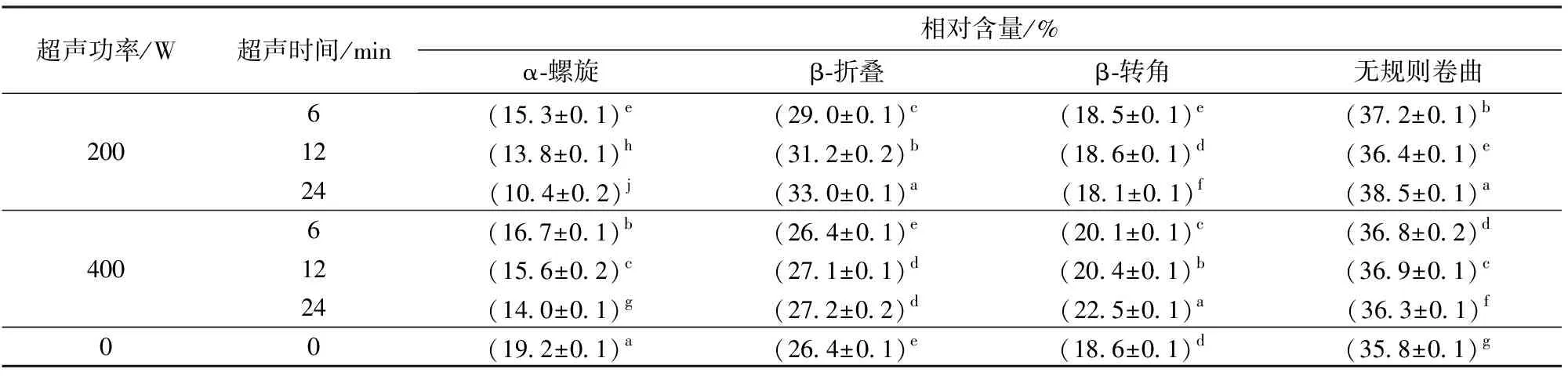
表3 不同超声处理制备重组油体乳液中蛋白质的二级结构相对含量Tab.3 Secondary structural contents of reconstruction oil body estimated using circular dichroism spectra
3 结束语
当超声条件为200 W、24 min时,制备的重组油体乳液粒径均匀稳定,激光共聚焦显微镜观察到的乳滴形状规则,表现出较好的乳化性和较低的乳层析指数。同时,超声处理改变了重组油体蛋白的二级结构,从而使乳化能力得到提高,重组油体蛋白的α-螺旋结构相对含量最少,重组油体表面蛋白构象发生转变,使其更易形成稳定的重组油体乳液。本研究发现,超声功率为200 W、超声时间24 min时所制备的重组油体乳液最稳定,该结果为重组油体的构建和应用提供了一定的理论依据。

