羊种布鲁氏菌Rev.1株VjbR 基因的克隆、原核表达及生物信息学分析
杭天宇,宋前进,金 铭,关平原,温永俊
(内蒙古农业大学兽医学院,农业农村部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
布鲁氏菌病是由布鲁氏菌引起的一种人兽共患病,以流产和发热为主要特征,严重威胁着人类和许多动物的生命健康,对畜牧业生产和公共卫生构成巨大威胁[1]。布鲁氏菌是一种细胞内寄生的小球杆状菌,革兰氏染色阴性,属于α-2蛋白细菌家族,能够感染专职和非专职巨噬细胞[3-5]。密度感应系统(qurum sensing,QS)是细菌的一种通讯系统,通过散在的细胞间信号分子产物介导细胞间通讯来调节基因表达,与布鲁氏菌[6]以及其他多种致病菌[7-8]毒力有关。有文献[9]报道,VjbR是密度感应系统Lux R 蛋白家族的一个转录激活因子,能够影响IV 型分泌系统(T4SS)和鞭毛基因表达,并且在布鲁氏菌毒力和胞内寄生中发挥了重要作用。
Fuqua 等[10]研究发现,Lux R 蛋白家族可以调节革兰氏阴性菌密度感应系统中酰化高丝氨酸内酯类(AHLs)信号分子自诱导,使细菌和细胞产生密度依赖,从而调节基因表达。值得注意的是,Kleinman 等[11]研究发现,VjbR 与其他Lux R 型蛋白不同,并不介导集体反应,而是在细胞早期感染阶段,将单个细菌隔离在吞噬体中。
为此,本试验通过成功构建pET-30a-VjbR 原核表达载体,将VjbR基因进行原核表达及纯化、生物信息学分析,探索该蛋白的免疫原性,为日后该基因的单克隆抗体制备及iELISA 诊断试剂盒的建立奠定基础。
1 材料与方法
1.1 菌株与阳性血清
羊种布鲁氏菌Rev.1株核酸:内蒙古金宇保灵生物药品有限公司惠赠;大肠杆菌BL21(DE3)菌株、DH5α 菌株及pET-30a 载体:内蒙古农业大学动物传染病学实验室提供;布鲁氏菌阳性血清:购自美国IDEXX 生物科技有限公司。
1.2 试剂
DNA Marker:购自北京天根生化科技有限公司;T4连接酶:购自NEB(北京)有限公 司;限制性内切酶(BamHI/XhoI)、2×EsTaqMasterMix、琼脂糖凝胶回收试剂盒及细菌质粒小提取试剂盒、显色剂:购自Thermo Fisher Scientific 公司;HRP 标记的兔抗羊IgG 抗体:购自Abcom 公司;蛋白Marker:购自北京索莱宝科技有限公司;
1.3 引物
根据GenBank 中收录的布鲁氏菌VjbR基因序列设计引物,并由吉林省库美科技有限公司合成。
1.4 主要仪器
PCR 仪、超净工作台、聚丙烯酰胺凝胶电泳仪、超速离心机、制冰机、超声波细胞粉碎机、恒温培养箱、恒温振荡器、水浴锅、高速冷冻离心机、蛋白纯化仪等,均由内蒙古农业大学动物传染病学实验室提供。
1.5 目的基因扩增
VjbR基因PCR 扩增反应体系(50 μL):Mix 25 μL、ddH2O 19 μL、上游引物2 μL、下游引物2 μL、DNA 模板2 μL;反应条件:95 ℃预变性2 min 30 s;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,30个循环;72 ℃终延伸10 min。将PCR 产物进行琼脂糖凝胶电泳检测,使用DNA 回收试剂盒回收目的片段,并与pMD19-T 载体连接,条件为16 ℃ 8 h;将构建好的pMD19-T-VjbR 重组质粒转化至大肠杆菌Trans5α 感受态细胞,活化后在具有氨苄抗性的LB 固体培养基中筛选;PCR鉴定阳性菌液送生工生物工程有限公司测序,在GenBank 中比对测序结果。
1.6 原核表达载体构建
使用BamHI 和XhoI 核酸内切酶,将测序结果正确的重组质粒pMD19-T-vjbR 和pET-30a 原核表达载体进行双酶切,用琼脂糖凝胶电泳检测后分别进行DNA 回收;使用T4连接酶16 ℃连接8 h,然后转化至大肠杆菌BL21(DE3)感受态细胞;活化后在具有卡那抗性的LB 固体培养基中筛选,提取质粒进行BamHI 和XhoI 双酶切鉴定。
1.7 重组蛋白原核表达及SDS-PAGE 电泳检测
从转化后涂板的LB 固体培养基上,挑取单克隆菌落至10 mL 含卡那抗性的LB 液体培养基中,37 ℃,200 r/min 培 养12 h;取1 mL 菌 液至100 mL 含卡那抗性LB 液体培养基中,37 ℃,200 r/min 培养至OD=0.6~0.8;加入100 mmol/L 的IPTG 至终浓度0.5 mmol/L,37 ℃,200 r/min 诱导培养2 h;将诱导表达后菌液以12 000 r/min 离心15 min,然后超声破碎菌体(工作循环40%、超声5 s、间歇5 s、破碎30 min),12 000 r/min 离心15 min;分离上清与沉淀,将沉淀用20~30 mL 10 mmol/L Tris-HCl(pH8.0)溶液重悬;取上清和重悬后菌液各10 μL 至两个全新1.5 mL 离心管中,加入等体积的2×loading buffer 蛋白上样缓冲液中,100 ℃ 10 min,进行SDS-PAGE 电泳检测。
1.8 重组蛋白纯化
用梯度离心法,对重组蛋白进行纯化。用15 mL 10 mmol/L Tris-HCL(pH8.0)溶液重悬沉淀后,加入5% Triton X-100,旋涡震荡充分混匀后静置10 min,12 000 r/min,离心10 min,分离上清和沉淀;弃上清,用15 mL 10 mmol/L Tris-HCL(pH8.0)溶液重悬沉淀,12 000 r/min,离心10 min,弃上清。重复此步骤1次。用10 mL 10 mmol/L Tris-HCL(pH8.0)溶液重悬沉淀,加5~10 mL 含8 mol/L 尿素的10 mmol/L Tris-HCL(pH8.0)溶液,过夜溶解蛋白;次日12 000 r/min,离心10 min,收集上清;取10 μL 上清液加入40 μL 的5×loading buffer 蛋白上样缓冲液中,100 ℃ 10 min,进行SDS-PAGE电泳分析。
1.9 重组蛋白Western-blot 检测
将纯化后的蛋白SDS-PAGE 电泳分析后,14 V 50 min 转印至PVDF 膜上,用5%的脱脂乳,4 ℃封闭转印后的PVDF 膜8~10 h;用PBST 缓冲液洗涤3次,每次15 min;将PVDF 膜置于标准布鲁氏菌阳性血清与5%脱脂乳稀释液中(稀释比例1:50),37 ℃孵育4 h;用PBST 缓冲液洗涤3次,每次15 min;加入1:8 000稀释的兔抗羊IgG 抗体(HRP 标记),37 ℃孵育2 h;用PBST 缓冲液洗涤3次,每次15 min,用显色剂显色拍照。
1.10 生物信息学分析
用TMHMM Serverv 2.0软件,预测VjbR 蛋白的跨膜结构域;用SignalP 5.0 Server 软件,预测VjbR 蛋白的信号肽;通过SOPMA 软件,分析VjbR 蛋白的二级结构;通过Phyre2软件,预测VjbR 蛋白的三级结构;利用Predicting Antigenic Peptides 软件,预测VjbR 蛋白的抗原表位。
2 结果
2.1 目的片段扩增及原核质粒构建
羊种布鲁氏菌Rev.1株VjbR基因片段大小为789 bp。用1%琼脂糖凝胶电泳,分析PCR 扩增产物,发现与预期大小一致(图1)。将重组质粒用BamHI 和XhoI 进行酶切鉴定,发现与预期结果一致(图2)。
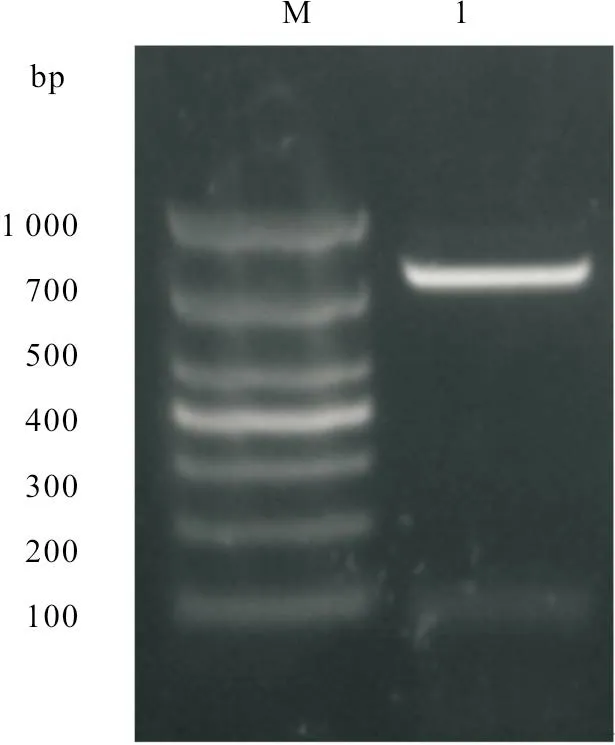
图1 VjbR 基因PCR 扩增结果
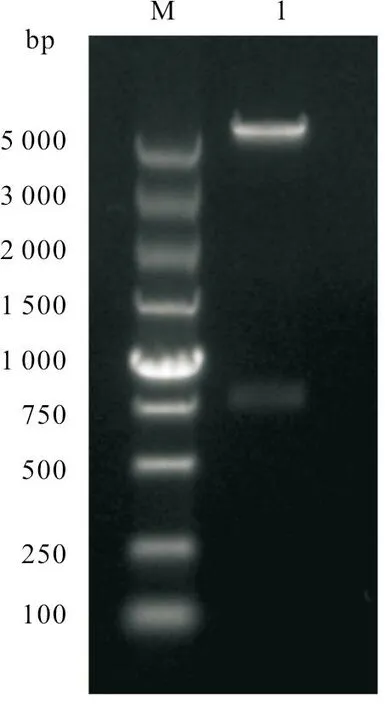
图2 重组质粒BamHI 和XhoI 双酶切鉴定结果
2.2 重组蛋白SDS-PAGE 电泳检测
取经破碎处理的样品,进行上样电泳检测。SDS-PAGE 分析显示,VjbR基因在34 kD 处有明显条带(图3、图4),主要表达在沉淀中,且大小与预期结果一致。
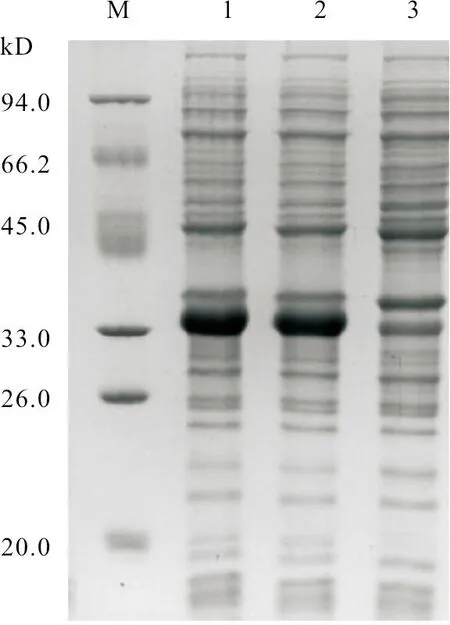
图3 SDS-PAGE 蛋白表达检测结果
2.3 蛋白质纯化
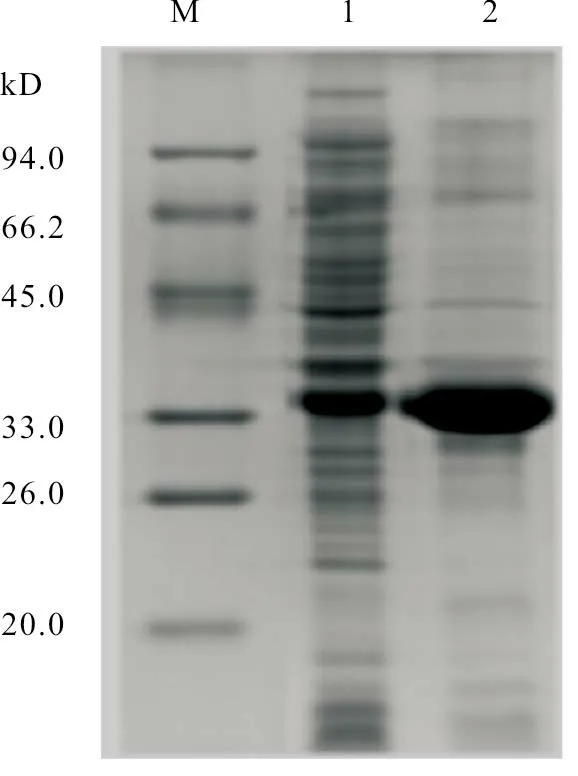
图4 重组蛋白在E.coli BL21(DE3)中诱导表达情况的SDS-PAGE 分析结果
对沉淀样品依次用15、20、10 mL 含10 mmol/L Tris-HCl(pH8.0)溶液重悬沉淀,12 000 r/min,分别离心15 min,再加5 mL 含8 mol/L 尿素的10 mmol/L Tris-HCl(pH8.0)溶液溶解蛋白,12 000 r/min 离心10 min,收集上清。对收集的上清,用SDS-PAGE 检测蛋白纯化效果,证实纯化出相应的蛋白(图5)。
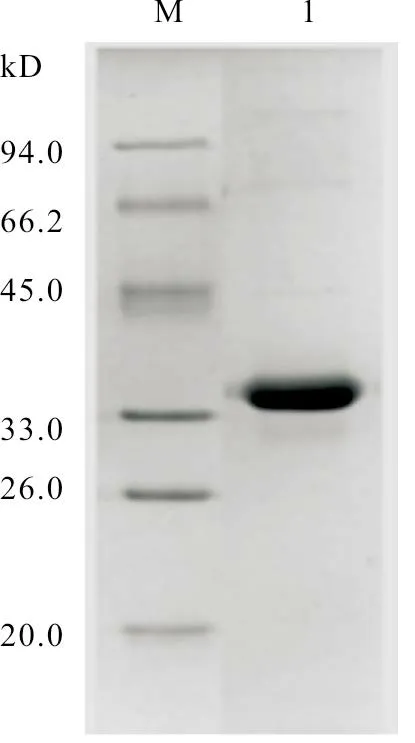
图5 目的蛋白纯化后的SDS-PAGE 检测结果
2.4 Western-blot 检测
将纯化后的重组蛋白进行聚丙烯酰胺凝胶电泳,电泳结束后将凝胶至于14 V 电压下转印50 min,孵育布鲁氏菌阳性血清,结果发现明显的目的条带,证实重组蛋白具有一定的反应原性,且大小与预期大小相符(图6)。
2.5 目的蛋白生物信息学分析
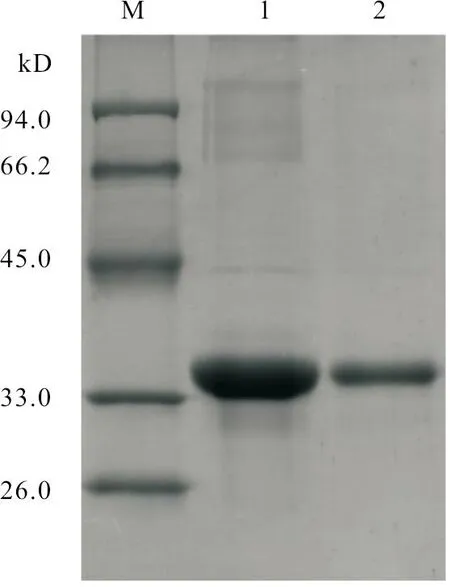
图6 Western-blot 检测结果
通过TMHMM Serverv.2.0软件,分析羊种布鲁氏菌VjbR 蛋白氨基酸序列的跨膜结构,发现该蛋白无跨膜区(图7);利用SignalP 5.0 Server软件,预测羊种布鲁氏菌的VjbR 蛋白的信号肽,发现该蛋白无信号肽(图8);利用Predicting Antigenic Peptides 软件,预测羊种布鲁氏菌的VjbR 蛋白的抗原决定簇,可发现该蛋白共有15个抗原决定簇(图9)。
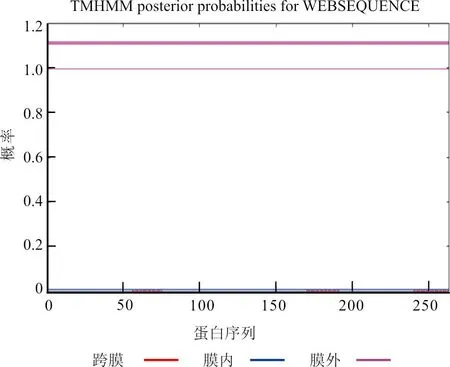
图7 跨膜区预测结果
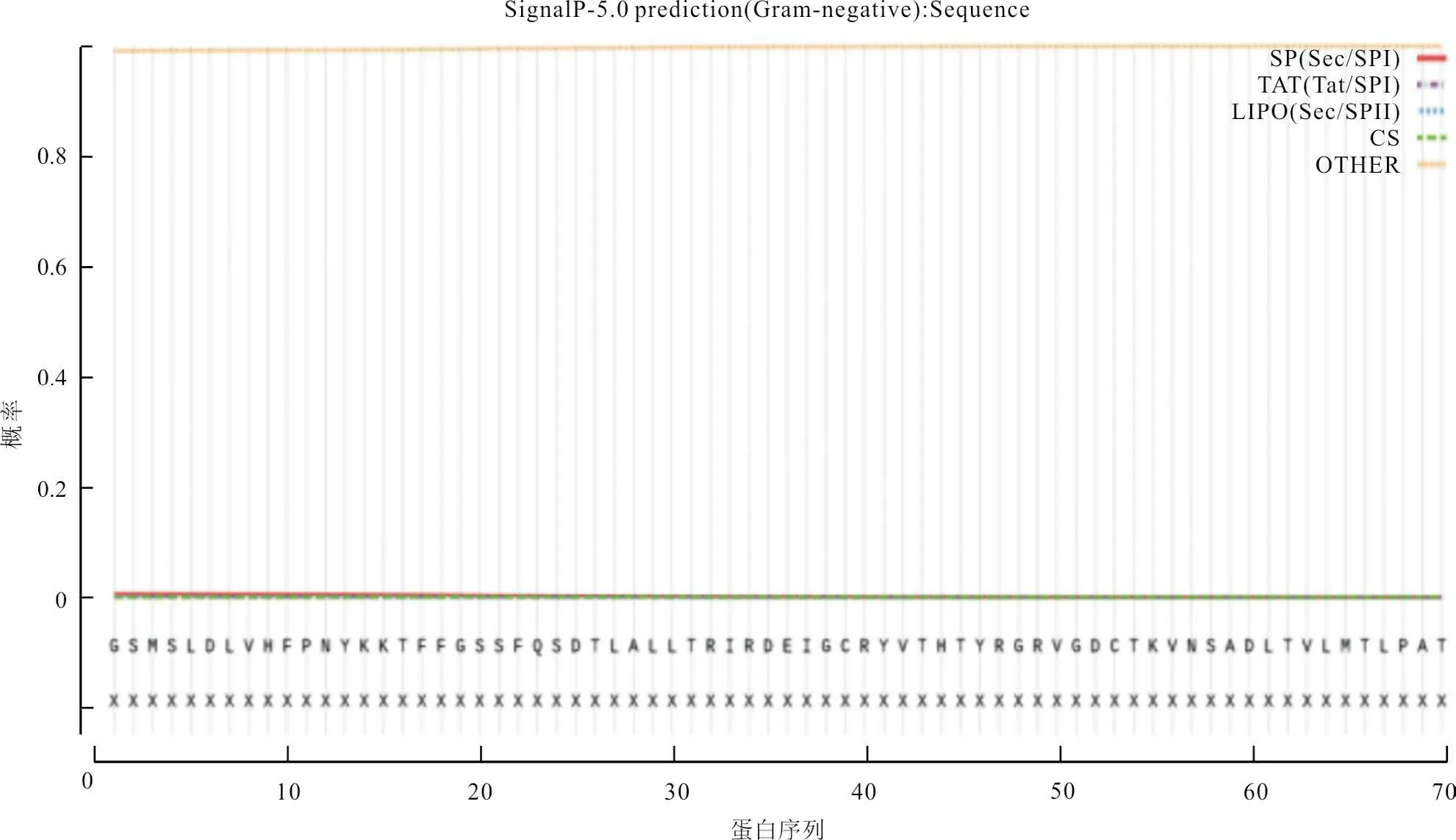
图8 信号肽预测结果
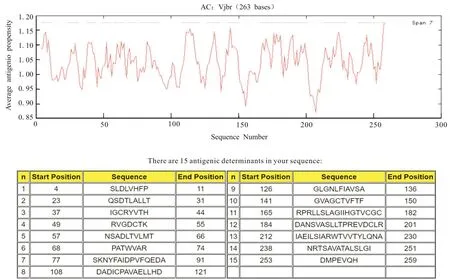
图9 抗原位点预测结果
经SOPMA 软件分析得出,该蛋白中参与形成α-螺旋的氨基酸有131个,占比为49.81%;参与延伸链形成的氨基酸有34个,占比为12.93%;参与无规卷曲结构的氨基酸有85个,占比为32.32%;参与β-转角形成的氨基酸有13个,占比为4.94%(图10)。蛋白质的三级结构含多种二级结构单元且有明显的折叠层次。通过软件Swiss Model 预测该蛋白的三级结构,发现其三级结构中有大量的α-螺旋及相应的无规卷曲和β-转角结构(图11)。
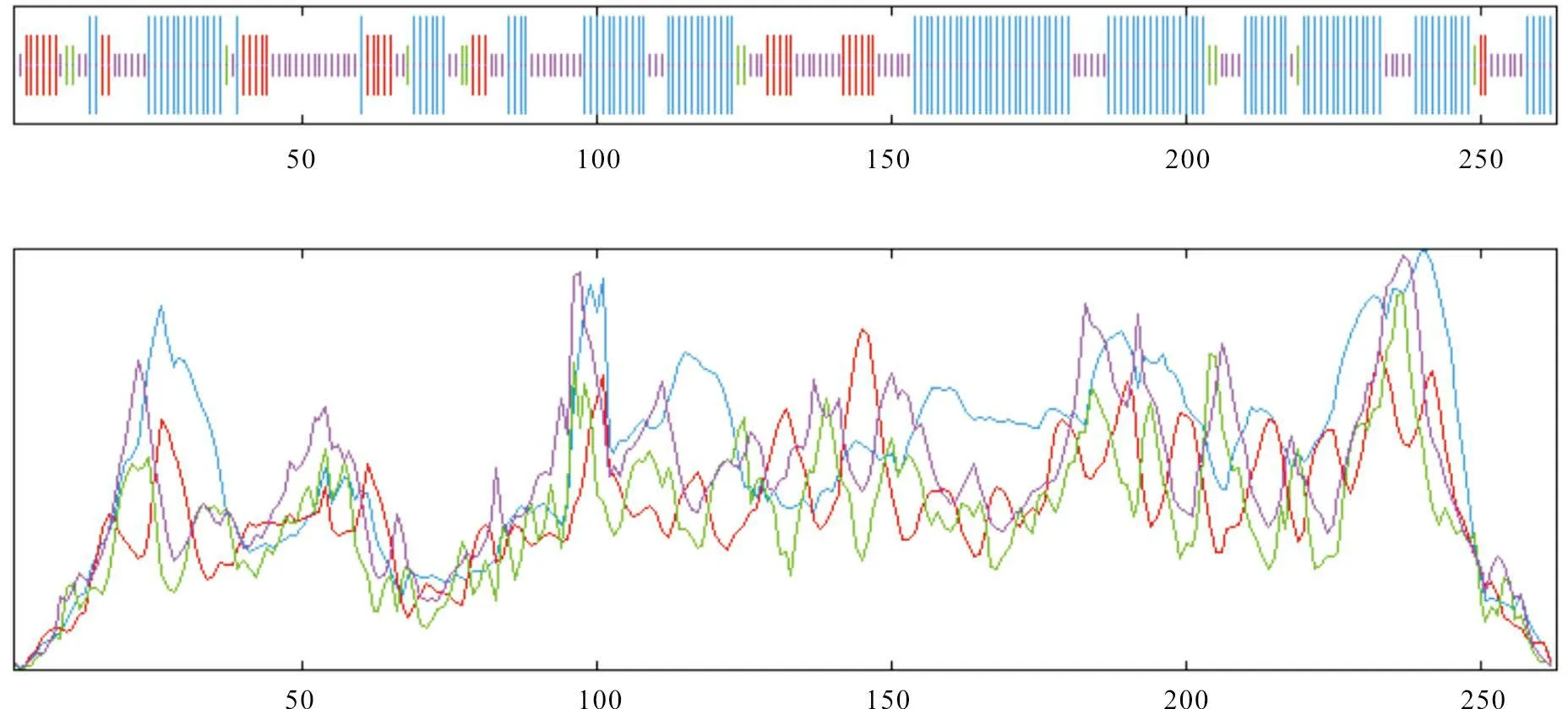
图10 VjbR 蛋白二级结构预测结果
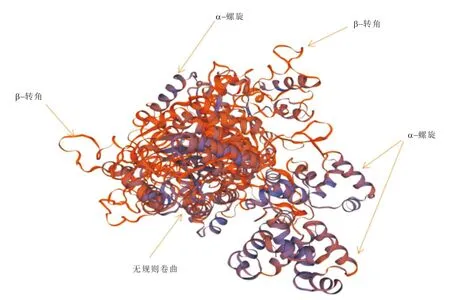
图11 VjbR 蛋白三级结构预测结果
3 讨论
布鲁氏菌病流行范围广,对养殖业构成巨大威胁。Li 等[12]研究表明,缺失VjbR基因的羊种布鲁氏菌16M突变株在实验模型中表现毒力减弱。Tafelmeyer 等[13]研究发现,VjbR基因参与调节脂多糖的合成和释放,还能调节几种外膜蛋白的合成。这几种外膜蛋白与布鲁氏菌毒力有关。因此,VjbR基因在布鲁氏菌致病力中占有重要地位。该基因的研究对布鲁氏菌相关致病机制的研究提供了材料。屈海龙等[14]在布鲁氏菌研究中发现,自然感染布鲁氏菌的牛、羊血清中含有VjbR 蛋白抗体,可知VjbR 蛋白广泛存在于布鲁氏菌病患病动物中,因此对VjbR 蛋白的深入研究具有一定意义。然而,人们目前多关注于VjbR基因的毒力研究,而关于VjbR基因的原核表达与蛋白纯化研究则很少。
本试验应用TMHMM Serverv.2.0在线软件等生物信息学软件,对VjbR基因进行分析,发现布鲁氏菌Rev.1株的VjbR 蛋白无跨膜区,无信号肽;利用Predicting Antigenic Peptides 在线软件分析Rev.1株的VjbR 蛋白抗原表位发现,该蛋白共有15个抗原决定簇。利用软件Swiss Model 构建了VjbR 蛋白的三维模型,从而有利于蛋白结构和功能的可视化分析。
本研究通过成功构建羊种布鲁氏菌pET-30a-VjbR 原核表达载体,使VjbR 蛋白得到大量表达,并通过纯化,得到了高度纯化的重组蛋白。同时其反应原性鉴定和生物信息学分析结果,为进一步研究该基因编码蛋白在临床诊断与治疗中的作用提供了重要依据。

