中华鳖GHITM cDNA基因克隆及表达分析*
熊 钢 周先文 马 晓 曾 丹 陈贞年 康 骊 王晓清
中华鳖cDNA基因克隆及表达分析*
熊 钢1,2周先文2马 晓3曾 丹2陈贞年2康 骊1王晓清2①
(1. 湖南生物机电职业技术学院动物科技系 长沙 410127;2. 湖南农业大学动物科技学院 长沙 410128;3. 河南师范大学水产学院 新乡 453007)
为研究基因在中华鳖()胚胎发育及生长中的作用,本研究通过RT-PCR和RACE方法获得了中华鳖全长cDNA序列;采用实时荧光定量PCR对mRNA组织表达及不同温度孵化胚胎发育过程中的表达特性进行分析。结果显示,中华鳖cDNA序列长度为2650 bp,开放阅读框为1050 bp,5¢非编码区为123 bp,3¢非编码区为1477 bp,编码349个氨基酸,编码蛋白的等电点为10.01,分子量为37.12 kDa。编码氨基酸序列由胞外区、跨膜区和胞内区组成,7个跨膜域组成跨膜区。编码氨基酸序列的同源性分析显示,中华鳖与锦龟()和绿海龟()同属一个分支,3种鳄鱼构成一个分支,7种鸟类形成一个分支。实时荧光定量检测显示,基因在肝脏、肌肉和脑垂体中的表达水平较高,显著高于心脏、性腺、肠、肾脏和脾脏组织(<0.05);50 g左右和500 g左右雄性个体肝脏中的基因表达量显著高于雌性个体(<0.05);低温胁迫孵化能显著抑制胚胎肝脏中基因的表达(<0.05)。上述研究结果表明,基因与中华鳖生长和胚胎发育密切相关,其在中华鳖胚胎中的表达受孵化温度调节。本研究为探讨中华鳖胚胎发育和生长提供理论依据。
中华鳖;;基因克隆;胚胎发育;组织表达
生长激素诱导的跨膜蛋白(Growth-hormone inducibletransmembrane protein, GHITM)是在研究转基因(Growth- hormone antagonist, GHA)小鼠的差异表达基因时被首次发现(Li, 2001)。GHITM蛋白(Reimers, 2007)的氨基酸序列其C末端的特殊结构域,将其归类为Bax抑制蛋白类似家族新成员,BI-1家族(Bax inhibitory protein-like family)在细胞内质网中高表达,并且参与细胞的程序性细胞死亡。这些家族成员在哺乳动物中保守存在,都是定位于细胞膜上且具有6~ 7个典型跨膜结构域的高疏水性蛋白(罗少杰等, 2016),在软体动物仿刺参() (高杨等, 2014)和马氏珠母贝() (罗少杰等, 2016)中有8个跨膜结构,因而得名生长激素诱导的跨膜蛋白。
GHITM蛋白在氧自由基对抗衰老的机制中发挥作用,与动物的年龄、生长相关(Knapp, 1994)。GHITM在小鼠胚胎和成人组织以及哺乳动物组织中普遍存在表达,在小鼠胚胎发育过程中大量表达,胚胎分裂对GHITM表达量至关重要(Yoshida, 2006)。GHITM在日本血吸虫() (熊涛等, 2012)童虫时期表达量高,推测其在生长发育中发挥作用。
为探讨中华鳖胚胎发育和生长,本研究采用RACE (Rapid-amplification of cDNA ends)扩增法获得中华鳖cDNA的全长序列,并采用实时荧光定量PCR技术(qRT-PCR)检测基因的组织表达情况,及不同孵化温度对胚胎处理的研究,旨在为进一步探讨中华鳖基因的生物学功能及作用机制提供理论基础。
1 材料与方法
1.1 实验材料
从湖南省岳阳市临湘中华鳖养殖场采集同批次50 g左右和500 g左右的中华鳖雌雄个体各3个,取其肌肉、肝脏、脑垂体、肠道、心脏、脾脏和性腺组织。中华鳖受精卵取自湖南省常德柳叶湖河州甲鱼生态养殖基地,24℃、30℃和34℃恒温孵化,取15~17期、20~22期和破壳期胚胎肝脏组织,各组织放入1.5 ml离心管中,于液氮中冷冻后,-80℃保存。
1.2 主要药品与试剂
RNA提取试剂盒(RNAiso Plus)、柱式胶回收试剂盒和凝胶回收试剂盒购于Omega,cDNA逆转录试剂盒、DNA Fragment Purification Kit Ver.2.0、纯化试剂盒和TdT酶购自大连宝生物工程(TaKaRa)公司,PCR反应酶-2×EasyTaq PCR SuperMix (北京全式金生物)、SYBR Green real time PCR Mix购自Thermo Scientific公司。
1.3 实验方法
1.3.1 引物合成 从GenBank中下载相近物种的基因序列,在基因保守区内用Primer Premier 5.0设计特异性引物,引物由上海铂尚生物科技有限公司(以下简称铂尚生物)合成,引物序列见表1。
1.3.2 总RNA提取和cDNA合成 用RNA提取试剂盒(Omega)提取总RNA,加入30 μl Rnase-free 水,60℃孵化溶解RNA沉淀,–20℃保存备用。以提取的总RNA为模板,按逆转录试剂盒操作说明逆转录成第一条cDNA链。
表1 中华鳖cDNA序列扩增及RT-PCR用引物

Tab.1 Primers used for cloning of GHITM cDNA and RT-PCR
1.3.3cDNA中间片段扩增和克隆 以引物GHITM1+和GHITM1扩增基因中间片段1;GHITM2+和GHITM2-扩增GHITM基因中间片段2;PCR扩增条件:95℃预变性3 min;94℃ 30 s,52℃ 30 s,72℃ 60 s,共33个循环;最后72℃延伸5 min。PCR产物经1.0%琼脂糖电泳、切胶和回收纯化后克隆至pGM-T载体,转化到感受态TOP10,进行蓝白斑筛选,菌液PCR检测阳性克隆,阳性克隆送铂尚生物测序。
1.3.4cDNA 3¢端和5¢端片段扩增和克隆 3¢端片段扩增和克隆:扩增采用GHITM2+、GHITMN3¢、3¢RACE Olig(T)-Adaptor和3¢RACE Adaptor引物,作为巢式PCR引物,GHITMN3¢是根据已获得中间片段序列而设计的特异性引物,并且GHITMN3¢在GHITM2+的下游;3'RACE Olig(T)-Adaptor和3¢RACE Adaptor是1对通用引物。反转录时,用3¢RACE Olig(T)- Adaptor代替反转录试剂盒中的Olig(T)用于mRNA反转录;扩增时,采用GHITM2+和3¢RACE Adaptor进行第1次PCR:94℃预变性3 min;94℃ 30 s,55℃ 30 s,72℃ 90 s,共20个循环;72℃延伸10 min。产物稀释50倍后,用GHITMN3¢和3¢RACE Adaptor进行巢式PCR,反应条件同上。PCR产物经1.0%琼脂糖电泳,将出现的条带切胶和回收纯化后克隆至pGM-T载体,转化到感受态TOP10,进行蓝白斑筛选,菌液PCR检测阳性克隆,阳性克隆送铂尚生物测序。
5¢端片段扩增和克隆:扩增采用GHITM1-、GHITMN5¢、5¢RACE Olig(T)-Adaptor和5¢RACE Adaptor引物,GHITMN5¢为根据已获得中间片段序列而设计的特异性引物,并且GHITMN5¢在GHITM1-的上游;5¢RACE Olig(T)- Adaptor和5¢RACE Adaptor为1对通用引物。首先,用特异性引物GHITM1-代替反转录试剂盒中的Olig(T),在Mulv逆转录酶作用下合成cDNA第一链,用DNA Fragment Purification Kit Ver.2.0 (Code: DV807A)纯化试剂盒将cDNA纯化。然后,在纯化产物cDNA3¢端加1个Poly(A)尾巴。取纯化cDNA 10.0 μl,5×TdT buffer 10 μl,0.1% BSA 5.0 μl,dATP (10 mmol/L) 2.5 μl,TdT酶1.0 μl,H2O 21.5 μl,37℃保温30 min后80℃10 min,产物用H2O稀释为0.5 ml后–20℃保存备用。最后用GHITM1-和5'RACE Olig(T)-Adaptor进行第1次PCR:94℃预变性3 min;94℃ 30 s,53℃ 30s,72℃ 60 s,共20个循环;72℃延伸10 min,产物稀释50倍后再用GHITMN5'和5' RACE Adaptor进行巢式PCR,反应条件同上。PCR产物经1.0%琼脂糖电泳,将出现的条带切胶和回收纯化后克隆至pGM-T载体,转化到感受态TOP10,进行蓝白斑筛选,菌液PCR检测阳性克隆,阳性克隆送铂尚生物测序。
1.3.5 测序结果分析 测序结果在美国基因库(http://www.ncbi.nlm.nih.gov/BLAST/)分析,主要使用DNAMAN生物软件、开放阅读框(https://www.ncbi.nlm. nih.gov/orffinder/),蛋白质理化性质预测使用ProtParam (http://web.expasy.org/protparam/)在线软件,信号肽(http:// www.cbs.dtu.dk/services/SignalP/)、CLC Main workbench软件和SWISS-MODEL Workspace (http://swissmodel. expasy.org/interactive)在线进行分析。应用MEGA 6.06(Librado, 2009)软件,采用邻位相接法(NJ法)构建系统发育树,并用Bootstrap重复1000次计算各分支的置信度。
1.3.6 基因发育及组织表达检测 按1.3.3方法获得中华鳖心脏、肝脏、肌肉、性腺、肠、肾脏、脑垂体、脾脏和胚胎肝组织cDNA,每个组织取3个平行样,其中,雌雄中华鳖胚胎用本课题组筛选的中华鳖性染色体PCR引物进行鉴定,50 g左右和500 g左右中华鳖雌雄采用解剖肉眼观察筛选。用荧光定量引物Real-GHITM和内参引物对各组织进行基因表达检测。对荧光定量数据采用基因相对内参基因表达量(2-ΔΔCt)进行计算。实验结果采用SPSS 17.0进行ANOVA单因素方差分析(One-way ANOVA),<0.05为显著差异,<0.01为差异极显著。
2 结果与分析
2.1 GHTIM cDNA克隆及序列分析
以中华鳖肝脏RNA为模板,用特异性引物扩增获得cDNA,全长为2650 bp(基因号: MH557794),包括包含123 bp的5¢非编码区序列、1 477 bp的3¢非编码区序列、长度为1050 bp开放阅读框,编码349个氨基酸(图1),编码蛋白的等电点为10.01,分子量为37.12 kDa。
2.2 基因编码氨基酸序列生物信息分析
利用SignalP软件对基因编码氨基酸序列预测无明显信号肽。编码蛋白功能域预测发现,基因编码氨基酸序列为典型的7个跨膜结构蛋白(图2)。从第121个氨基酸开始跨膜,由20个氨基酸组成的第4个跨膜结构域长度最短,由31个氨基酸组成的第7个跨膜结构域长度最长。
2.3 系统进化树分析
在GenBank中对中华鳖基因BLAST获得锦龟(, XP_005294095.1)、墨西哥箱龟(, XM_024209991)、绿海龟(, XP_007067303.1)、湾鳄(, XM_019555975)、扬子鳄(, XP_006029557.1)、密西西比鳄(, XP_006270235.1)、非洲鸵鸟(, XM_009685550)、褐几维鸟(, XM_013961508)、日鳽(, XM_010148176)、暴雪鹱(, XM_009578185)、鹃鴗(, XM_009958645)、日本冠鹮(, XM_009465931)和帝企鹅(, XM_019473032)物种的基因。利用MEGA 6.06软件对14个物种基因编码氨基酸序列进行比对并构建NJ系统进化树分析,结果显示,鳖科的中华鳖与龟科的锦龟和海龟科的绿海龟亲缘关系最近,同属一个分支,泽龟科的墨西哥箱龟独立在一支,湾鳄、扬子鳄和密西西比鳄3种鳄鱼构成一分支,7种鸟类形成一分支。

图1 中华鳖GHITM cDNA序列和推测的氨基酸序列
下画线表示跨膜结构域
Underline represents the transmembrane domain
图2 GHITM编码蛋白功能域预测
Fig.2 Prediction of protein functional domains of GHITM
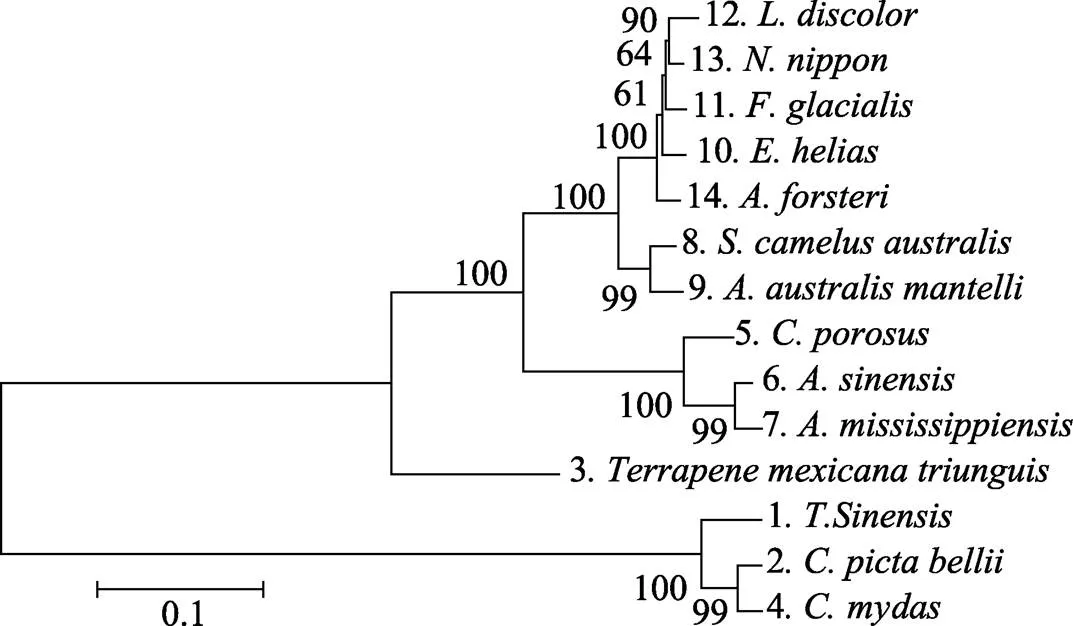
图3 利用MEGA 6.06软件构建的基于GHITM基因所编码氨基酸序列的NJ系统进化树
2.4 GHITM基因的组织表达特性及胚胎发育阶段变化
采用相对实时定量PCR检测mRNA的组织和胚胎表达特性,结果显示,基因在500 g左右中华鳖的肝脏、肌肉和脑垂体中表达水平较高,显著高于心脏、性腺、肠、肾脏和脾脏组织(<0.05),在性腺中表达量最低,且精巢与卵巢的表达量差异不显著(>0.05);50 g左右和500 g左右雄性中华鳖肝脏中表达量显著高于雌性(<0.05);采用30℃孵化的中华鳖胚胎性别决定期和分化期的雄性胚胎肝脏表达量不显著高于雌性(>0.05),在胚胎破壳时,雌性个体肝脏组织不显著高于雄性(>0.05);经24℃低温胁迫孵化处理胚胎肝脏能显著降低表达量(<0.05),34℃高温胁迫孵化处理不能显著增加表达量(>0.05)。
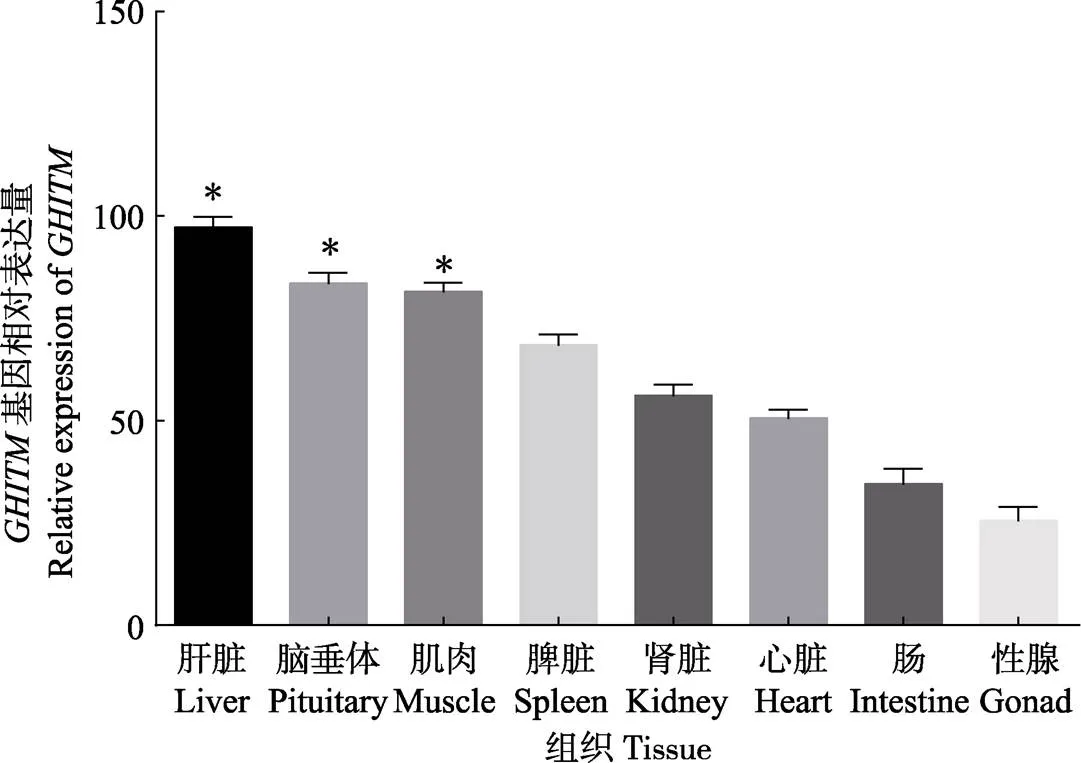
图4 中华鳖组织GHITM基因相对表达量
“*”代表组织间差异显著(=3,<0.05),下同
“*”represents significant difference between groups (=3,<0.05). The same as below
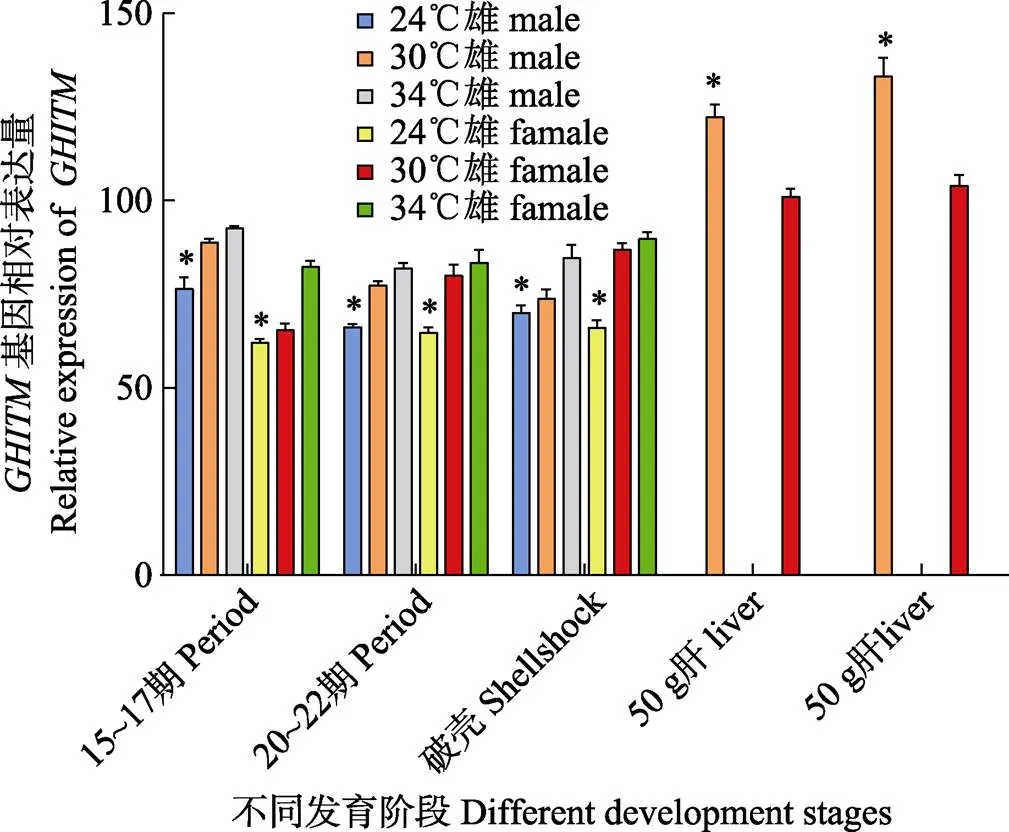
图5 中华鳖肝脏GHITM基因相对表达量
3 讨论
GHITM在调节GH功能、胚胎发育、脂肪代谢和免疫等许多方面有重要功能。人类Bax抑制因子和BI-1蛋白在跨膜区有6~7个跨膜域,在进化过程中是一个保守且具有复杂结构的蛋白,主要存在于胞浆中,作为细胞损伤和刺激的传感器等(Reimers, 2007)。本研究中的4种鳖龟GHITM蛋白跨膜结构域均为7个,其基因编码氨基酸序列构建的NJ系统发育树与物种传统分类地位一致。
在动物生长及能量代谢方面具有重要作用。表达量与小鼠胚胎分裂关系紧密(Yoshida, 2006)。在生长方面,鸡有调控生长的作用,是B淋巴细胞的特异性基因之一(Koskela, 2003)。介导生长激素/胰岛素样生长因子1轴 (GH/IGF1)对动物中枢神经系统的神经保护作用(Baudet, 2008)。罗非鱼的(Qiang, 2017)在小分子RNA(miR-1338-5p)的调节下参与干扰生长激素(GH)–生长激素受体(GHT)–胰岛素样生长因子(IGF)信号通路,参与罗非鱼的生长和发育。中华鳖雌雄个体在生长过程中存在差异,雄性中华鳖生长速度显著高于雌性(马晓等, 2015)。本研究选取快速生长阶段中的50 g左右和500 g左右中华鳖为研究材料,结果表明,500 g左右中华鳖基因在肝脏中表达量高于50 g左右中华鳖,据此推断,基因参与了中华鳖生长调节。
此外,GHITM (Henke, 2011)通过细胞内钙内稳态维持线粒体的正常结构。LPS刺激诱导仿刺参体腔细胞发现GHITM(高杨等, 2014)参与了仿刺参抗细菌感染和天然免疫防御反应。本研究发现,脾脏中GHITM有较高的表达量,其是否参与中华鳖的免疫尚需进一步研究。
在小鼠(Li, 2001)的胚胎发育过程中,含量不断增加,且在心、肝、肌、胃、肾、脑中均表达量较高。东方蜜蜂()的能够协同PGDR参与蜕皮和变态过程,在工蜂幼虫中基因表达随日龄稳定增长,而蜂王蛹中该基因的表达模式为先下降后上升(龚志文等, 2016)。半滑舌鳎()GH/IGF-Ⅰ轴(徐永江等, 2017)对卵巢发育具有重要的调控作用。在中华鳖胚胎发育阶段,孵化温度与孵化性别(巫旗生等, 2011)和胚胎重量存在相关性。本研究中,低温孵化处理对中华鳖胚胎基因表达量有显著抑制作用,高温孵化处理对其表达有上调作用,而在胚胎发育性别分化期(20~22期)基因表达量有所下降,这表明参与了中华鳖胚胎发育,但是否协同中华鳖性别调控还需进一步证实。综上所述,本研究是鳖龟类基因研究的首次报道,为进一步研究中华鳖胚胎发育和生长提供理论依据。
Baudet ML, Hassanali Z, Sawicki G,. Growth hormone action in the developing neural retina: A proteomic analysis. Proteomics, 2008, 8(2): 389–401
Gao Y, Wang SN, Ye SG,. Cloning and LPS - induced expression analysis ofgene in sea cucumber. Journal of Dalian Ocean University, 2014, 29(6): 543–549 [高杨, 王胜男, 叶仕根, 等. 仿刺参基因的克隆及LPS诱导后的表达分析. 大连海洋大学学报, 2014, 29(6): 543–549]
Gong ZW, Fan Y, Yang MH,. Growth-hormone inducible tranxmembrane protein (GHITM) expression in different developmental stages of honeybee (). Journal of Yunnan Agricultural University (Natural Science), 2016, 31(1): 81–86 [龚志文, 樊莹, 杨明华, 等. 生长激素诱导的跨膜蛋白基因(GHITM)在东方蜜蜂()幼虫不同发育阶段的相对表达分析. 云南农业大学学报(自然科学版), 2016, 31(1): 81–86]
Henke N, Lisak DA, Schneider L,. The ancient cell death suppressor BAX inhibitor-1. Cell Calcium, 2011, 50(3): 251–260
Knapp JR, Chen WY, Turner ND,. Growth patterns and body composition of transgenic mice expressing mutated bovine somatotropin genes. Journal of Animal Science, 1994, 72(11): 2812–2819
Koskela K, Kohonen P, Nieminen P,. Insight into lymphoid development by gene expression profiling of avian B cells. Immunogenetics, 2003, 55(6): 412–422
Li Y, Kelder B, Kopchick J,. Identification, isolation, and cloning of growth hormone (GH)-inducible interscapular brown adipose complementary deoxyribonucleic acid from GH antagonist mice. Endocrinology, 2001, 142(7): 2937– 2945
Librado P, Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 2009, 25(11): 1451–1452
Luo SJ, Chen WY, Yang CY,. Molecular cloning and expression analysis of growth-hormone inducible transmembrane protein gene (GHITM) from. Genomics and Applied Biology, 2016, 35(8): 1973–1980 [罗少杰, 陈伟耀, 杨创业, 等. 马氏珠母贝生长激素诱导跨膜蛋白基因GHITM克隆与表达分析. 基因组学与应用生物学, 2016, 35(8): 1973–1980]
Ma X, Wang XQ, Xiong G,. Effect of morphological traits on body weight of female and male. Freshwater Fisheries, 2015, 45(1): 93–97 [马晓, 王晓清, 熊钢, 等. 不同日龄池塘养殖中华鳖形态性状对体重的影响. 淡水渔业, 2015, 45(1): 93–97]
Qiang J, Bao JW, Li HX,. miR-1338-5p modulates growth hormone secretion and glucose utilization by regulating ghitm in genetically improved farmed tilapia (GIFT,). Frontiers in Physiology, 2017, 8: 998
Reimers K, Choi CY, Bucan V,. The growth-hormone inducible transmembrane protein (GHITM) belongs to the Bax inhibitory protein-like family. International Journal of Biological Sciences, 2007, 3(7): 471–476
Wu QS, Wang XQ, Zeng YY,. Influence on sexual differentiation inby temperature. Feed Review, 2011, 42(2): 42–44 [巫旗生, 王晓清, 曾亚英, 等. 孵化温度对中华鳖性别分化的影响. 饲料博览, 2011, 42(2): 42–44]
Xiong T, Liu R, Zhao QP,. Cloning and expression of the transmembrane protein (GHITM) gene of. Chinese Journal of Microcirculation, 2012, 22(4): 87 [熊涛, 刘镕, 赵琴平, 等. 日本血吸虫生长激素诱导的跨膜蛋白(GHITM)基因克隆与表达. 微循环学杂志, 2012, 22(4): 87]
Xu YJ, Liu XZ, Shi Y,. Physiological role of GH/IGF-I axis in ovarian development of. Progress in Fishery Sciences, 2017, 38(1): 73–80 [徐永江, 柳学周, 石莹, 等. GH/IGF-Ⅰ轴对半滑舌鳎()卵巢发育的调控作用. 渔业科学进展, 2017, 38(1): 73–80]
Yoshida T, Nagata S, Kataoka H. GHITM is an ortholog of theprothoracic gland-derived receptor (PGDR) that is ubiquitously expressed in mammalian cells and requires an N-terminal signal sequence for expression. Biochemical and Biophysical Research Communications, 2006, 341(1): 13–18
Molecular Cloning and Expression Analysis ofcDNA in
XIONG Gang1,2, ZHOU Xianwen2, MA Xiao3, ZENG Dan2, CHEN Zhennian2, KANG Li1, WANG Xiaoqing2①
(1. Department of Animal Science and Technology, Hunan Biological and Electromechanical Polytechnic, Changsha 410127; 2. College of Animal Science and Technology, Hunan Agriculture University, Changsha 410128; 3. College of Fisheries, Henan Normal University, Xinxiang 453007)
In this study, we obtained the full-length cDNA of thegene fromfor the first time using the RACE (rapid-amplification of cDNA ends) method. The full-length cDNA sequence was 2650 bp, including a 123 bp 5¢-UTR, 1477 bp 3¢-UTR, and 1050 bp open reading frame (ORF) that encoded 349 amino acid residues. The isoelectric point (pI) of this peptide was 10.01, and the molecular mass was 37.12 kDa. The amino acid sequence was composed of the extracellular region, the transmembrane region, and the intracellular region. The transmembrane region was composed of 7 transmembrane domains. The phylogenetic analysis of the amino acid sequences showed that,andbelonged to the same branch, the three species of crocodiles formed a branch, and birds formed another branch. The expression ofin different tissues was also analyzed with quantitative real-time PCR. The results showed thatwas expressed in all the tested tissues, including the liver, pituitary, muscle, spleen, kidney, heart, intestine, and gonad, with the high expression observed in the liver, muscle, and pituitary. At the specifications of 50 g and 500 g, the expression ofwas significantly higher in the liver of males than females (<0.05). Low temperature incubation can inhibit the expression ofin fetal embryos (<0.05). The results indicated thatwas related to the growth and embryo development of
;; Gene cloning; Embryonic development; Tissue expression
S917;Q575;Q492
A
2095-9869(2019)06-0173-07
10.19663/j.issn2095-9869.20180906001
http://www.yykxjz.cn/
熊钢, 周先文, 马晓, 曾丹, 陈贞年, 康骊, 王晓清. 中华鳖cDNA基因克隆及表达分析. 渔业科学进展, 2019, 40(6): 173–179
Xiong G, Zhou XW, Ma X, Zeng D, Chen ZN, Kang L, Wang XQ. Molecular cloning and expression analysis ofcDNA in. Progress in Fishery Sciences, 2019, 40(6): 173–179
* 国家自然科学基金(31672640)、湖南省自然科学基金(2017JJ3134; 2016NK2115)和湖南省教育厅基金项目(17C0935)共同资助 [This work was supported by National Natural Science Foundation of China (31672640), Natural Science Foundation of Hunan Province(2017JJ3134; 2016NK2115), and Scientific Research Fund of Hunan Province Education Department(17C0935)]. 熊 钢,E-mail: xionggang709@126.com
王晓清,教授,E-mail: wangxiao8258@126.com
2018-09-06,
2018-10-21
WANG Xiaoqing, E-mail: wangxiao8258@126.com
(编辑 冯小花)

