巨桉BRI1基因的克隆和表达分析
李晓丹, 胡冰, 裘珍飞, 范春节, 闫慧芳, 曾炳山
巨桉基因的克隆和表达分析
李晓丹, 胡冰, 裘珍飞, 范春节, 闫慧芳, 曾炳山*
(中国林业科学研究院热带林业研究所,广州 510520)
为了解基因在巨桉中的功能,采用PCR技术克隆了基因,分析了EgrBRI1的生物信息学和亚细胞定位,并对基因响应激素和胁迫的差异表达进行了分析。结果表明,基因全长3 893 bp,编码1 197个氨基酸。EgrBRI1蛋白稳定,空间结构复杂,存在3个motifs,主要定位于细胞膜。茉莉酸甲酯和油菜素内酯(BR)处理后,基因在叶片中的表达上升,而水杨酸处理则没有明显的变化。盐胁迫和冷胁迫下,基因表达表现为先下降后上升的趋势。因此,基因能快速对外施激素做出响应,并在巨桉抗逆方面发挥重要作用,这可能是通过对BR信号的响应来实现的。
巨桉; 油菜素内酯;基因; 基因表达
油菜素内酯(brassinolides, BR)是一种新型的植物激素,二十世纪70年代在油菜()花粉中发现。BR在植物中含量较少, 但活性极高[1],且适用性广、无毒,多存在于植物的生殖器官和营养器官中[2]。BR能调控植物细胞伸长和分化、维管组织分化、衰老、开花时间[3]、雄性育性、花粉发育、种子大小、光形态建成等一系列植物生长发育过程以及应对生物和非生物胁迫等过程[4–5]。对油菜幼苗外施BR能促进其体内热休克蛋白的积累,显著增强耐热性[6];对大麦()施用BR能减少赤霉病危害,降低产量损失[7]。而BR缺失突变体或不敏感型突变体则会出现矮化、维管组织发育不正常、墨绿色叶、开花和衰老延迟、雄性不育、种子萌发率降低及黑暗条件下去黄化等表型[8]。
在BR信号转导途径中,基因(brassinosteroid insensitive 1)编码1个亮氨酸受体激酶, BRI1定位在细胞膜上,通过胞外的结构域感受BR信号,启动胞内的激酶活性,使得抑制因子BKI1 (BRI1 kinase inhibitor 1)从BRI1上解离[9],BKI1的解离促使BRI1与其共受体BAK1/SERK3 (BRI1-associated kinase 1/ somatic embryogenesis receptor-like kinase 3)相互作用[10],接着通过一系列的激酶和磷酸酶的顺序作用,继续向下传递BR信号。BR信号通路中的关键转录因子BZR1 (brassinazole-resistant 1)和BES1 (BRI1- EMS-suppressor 1)从而被去磷酸化, 进入细胞核内调控BR相关基因的表达[11]。BRI1是1个细胞膜上的富含亮氨酸重复序列(leucine-rich repeats, LRRs)的类受体激酶,目前已发现20多个BRI1的突变体,都表现出叶片变圆、育性下降、衰老延迟等BR缺陷的典型特点[12]。
桉树()又称尤加利树,是桃金娘科(Myrtaceae)桉属植物的统称。桉树原产地位于澳大利亚,近几十年来已经成为全球人工林最重要的造林树种之一[13]。桉树木材质量优良,是用来做家具和装饰的理想材料。改良桉树材性,不仅有利于我国森林资源的合理利用,而且可促进国内木材加工工业的持续发展[14]。巨桉()全基因组测序的完成,也为开展基因克隆和鉴定相关基因功能提供了宽广的基础平台[15]。
BR信号需被BRI1蛋白感应才能启动一系列的信号级联传递,鉴于BRI1在BR信号转导途径中扮演的重要作用,本研究以巨桉材料,克隆了基因,采用实时荧光定量PCR对其在高盐、低温胁迫和BR、茉莉酸甲酯(MeJA)、水杨酸(SA)处理后的表达模式进行分析,同时还构建了亚细胞定位载体,观察巨桉BRI1蛋白在细胞内的表达情况,另外还构建了超表达载体,对其进行功能鉴定,为探讨桉树次生维管发育的分子调控机理和分子育种提供基础研究数据。
1 材料和方法
1.1 材料
试验材料为巨桉()无性系GL1,由中国林业科学研究院热带林业研究所林木生物技术组培育。选择生长状况良好,高度为30~ 40 cm的幼苗。
大肠杆菌() Trans1-T1感受态细胞、TA克隆载体购自北京全式金生物技术有限公司;反转录试剂盒购自美国的英潍捷基公司;PCR高保真酶和PCR Mix购于美国纽英伦生物技术;胶回收试剂盒、质粒提取试剂盒、DNaseI试剂盒购自德国凯捷(Qiagen)公司;DNA Marker购自上海捷瑞生物技术公司。引物合成和DNA测序工作由上海生工生物工程有限公司完成。
1.2 EgrBRI1基因克隆和生物信息学分析
总RNA的提取和cDNA的合成 使用EASY- spin植物RNA快速提取试剂盒(Aidlab)提取总RNA,采用1.2%琼脂糖凝胶电泳和NanoDrop 2000检测质量,OD260/OD280为1.8~2.0,28S/18S约为2的RNA样品进行cDNA的合成。采用Invitrogen Superscript III,按照操作步骤获得cDNA产物并置于–20℃冰箱保存。
基因克隆 利用DNAMAN软件设计克隆基因的引物(表1)。以cDNA为模板采用Q5 High-Fidelity PCR Kit进行PCR反应,采用20L反应体系,其中退火温度为62℃,35个循环。PCR产物采用QIAquick Gel Extraction Kit (Qiagen)进行目的片段回收。
生物信息学分析和进化树的构建 将巨桉基因序列提交NCBI (http://www.ncbi.nlm. nih.gov/WebSub/?tool=genbank), 登录号为KP721492。通过ExPASy数据库中的在线分析软件ProtParam (http://expasy.org/tools/protparam.html)分析EgrBRI1蛋白的理化性质[16],利用RasMol/PyMOL软件对EgrBRI1蛋白的结构进行分析。使用在线软件WoLF PSORT (http://www.genscript.com/wolf-psort.html)进行亚细胞定位预测[17]。在NCBI的BLASTX (http://blast.ncbi.nlm.nih.gov/)中查找不同植物的同源序列,选择相似度较高的物种,与巨桉EgrBRI1氨基酸序列进行多序列比对,在MEGA 6.0软件中构建进化树, 进化树以Gblock多重比对下的平均距离树(average distance tree)表示。
1.3 载体构建及亚细胞定位
载体构建 回收的目的片段连接于pEASY- Blunt克隆载体,热激法转化。通过菌液PCR检测,由上海生工生物工程有限公司进行测序确认。采用Gateway法将目的基因构建到pMDC32载体上,使用电击转化法,将载体转化根癌农杆菌() GV3101。采取同样方法构建亚细胞定位载体,转化农杆菌GV3101。

表1 文中所用引物
亚细胞定位 采用基因枪介导转化法,将构建好的亚细胞定位载体,通过基因枪法导入洋葱()表皮细胞,采用荧光显微镜检测该基因在细胞内的瞬时定位表达情况。具体步骤如下: 首先将金粉消毒,然后与DNA包埋,取50L金粉悬浮液,加入5L (1gL–1) DNA+50L (2. 5 mol L–1) CaCl2+20L (0.1 mol L–1)亚精胺充分混匀涡旋, 9 391×离心30 s后倒掉上清液,然后加入250L预冷的无水乙醇,涡旋1~2 min;15 871×离心1 min后倒掉上清,用60L无水乙醇重悬沉淀物。
同时选取新鲜洋葱,剥去外层,用解剖刀切取第2~3层鳞茎,切成3 cm×3 cm方块。用镊子小心撕下内表皮,将其置于高渗MS培养基中室温培养2~4 h。选用900 psi的可裂膜,将10L微弹悬浮液置于轰击膜中央,待风干后进行轰击。采用PDS1000/He 型基因枪轰击,轰击微粒运行距离为9/12 cm各1次,可裂膜与载体膜之间的距离为2.5 cm,载体与阻挡网之间的距离为0.8 cm,真空度为26~28 In·Hg。将轰击后洋葱表皮细胞在高渗MS培养基上培养16~20 h后,转移到MS培养基上培养24 h后制片,置于倒置荧光显微镜(Zeiss Axio Obrserver A1)下观察。
1.4 EgrBRI1基因的差异表达
用0.1 mmol L–1茉莉酸甲酯(MeJA)、0.2mol L–1BR、0.1 mmol L–1水杨酸(SA)喷施处理,分别在0、1、6、24和168 h后取叶片;参考姚海荣等[18]的方法进行盐处理和冷处理,200 mmol L–1NaCl分别处理0、1、6、24和168 h后取叶片;冷处理为在4℃下分别培养0、2、4、24和48 h后取叶片。样品采集后立即放入液氮内,然后转入-80℃冰箱中保存备用。基因的表达分析使用Roche公司的Light Cycler96荧光定量分析仪,采用SYBR Premix Ex Taq II (TaKaRa)试剂盒进行分析。cDNA样品稀释25倍, 程序为95℃ 30 s→(95℃ 5 s→60℃ 34 s) 40个循环, 溶解曲线程序为95℃15 s→60℃1 min→ 95℃ 15 s。内参基因为。
2 结果和分析
2.1 EgrBRI1基因克隆和生物信息学分析
利用设计好的特异性引物(表1)对基因进行PCR扩增,扩增产物经电泳检测后,回收目的片段并测序,片段长度为3 893 bp (图1)。
切取目的片段凝胶回收基因片段,然后将回收产物连接于克隆载体,经过筛选、PCR扩增、测序分析和比对,证实获得基因的核苷酸序列。经过氨基酸预测分析,基因编码1 197个氨基酸序列,其分子量为129 690.6 kD,理论等电点为6.01,不稳定系数为35.4,EgrBRI1蛋白质结构稳定,存在信号肽。脂肪系数97.37, 属于亲水性蛋白。蛋白质二级结构分析发现,-螺旋占35%,-转角占8.69%,延展结构为17.71%,无规卷曲占38.6%。蛋白无序性分析表明,EgrBRI1蛋白质不规则区域数为7,无序化分值为0.202。亚细胞定位预测该蛋白定位于细胞膜上,存在跨膜区,存在长度为141个残基的结构域,共有3个motifs, 含有LRRNT_2 domain、LRR_1 domain、LRR_8domain以及Pkinase domain (图2)。

图1 EgrBRI1基因的扩增
通过NCBI中的BLAST程序对EgrBRI1蛋白与其它植物中BRI1蛋白进行同源性分析(图3),结果表明EgrBRI1与拟南芥()、大豆()、蓖麻()、毛果杨()、可可()中的BRI1蛋白同源性高达77.60%,且都具有保守的3个LRR序列,说明BRI1在植物中高度保守。同时发现巨桉与杨树和蓖麻的亲缘关系最近,与其他植物遗传距离较远(图3)。
2.2 载体构建和亚细胞定位
以克隆载体为模板,经过BP反应将基因构建到入门载体pDONR221中,然后通过LR反应将基因构建到超表达载体pMDC32上, 该载体转化进入农杆菌GV3101细胞,菌液PCR检测证实基因的超表达载体已转化到农杆菌菌株中(图4)。
亚细胞定位载体构建同样使用Gateway克隆法,模板为上一步中的克隆载体, BP反应将目的基因交换到入门载体pDONR207上,LR反应后将基因构建到表达载体pEarly101中,检测目的载体是否成功进入农杆菌GV3101体内,使用35S引物和克隆引物(表1),农杆菌菌液PCR检测,结果如图5所示,得到/pEarly101-GV3101菌株, 亚细胞定位载体构建工作完成。
将构建好的EgrBRI1亚细胞定位载体EgrBRI1/ pEarly101-GV3101与pEarly101-GV3101空白载体,利用基因枪法转化进入洋葱表皮细胞,得到EgrBRI1蛋白在洋葱表皮细胞内的瞬时表达情况。如图6所示,空白载体转化的洋葱细胞内荧光分布在细胞各个部位,而重组载体转化的洋葱表皮细胞内,荧光主要分布在细胞膜上。这说明EgrBRI1蛋白定位于细胞膜上进一步行使其功能。
2.3 激素处理对EgrBRI1基因的差异表达影响
从图7可以看出,经过MeJA处理的巨桉叶片中基因的表达量升高,尤其是在1 h时表达量急剧升高,约为对照的593倍,说明能够快速的回应MeJA处理(图7: A)。与MeJA处理相似,BR处理时,基因的表达量升高,经过168 h处理表达量达到最高,约为对照的2.9倍(图7: B)。然而,SA处理时EgrBRI1表达量并未出现明显变化(图7: B)。这说明基因对不同的激素响应方式不同。
2.4 胁迫处理对EgrBRI1基因的差异表达影响
在盐处理时,叶片中基因表达量呈现出先高后低的现象,在6 h处理时表达量达到最大,为对照的2.3倍,随后基因表达量逐渐降低,在168 h处理时其表达量显著下降,远低于对照水平(图8)。而在冷胁迫处理时,基因的表达量呈现出快速应答的表现,在1 h时表达量迅速下降,随后缓慢上升,但仍然低于对照水平,处理48 h表达量升高,超过对照。这表明基因响应盐胁迫和冷胁迫的表达方式明显不同(图8)。
3 讨论
本文成功克隆了巨桉的基因,全长3 893 bp,编码1 197个氨基酸,与刘明月等[19]克隆的杜仲()基因(无内含子,全长为3 612 bp,编码1 203个氨基酸)长度上存在差异,可能是不同物种的原因。EgrBRI1蛋白质理化性质稳定,预测其存在细胞膜表面,可以感知BR信号,并与之结合。Wang等[20]报道大豆的GmBRI1蛋白结构稳定,具有激酶活性,且结构高度保守。EgrBRI1蛋白质的生物信息预测结果与其相似,说明EgrBRI1和GmBRI1蛋白质具有亲缘性。通过构建亚细胞定位载体,基因枪介导转化洋葱细胞,观察到EgrBRI1蛋白质定位于细胞膜上。这说明BRI1蛋白质在植物中具有高度的保守性,主要在细胞膜上响应BR并行使功能。

图2 EgrBRI1 氨基酸序列与其他植物的多重比较分析。Egr: 巨桉; At: 拟南芥; Pp: 桃树; Gm: 大豆; Pt: 毛果杨; Rc: 蓖麻; Cp: 番木瓜; Tc: 可可。LRRNT_2: 富含亮氨酸重复N-末端结构域; LRR_1, LRR_8: 富含亮氨酸重复序列; Pkinase: 亮氨酸激酶结构域。
Fig. 2Multiple comparation analysis ofamino acid sequenceof EgrBRI1 and other plants. Egr:; At:; Pp:; Gm:; Pt:;Rc:; Cp:; Tc:. LRRNT_2 is Leucine rich repeat N-terminal domain; LRR_1, LRR_8 are Leucine rich repeats; Pkinase is Leucine kinase domain.
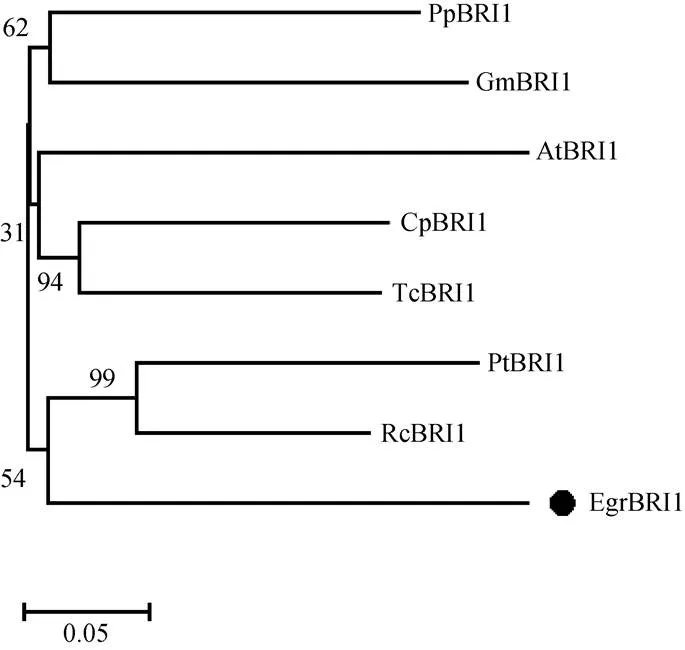
图3 EgrBRI1的系统进化树。Rc: 蓖麻; Gm: 大豆; Cp: 番木瓜; Egr: 巨桉; Tc: 可可; Pt: 毛果杨; At: 拟南芥; Pp: 桃树。
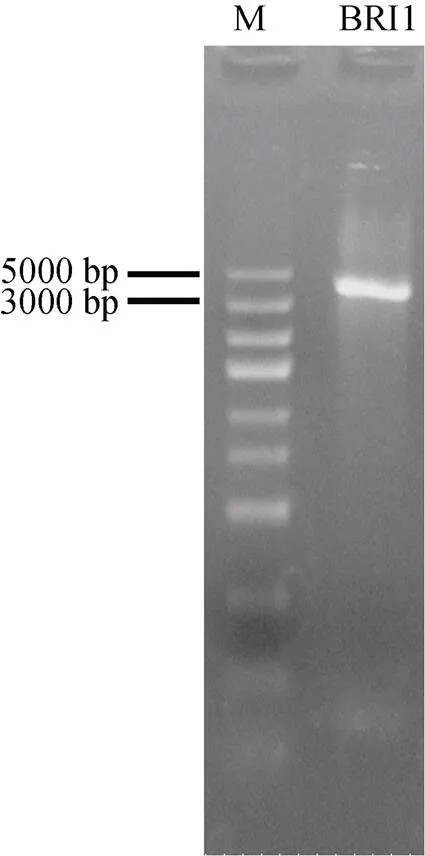
图 4 EgrBRI1超表达载体构建检测
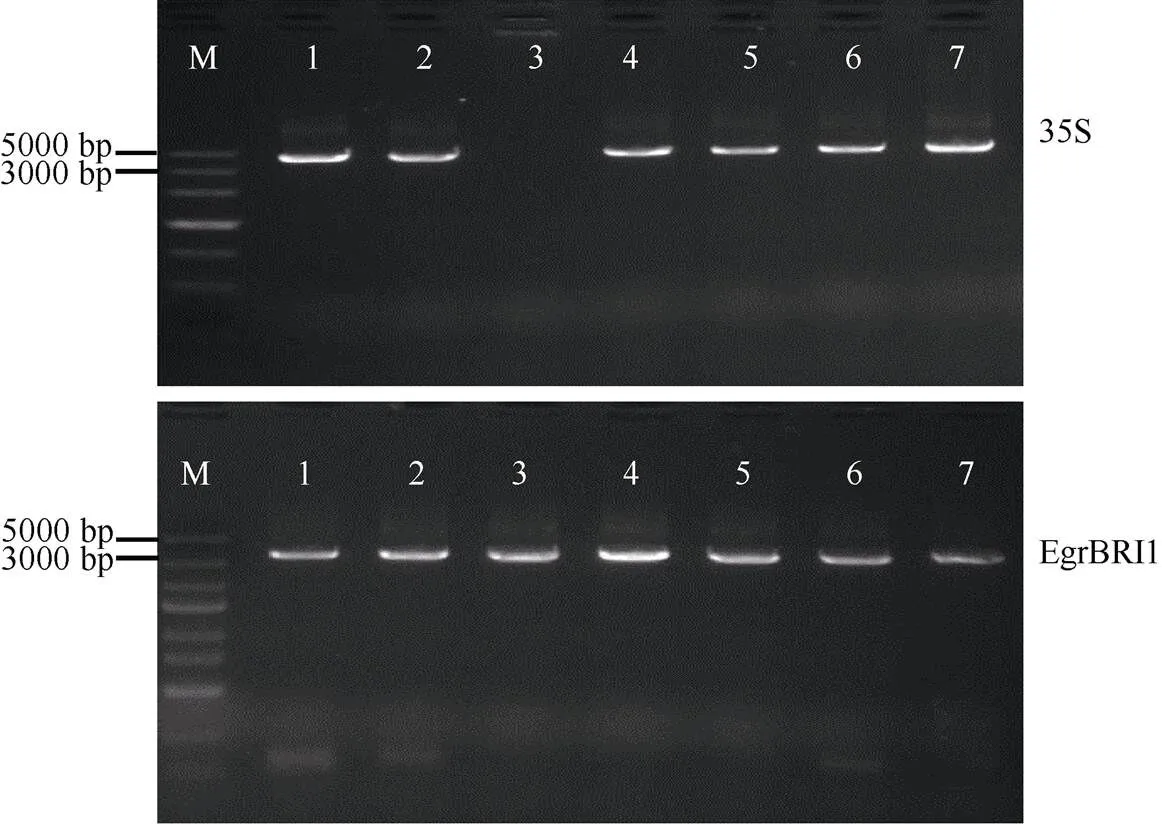
图5 EgrBRI1亚细胞定位载体构建检测
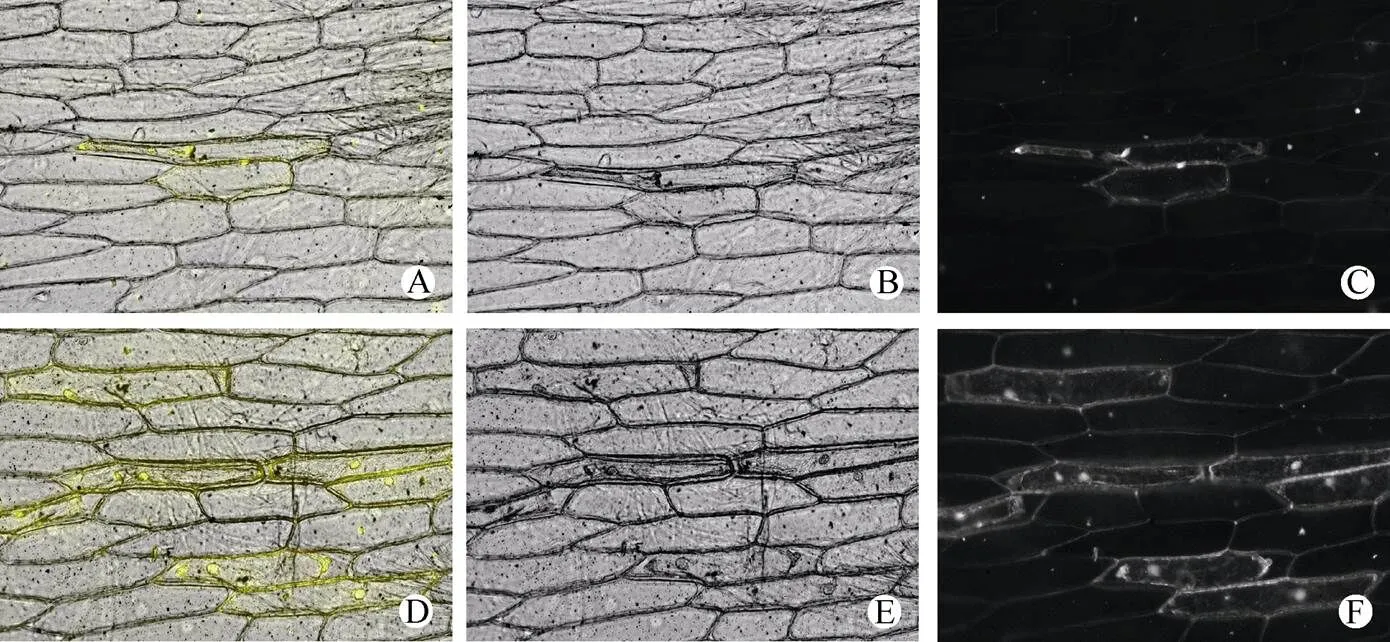
图6 EgrBRI1在洋葱表皮细胞中的定位。A: BRI1-YFP明场与荧光场叠加; B: BRI1-YFP明场; C: BRI1-YFP荧光场; D: YFP明场与荧光场叠加; E: YFP明场; F: YFP荧光场。
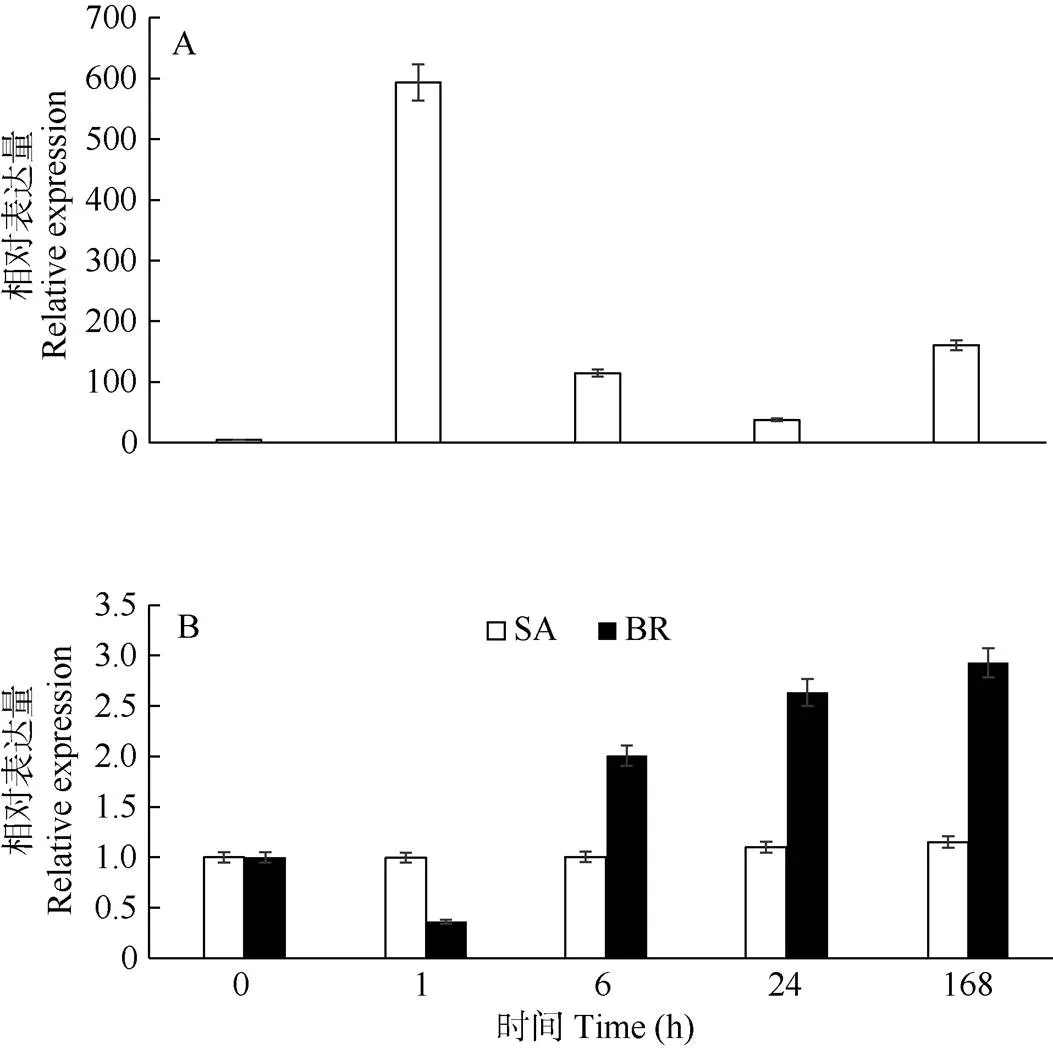
图7 茉莉酸甲酯(A)、水杨酸(B: SA)、油菜素内酯(B: BR)处理后巨桉叶片中EgrBRI1的相对表达量
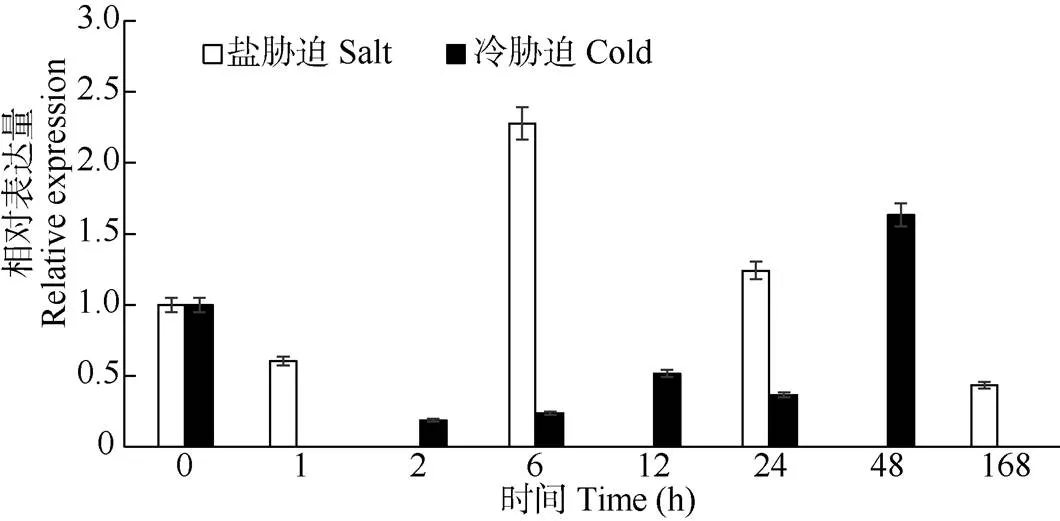
图8 盐和冷胁迫下巨桉叶片中EgrBRI1的相对表达量
植物的生长发育受植物激素的协同或拮抗作用共同调节,BR作为一种甾醇类新型植物激素参与到植物生长发育过程中,如种子萌发、开花、结实、解除逆境胁迫等。BR与其他植物激素间存在互作,共同调节植物的各个生长发育过程[21]。MeJA处理1 h的表达量是对照的593倍,表明JA与BR具有协同作用。张弦等[22]也报道,MeJA和BR处理能减轻强光对苹果()叶片的抑制作用。同时对水杨酸的刺激没有明显的响应,然而徐晓昀等[23]的研究却认为,外施水杨酸和BR能增强黄瓜()幼苗对低温的耐受性。这可能是不同物种的响应机制不同导致的。而外施BR 1 h的表达量略微降低,随后表达量显著升高,说明在桉树中作为BR的受体,能够明显响应BR。但在郝岭等[24]的研究提到,在玉米中过表达基因会恢复突变体的表型, 这是由于修复了突变体信号通路, Wang等[20]的研究也有相似的结论,这进一步证实了的表达受BR的调控。
同时,本研究结果还表明能对盐胁迫和冷胁迫做出应答。岳健敏等[25]研究提出,盐胁迫下外源添加BR能提高刺槐()叶片中叶绿体的数量,维持一定的光合作用,增强对盐胁迫的抗性,但并未对BR相关基因的表达进行研究。而本研究结果表明,盐处理6 h的表达量有明显上调,意味着BR对于盐胁迫的应答可能是通过表达来实现的。而冷胁迫处理48 h表达量为对照的1.6倍,表明能够响应冷胁迫。而吴进东[26]的研究也提出,BR能够增强植物抗寒性,主要是通过提高植物叶片抗氧化酶系统的活性。因此,我们推测基因可能通过响应BR来提高桉树的耐寒性,具体作用机制需要进一步研究。后续我们将构建启动子载体和超表达载体转化桉树,以期获得相应的转基因植株,通过表型分析等进一步完善基因的功能鉴定。
[1] XIA X J, HUANG L F, ZHOU Y H, et al. Brassinosteroids promote photosynthesis and growth by enhancing activation of rubisco and expression of photosynthetic genes in[J]. Planta, 2009, 230(6): 1185–1196. doi: 10.1007/s00425-009-1016-1.
[2] WANG M J, DENG B W, YANG G P. Research progress of brassino- steroid inand its application in crop breeding [J]. J Henan Agric Sci, 2015, 44(2): 1–6. doi: 10.15933/j.cnki.1004-3268. 2015.02.001.王梦姣, 邓百万, 杨国鹏. 拟南芥油菜素内酯的合成、修饰、信号转导及其在农作物育种中的应用研究进展 [J]. 河南农业科学, 2015, 44(2): 1–6. doi: 10.15933/j.cnki.1004-268.2015.02.001.
[3] NAKAMOTO D, IKEURA A, ASAMI T, et al. Inhibition of brassino- steroid biosynthesis by either amutation or a brassinosteroid biosynthesis inhibitor rescues defects in tropic responses of hypocotyls in themutant nonphototropic hypocotyl 4[J]. Plant Physiol, 2006, 141(2): 456–464. doi: 10.1104/pp.105.076273.
[4] HAO J J, YIN Y H, FEI S Z. Brassinosteroid signaling network: Impli- cations on yield and stress tolerance [J]. Plant Cell Rep, 2013, 32(7): 1017–1030. doi: 10.1007/s00299-013-1438-x.
[5] LI Y Y, CAO Q H. Mechanism of brassinosteroid involved in regulating plant development, stress resistance and its application in breeding [J]. J Agric Sci Technol, 2015, 17(2): 25–32. doi: 10.13304/j. nykjdb.2014.560.李元元, 曹清河. 油菜素内酯参与调控植物生长发育与抗逆性的机制及其育种应用研究 [J]. 中国农业科技导报, 2015, 17(2): 25–32. doi: 10.13304/j.nykjdb.2014.560.
[6] DHAUBHADEL S, BROWNING K S, GALLIE D R, et al. Brassino- steroid functions to protect the translational machinery and heat-shock protein synthesis following thermal stress [J]. Plant J, 2002, 29(6): 681–691. doi: 10.1046/j.1365-313X.2002.01257.x.
[7] ALI S S, KUMAR G B, KHAN M, et al. Brassinosteroid enhances resistance to fusarium diseases of barley [J]. Phytopathology, 2013, 103(12): 1260–1267. doi: 10.1094/PHYTO-05-13-0111-R.
[8] CLOUSE S D. Brassinosteroid signal transduction: From receptor kinase activation to transcriptional networks regulating plant development [J]. Plant Cell, 2011, 23(4): 1219–1230. doi: 10.1105/tpc.111.084475.
[9] LIU Q S, WANG G F. Subcellular trafficking of BRI1 receptors and its role in brassinosteroids signal transduction [J]. Chin J Cell Biol, 2018, 40(1): 108–115. doi: 10.11844/cjcb.2018.01.0214.刘沁松, 王桂凤. BRI1受体的胞内运输及其在油菜素甾醇信号转导中的作用 [J]. 中国细胞生物学学报, 2018, 40(1): 108–115. doi: 10. 11844/cjcb.2018.01.0214.
[10]JAILLAIS Y, HOTHORN M, BELKHADIR Y, et al. Tyrosine phospho- rylation controls brassinosteroid receptor activation by triggering membrane release of its kinase inhibitor [J]. Genes Dev, 2011, 25(3): 232–237. doi: 10.1101/gad.2001911.
[11] SHE J, HAN Z F, KIM T W, et al. Structural insight into brassino- steroid perception by BRI1 [J]. Nature, 2011, 474(7352): 472–476. doi: 10.1038/nature10178.
[12] ASGHARI M, ZAHEDIPOUR P. 24-Epibrassinolide acts as a growth- promoting and resistance-mediating factor in strawberry plants [J]. J Plant Growth Regul, 2016, 35(3): 722–729. doi: 10.1007/s00344-016- 9577-2.
[13] QI S X. Eucalypt introduction and development status in China [J]. Guangxi For Sci, 2006, 35(4): 250–252. doi: 10.3969/j.issn.1006-1126. 2006.04.016.祁述雄. 中国引种桉树与发展现状 [J]. 广西林业科学, 2006, 35(4): 250–252. doi: 10.3969/j.issn.1006-1126.2006.04.016.
[14] YIN Y F, JIANG X M, LÜ J X, et al. Status of resources and wood utilization of eucalyptus plantation in China [J]. China Wood Ind, 2001, 15(5): 3–5. doi: 10.3969/j.issn.1001-8654.2001.05.001.殷亚方, 姜笑梅, 吕建雄, 等. 我国桉树人工林资源和木材利用现状 [J]. 木材工业, 2001, 15(5): 3–5. doi: 10.3969/j.issn.1001-8654. 2001.05.001.
[15] SHEN J H, SONG D L, ZHAO Y J, et al.genomics and functional genomics [J]. Plant Physiol Commun, 2010, 46(1): 94–100. doi: 10.13592/j.cnki.ppj.2010.01.023.沈君辉, 宋东亮, 赵运军, 等. 桉树基因组和功能基因组 [J]. 植物生理学通讯, 2010, 46(1): 94–100. doi: 10.13592/j.cnki.ppj.2010.01. 023.
[16] WANG S N, SUN H Y, XU H, et al. Molecular characteristics and expression analysis of brassinolide receptor kinase genes in[J]. J Trop Subtrop Bot, 2018, 26(3): 215–223. doi: 10. 11926/jtsb.3818.王思宁, 孙化雨, 徐浩, 等. 毛竹油菜素内酯受体激酶基因的分子特征及表达模式分析 [J]. 热带亚热带植物学报, 2018, 26(3): 215– 223. doi: 10.11926/jtsb.3818.
[17] LI J Y, HAO Z Y, SHEN Y F, et al. Cloning and expression ofin[J]. J Trop Subtrop Bot, 2018, 26(6): 561– 570. doi: 10.11926/jtsb.3881.李嘉昱, 郝自远, 申宇芳, 等. 鹅掌楸基因的克隆和组织表达分析 [J]. 热带亚热带植物学报, 2018, 26(6): 561–570. doi: 10. 11926/jtsb.3881.
[18] YAO H R, ZENG B S, FAN C J, et al. Cloning and expression analysis ofin[J]. Chin J Trop Crops, 2016, 37 (7): 1341–1348. doi: 10.3969/j.issn.1000-2561.2016.07.016.姚海荣, 曾炳山, 范春节, 等. 巨桉基因克隆和初步表达分析 [J]. 热带作物学报, 2016, 37(7): 1341–1348. doi: 10.3969/ j.issn.1000-2561.2016.07.016.
[19] LIU M Y, ZHAO Y C, ZHAO DG. Cloning and bioinformatics analysis of brassinosteroid insensitive 1 gene in[J]. Genom Appl Biol, 2018, 37(4): 1582–1588. doi: 10.13417/j.gab.037.001582.刘明月, 赵懿琛, 赵德刚. 杜仲BR受体蛋白基因克隆及生物信息学分析 [J]. 基因组学与应用生物学, 2018, 37(4): 1582–1588. doi: 10.13417/j.gab.037.001582.
[20] WANG M, SUN S, WU C X, et al. Isolation and characterization of the brassinosteroid receptor gene () from[J]. Int J Mol Sci, 2014, 15(3): 3871–3888. doi: 10.3390/ijms15033871.
[21] LI Q F, LU J, YU J W, et al. Advances in molecular mechanisms of brassinosteroid-abscisic acid crosstalk coordinating plant growth and stress tolerances [J]. Plant Physiol J, 2018, 54(3): 370–378. doi: 10. 13592/j.cnki.ppj.2017.0510.李钱峰, 鲁军, 余佳雯, 等. 油菜素内酯与脱落酸互作调控植物生长与抗逆的分子机制研究进展 [J]. 植物生理学报, 2018, 54(3): 370–378. doi: 10.13592/j.cnki.ppj.2017.0510.
[22] ZHANG X, WANG Z B, NIE Y T, et al. Alleviation of photoinhibition by methyl jasmonate and brassinolide under strong light in apple leaves [J]. Acta Agric Boreali-Occid Sin, 2017, 26(6): 906–915. doi: 10.7606/ j.issn.1004-1389.2017.06.014.张弦, 王志博, 聂雅婷, 等. 茉莉酸甲酯和油菜素内酯减轻苹果叶片光抑制的生理机制研究 [J]. 西北农业学报, 2017, 26(6): 906–915. doi: 10.7606/j.issn.1004-1389.2017.06.014.
[23] XU X Y, YU J H, XIE J M, et al. Effects of exogenous salicylic acid and brassinolide on photosynthesis of cucumber seedlings under low temperature stress [J]. Chin J Appl Ecol, 2016, 27(9): 3009–3015. doi: 10.13287/j.1001-9332.201609.020.徐晓昀, 郁继华, 颉建明, 等. 水杨酸和油菜素内酯对低温胁迫下黄瓜幼苗光合作用的影响 [J]. 应用生态学报, 2016, 27(9): 3009– 3015. doi: 10.13287/j.1001-9332.201609.020.
[24] HAO L, ZHANG Y S, DUAN L S, et al. Cloning, expression and functional analysis of brassinosteroid receptor gene () fromL. [J]. Acta Agron Sin, 2017, 43(9): 1261–1271. doi: 10. 3724/SP.J.1006.2017.01261.郝岭, 张钰石, 段留生, 等. 玉米基因的克隆、表达及功能分析 [J]. 作物学报, 2017, 43(9): 1261–1271. doi: 10.3724/SP.J.1006. 2017.01261.
[25] YUE J M, ZHANG J C, YOU Y H, et al. Effects of brassinostreoids on photosynthesis and ultrastructure of chloroplasts inseedlings under salt stress [J]. J NW Agric For Univ (Nat Sci), 2017, 45(10): 56–66. doi: 10.13207/j.cnki.jnwafu.2017.10.008.岳健敏, 张金池, 尤焱煌, 等. 油菜素内酯对盐胁迫刺槐苗光合作用及叶绿体超微结构的影响 [J]. 西北农林科技大学学报(自然科学版), 2017, 45(10): 56–66. doi: 10.13207/j.cnki.jnwafu.2017.10.008.
[26] WU J D. Effects of brassinosteroids on the chilling resistance of[J]. Acta Bot Boreali-Occid Sin, 2015, 35(5): 985–990. doi: 10.7606/j.issn.1000-4025.2015.05.0985.吴进东. 油菜素内酯对霍山石斛抗冷性能的调控效应 [J]. 西北植物学报, 2015, 35(5): 985–990. doi: 10.7606/j.issn.1000-4025.2015.05. 0985.
Gene Cloning and Expression Analysis ofin
LI Xiao-dan, HU Bing, QIU Zhen-fei, FAN Chun-jie, YAN Hui-fang, ZENG Bing-shan*
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guagndong,Guangzhou 510520, China)
In order to understand the function ofgene in,gene was cloned, and the bioinformatics and subcellular localization of EgrBRI1 were analysis. Meanwhile, the expression ofgene were analyzed after treated with hormones and stresses by qRT-RCR. The results showed that the length ofgene was 3 893 bp, encoding 1 197 amino acids. EgrBRI1 protein was relatively stable with complex spatial structure, which contains three motifs. EgrBRI1 protein was mainly located in cell membrane. When treated with methyl jasmonate and brassinolide, the expression ofgene in leaves showed an up-regulated trend with the time, while there was no significant change by treated with salicylic acid. Under salt and cold stresses, the expression ofgene was down-regulated at first and then increased with the time. These indicated thatgene could respond quickly to applied hormone and play an important role in stress resistance of, which might be achieved by responding to BR signal.
; Brassinosteroid;gene; Gene expression
10.11926/jtsb.4044
2019–01–21
2019–03–12
国家自然科学基金项目(31400554)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31400554).
李晓丹(1995~ ),女,硕士研究生,专业方向为林木生物技术。E-mail: 924489727@qq.com
Corresponding author. E-mail:b.s.zeng@vip.tom.com

