青蒿素工业提取废料丙酮层中猫眼草黄素等3种多甲氧基黄酮富集研究
李 鑫,王可轩,李东辉,陈 靖
1哈尔滨商业大学药学院,哈尔滨 150076;2扬州大学医学院 转化医学研究院;3江苏省中西医结合老年病防治重点实验室,扬州 225001
多甲氧基黄酮(polymethoxylated flavones,PMFs)是一类含有多个甲氧基、低极性、具平面结构和强烈生物活性的黄酮类成分[1,2],主要存在于黄花蒿[3]、泽漆(俗称猫眼草)、岩筋菜、细花线纹香茶菜[4]。实验研究表明PMFs具有抗癌、抗炎、抗动脉粥样硬化、抗氧化、抗诱变等药理作用[5,6]。猫眼草黄素(chrysosplenetin,CHR)、蒿黄素(artemetin)、槲皮万寿菊素(quercetagetin-3,7,3′,4′-tetramethyl ether)是较常见的多甲氧基黄酮,化学结构见图1。文献报道黄花蒿叶片中的多甲氧基黄酮对青蒿素的抗疟活性具有明显增强作用[7];猫眼草黄素对手足口病主要病原体肠道病毒71(EV71)具有较强的抑制活性,能够有效抑制病毒RNA的合成[8];文献还报道其有较强的细胞毒性,能诱导细胞凋亡而具有抗癌活性[6]。本课题前期也发现CHR可能通过抑制青蒿素代谢相关肝代谢酶CYP3A和ABC转运体P-糖蛋白的活性,显著提高青蒿素生物利用度,提高青蒿素抗疟活性,显示出作为青蒿素耐药逆转剂的潜力[9-11],同时CHR不仅具有较强的抗肿瘤活性[6],且可能提高化疗药的敏感性。通过对黄花蒿不同生长期青蒿素及4种多甲氧基黄酮CHR、casticin、eupatin和artemetin含量分析[12],发现黄酮和青蒿素一样在盛蕾期含量最高,因此采集期一致,这为从青蒿素生产废料中获得CHR等多甲氧基黄酮奠定了重要理论基础,而通常在青蒿素原料药的工业化生产过程中,这些黄酮类成分都在复杂的除杂净化过程中,被当成杂质浪费掉了,并没有得到充分的利用。
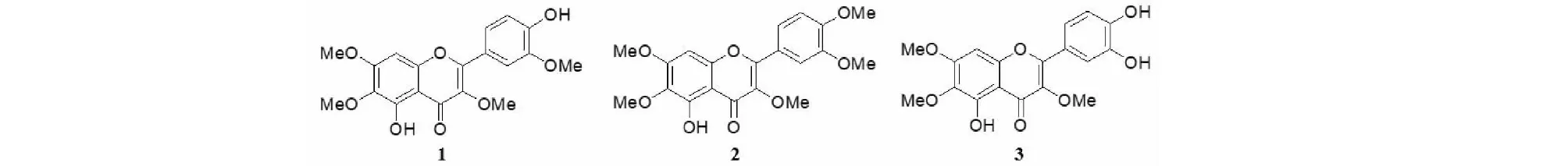
图1 化合物1~3的化学结构Fig.1 The chemical structures of compounds 1-3 注:1-猫眼草黄素;2-蒿黄素;3-槲皮万寿菊素。Note:1-CHR;2-artemetin;3-quercetagetin-3,7,3′,4′-tetramethyl ether.
化合物分子大小、极性大小、酸性强弱是黄酮类化合物分离纯化的重要依据。常用的分离方法包括pH梯度萃取法、HPLC色谱法、柱色谱法。其中柱色谱法又分为硅胶柱色谱、聚酰胺柱色谱、葡聚糖凝胶柱色谱、大孔树脂色谱法。多甲氧基黄酮的分离以柱色谱法运用最为广泛[13]。Yu等[14]运用高速逆流色谱法分离纯化青皮中六种PMFs;Liu等[15]采用大孔树脂分离纯化了陈皮中PMFs类化合物。本文结合大孔树脂、硅胶、凝胶柱色谱法,以含目标化合物的青蒿素工业生产废料丙酮层为原料,建立了3种活性多甲氧基黄酮化合物的精制纯化方法,既为后续的机制研究提供原料,也为青蒿素生产废料的循环再利用做出了有益的探索。
1 材料与仪器
1.1 样品
重庆华立控股股份有限公司提供青蒿素各段工业废料共五部分,包括石油醚层、石油醚-乙酸乙酯层、丙酮层、乙醇层、提取后残渣。各层性状:石油醚层、石油醚-乙酸乙酯层为油状,丙酮层、乙醇层为膏状,丙酮层为黄绿色,乙醇层颜色略深。
以自制CHR(1)、artemetin(2)、quercetagetin-3,7,3′,4′-tetramethyl ether(3)(沈阳药科大学天然药物化学系提供,纯度大于98%,编号分别为200901、200902、200903)为对照品,RP-HPLC-DAD监测发现只有丙酮层检测到目标化合物。
1.2 材料与试剂
HPD-100大孔树脂、薄层层析硅胶GF254、柱层析硅胶(200~300目)、Sephadex LH-20均购自青岛海洋化工厂分厂;色谱甲醇、乙腈购自美国Fisher公司;二氯甲烷、甲醇、丙酮、石油醚均为分析纯;乙醇为工业级。
1.3 仪器
日立L-2000高效液相色谱仪(日立高新技术有限公司);R206型旋转蒸发仪(上海申生科技有限公司);R206型旋转蒸发仪(上海申生科技有限公司);循环水式多用真空泵(郑州长城科工贸有限公司);ZK-82B型真空干燥箱(上海市实验仪器总厂);DHG-9075A型电热鼓风干燥箱(上海一恒科学仪器有限公司);AL-104电子天平(美国METTLER TOLEDO);KQ-500B型超声波清洗器(昆山市超声仪器有限公司)。
2 实验方法
2.1 溶液的配制
标准溶液的配制:分别精密称取CHR、artemetin、quercetagetin-3,7,3′,4′-tetramethyl ether对照品各10 mg,置于10 mL容量瓶中,加入甲醇溶解,摇匀,稀释至刻度,分别配制成1.0 mg/mL的储备液,置4℃冰箱内储存备用。
2.2 色谱条件
色谱柱:Waters C18(4.6 mm × 250 mm,5 μm);流动相A:乙腈-B:水(V/V),采用梯度洗脱:0~30 min,30%A;30~35 min,30%~60%A;35~38 min,60%~100%A,38~45 min,100%~30%A;流动相用0.45 μm微孔滤膜过滤,超声20 min脱气;流速:1 mL/min;柱温:35 ℃;检测波长254 nm;进样量10 μL。
2.3 黄酮的分离纯化工艺
2.3.1 除色素方法选择
丙酮层各取1 g,分别用3 g SiO2gel、3 g MgO、3 g polyamide、5 g HPD-100(60~100目)处理,选择除色素方法,结果表明HPD-100处理速度快,样品损失少为最佳除色素法。
2.3.2 精制条件初筛
取浸膏约2 g,经HPD-100(60~100目)大孔树脂处理,分别以60%、70%、80%、90%乙醇,100%甲醇和氯仿洗脱,90%乙醇和100%甲醇洗脱物有大量絮状沉淀析出,分别过滤,甲醇洗涤沉淀后,用氯仿溶解。各馏分采用RP-HPLC-UV分析,追踪目标化合物。
取约500 mg HPD-80%洗脱物,3 g硅胶拌样,10 g空白硅胶上样,石油醚-丙酮-乙酸乙酯梯度洗脱,HPLC跟踪结果表明16∶1∶1至12∶1∶1部分有目标化合物。
2.3.3 精制条件确定
2.3.3.1 HPD大孔树脂分离
按照前期摸索工艺,取丙酮层浸膏150 g,氯仿溶解,150 g HPD-100(60~100目)拌样,挥干,上HPD-100大孔树脂,树脂用量湿重2 kg,分别用60%、70%、80%、90%EtOH/H2O依次进行洗脱(EtOH/H2O浓度为V/V),减压回收溶剂。各馏分以HPLC-UV进行追踪分析。
取丙酮层浸膏约150.0 g,加入适量二氯甲烷,超声至完全溶解,备用。150 g HPD-100(60~100目)拌样,挥干。取HPD-100(60~100目)大孔树脂置烧杯中,树脂用量湿重2 kg,加入乙醇,浸泡0.5 h。将浸泡后的大孔树脂移至层析柱中,反复用乙醇冲洗。
2.3.3.2 上样洗脱
待层析柱中大孔树脂沉降好后,沿柱壁慢慢加入样品,分别用60%、70%、80%、90% EtOH/H2O梯度洗脱。收集层析柱各馏分,每瓶接样500 mL,减压回收洗脱溶剂。通过TLC追踪进行样品合并,以HPLC进行定性鉴别。
2.3.3.3 硅胶柱层析
含有目标化合物的样品:分别采用氯仿-甲醇、氯仿-丙酮、石油醚-丙酮溶剂系统进行分离,最终确定石油醚-丙酮系统。取含有目标化合物的洗脱部分,加入适量二氯甲烷,超声至完全溶解,备用。称取硅胶70 g,加入石油醚浸泡0.5 h,挥干溶剂,分次加入样品液,搅拌混匀。充分研磨,挥干溶剂,得黄色粉末,备用。
称取硅胶(200~300目)约700 g,105 ℃活化30 min。加入石油醚浸泡约0.5 h,不断用玻璃棒搅拌,使硅胶充分溶涨,备用。将溶涨后的硅胶注入层析柱中,并不断搅拌。石油醚冲洗硅胶柱,静置过夜,备用。
待层析柱中硅胶沉降好后,缓慢加入样品。洗脱体系为石油醚∶丙酮(100∶0~0∶100)。收集层析柱各馏分,保留体积约400 mL,减压回收洗脱溶剂。洗脱液经薄层色谱检测,合并组成相似的馏分,显色试剂为10%硫酸-乙醇溶液。
2.3.3.4 凝胶柱层析
称取Sephadex LH-20约100 g,置烧杯中,加入甲醇,并不断用玻璃棒轻轻搅拌,静置过夜。在搅拌下快速将泡好的Sephadex LH-20移置层析柱中,反复利用甲醇冲洗凝胶柱,静置12 h,备用。
待层析柱中凝胶沉降好后,且层析柱中无气泡,打开活塞放甲醇至液面为0.5~1 cm处。湿法上样,将准备好的样品用少量适宜溶剂溶解,用胶头滴管将样品转移至层析柱内,加入甲醇进行洗脱,TLC追踪并合并相同馏分。
经过反复硅胶柱层析、凝胶柱层析、薄层层析等多种分离手段进行分离,得到纯度较高的化合物1~3,具体分离流程如下:丙酮层150 g,HPD-D101大孔树脂梯度洗脱(100~200目)得到含目标化合物的70%EtOH/H2O洗脱物99 g,经硅胶柱层析(200~300目),石油醚-丙酮梯度洗脱,其中100∶13部位黄色粗结晶A经Sephadex LH20纯化得到化合物1(1 000 mg),100∶15部位黄色粗结晶B经Sephadex LH20纯化得到化合物2(3 000 mg),100∶20部位黄色粗结晶C经Sephadex LH20纯化得到化合物3(500 mg)。
2.3.8 样品检识
毛细管吸取少量样品溶液,点在硅胶薄层层析板上,选用合适的展开系统进行展开,晾干,用10%的浓硫酸乙醇溶液显色,在紫外灯下观察荧光。若在薄层层析硅胶板上显示为单一斑点,则应选至少用2种不同系统的溶剂系统展开,在薄层层析硅胶板上进行检识,若仍显示为单一斑点,可初步判定该化合物为单体化合物。若在薄层层析硅胶板上显示的为多个斑点,则需继续选用合适的硅胶、Sephadex LH-20柱色谱等分离纯化手段继续进行分离,直至点样在硅胶层析薄层板上显示为单一斑点。
3 实验结果
3.1 各馏分HPLC-UV色谱图
由图2可知,以自制化合物1~3为对照品,HPD-100大孔树脂的60%、70%、80%、90% EtOH/H2O洗脱部分经HPLC分析,在254 nm波长下,70%乙醇洗脱物中目标化合物峰面积较大,60%、80%乙醇洗脱物中化合物1~3峰面积均较小,而90%乙醇洗脱物中无目标化合物。
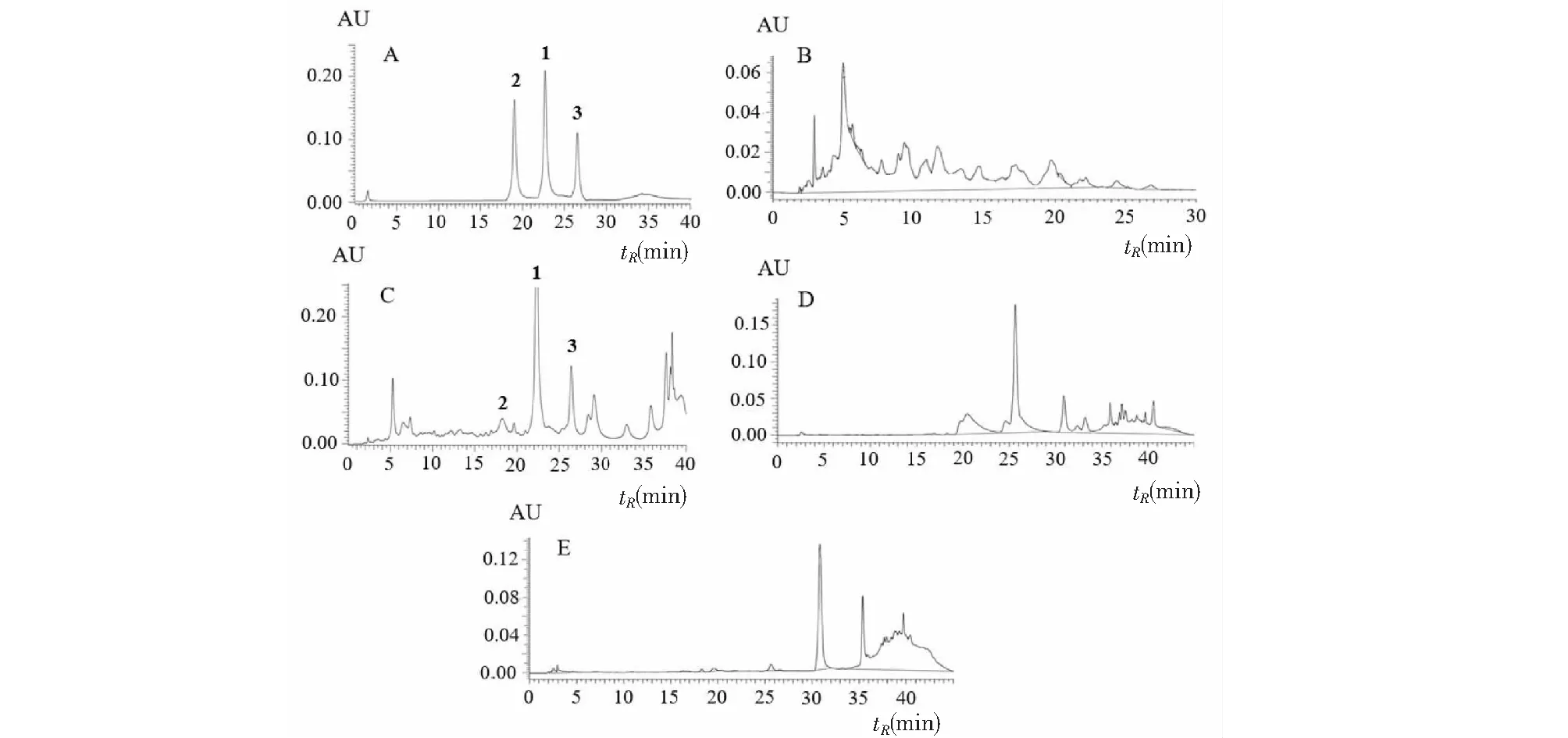
图2 RP-HPLC-UV色谱图Fig.2 RP-HPLC-UV chromatograms 注:A-对照品;B-60%洗脱物;C-70%洗脱物;D-80%洗脱物;E-90%洗脱物;1-猫眼草黄素;2-蒿黄素;3-槲皮万寿菊素。Note:A-standard substances;B-60% eluate;C-70% eluate;D-80% eluate;E-90% eluate;1-CHR;2-artemetin;3-quercetagetin-3,7,3′,4′-tetramethyl ether.
3.2 精制条件确定
共得到HPD-100大孔树脂60%洗脱部分约70 g,70%洗脱部分约99 g,80%洗脱部分约40 g,95%洗脱部分约30 g。
经硅胶柱层析100∶13馏份有黄色结晶(化合物1),100∶15馏份有黄色结晶(2),100∶20馏份有黄色结晶(3),反复重结晶后,经1H NMR、13C NMR确定与文献报道分别与artemetin(1)、CHR(2)、quercetagetin-3,7,3′,4′-tetramethyl ether(3)化学位移一致,分别得到artemetin 约1 000 mg、CHR约3 000 mg、quercetagetin-3,7,3′,4′-tetramethyl ether约500 mg(纯度≥95%)。
3.3 结构确定
化合物1淡黄色结晶(丙酮);mp.182~183 ℃;UV(MeOH)λmax(logε)253,268,350 nm; +AlCl3,260,272,365 nm;+NaOH,241,265,389 nm;+NaOCH3,245,259,393;+NaOCOCH3,255,357,410 nm;IR(KBr)νmax3 530,2 940/2 840,1 658,1 600 cm-1;1H NMR(DMSO-d6,600 MHz)δ:6.92(1H,s,H-8),7.66(1H,d,J=2.0 Hz,H-2′),6.94(1H,d,J=8.5 Hz,H-5′),7.61(1H,dd,J=8.5,2.0 Hz,H-6′),12.62(5-OH),9.95(4′-OH),3.91(-OCH3),3.72(-OCH3),3.80(-OCH3),3.86(-OCH3);13C NMR(DMSO-d6,150 MHz)δ:155.9(C-2),137.9(C-3),178.3(C-4),151.9(C-5)*,131.7(C-6),158.8(C-7),91.6(C-8),151.8(C-9)*(*代表可以互换),105.7(C-10),120.8(C-1′),112.2(C-2′),147.6(C-3′),150.0(C-4′),115.8(C-5′),122.5(C-6′),60.2(-OCH3),59.8(-OCH3),56.6(-OCH3),55.9(-OCH3);EI-MS:m/z375 [M+H]+,373[M-H]-。以上数据与文献[16]中发表的光谱数据对照,基本一致,故确定为chrysoplenetin。
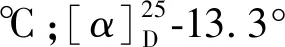
化合物3黄色短针状结晶(丙酮);mp.311~313 ℃;UV(MeOH)λmax(logε)257,274(sh),362 nm;+NaOMe,245,304,390 nm;+AlCl3/HCl,255,308(sh),338 nm;+AlCl3,272,435 nm;+NaOAc,286,404 nm;+NaOAc/H3BO3,263,382 nm;1H NMR(CDCl3,600 MHz)δ:12.60(5-OH),5.73(6-OH),7.72(1H,dd,J=8.6,1.8 Hz,H-6′),7.68(1H,d,J=1.8 Hz,H-2′),6.96(1H,d,J=8.6 Hz,H-5′),6.51(1H,s,H-8),4.00(4′-OCH3),3.96(7-OCH3),3.92(3-OCH3),3.88(3′-OCH3);13C NMR(CDCl3,150 MHz)δ:178.6(C-4),158.4(C-7),155.2(C-2),152.3(C-5),151.9(C-9),148.4(C-4′),145.1(C-3′),138.6(C-3),131.9(C-6),123.2(C-1′),121.2(C-6′),113.9(C-2′),110.0(C-5′),106.2(C-10),89.9(C-8),60.5(-OCH3),59.8(-OCH3),55.9(-OCH3),55.7(-OCH3);EI-MS:m/z318[M+H]+。以上数据与文献中发表的光谱数据[18-20]对照,基本一致,故确定为quercetagetin-3,7,3′,4′-tetramethyl ether。
4 结论
本部分采用大孔树脂、硅胶、葡聚糖凝胶、薄层层析等多种色谱手段,对青蒿素工业废渣丙酮层进行了系统分离和纯化,得到了纯度大于98%的CHR(1)、artemetin(2)、quercetagetin-3,7,3′,4′-tetramethylether(3);采用HPLC法对60%、70%、80%、90%的乙醇洗脱物进行检测,与对照品相比发现60%的洗脱物中目标化合物峰面积较小,杂质峰较多,主要是一些苷类和极性较大的苷元。70%乙醇洗脱物中CHR 峰面积较大,同时利用70%的洗脱部分,筛选了二氯甲烷-甲醇、氯仿-丙酮、石油醚-乙酸乙酯、石油醚-丙酮4种溶剂系统,最终确定石油醚-丙酮溶剂系统,此分离系统对样品的分离效果较好。
用大孔树脂富集得到70%乙醇洗脱物,经反复硅胶柱层析、凝胶柱层析得到高纯度的CHR单体。在青蒿素原料药工业化生产过程中,CHR等黄酮类化合物在除杂进化过程中,被当成杂质除去了。如果能够对青蒿素工业生废料进行有效的循环再利用,可以变废为宝,降低用药成本,在资源的开发利用方面具有重要的意义。

