IL-28B基因rs12979860基因多态性与慢性丙型肝炎转归的关系
蔡博 刘晓丹 王小青
据世卫组织报道,全球丙型肝炎感染者占比约为3%,慢性感染者高达1.7亿,其中自发性清除者约为20%~30%,持续感染者约为70%~80%[1]。若未能及时治疗,在持续病毒感染的情况下极易进展为肝硬化,甚至引起肝细胞癌,增加死亡率。IL-28B以IFN-λ3为表达产物,它能将JAK-STAT通路激活,并调节机体免疫。近年来,研究发现IL-28B基因多态性可能与慢性丙型肝炎(CHC)自发清除效果存在关联,但其与肝功能、脂代谢转归的关系尚未明确[2]。本研究旨在分析IL-28B基因rs12979860位点多态性与CHC转归的关系,为该病治疗提供新的治疗方向,现报道如下。
资料与方法
一、一般资料
选取山东省聊城市第二人民医院2014年8月—2017年8月收治的CHC患者130例,均给予抗病毒治疗。其中男69例,女61例,年龄30~72岁,平均(49.76±14.39)岁;体质指数18~25 kg/m2,平均(21.32±2.14)kg/m2;病程2~7年,平均(4.34±1.32)年;家族史:有26例,无104例;HCV基因型:Ib型118例,非Ib型12例;饮酒史:有41例,无89例。研究方案获得本院伦理委员会批准。
二、诊断标准[3]
(1)有CHC症状体征,包括恶心、腹胀、发热、黄疸等;(2)HCV阳性≥6个月;(3)HCV RNA呈阳性;(4)血清检查提示谷草转氨酶(AST)、谷丙转氨酶(ALT)增高。
三、纳入与排除标准
(1)纳入标准 ①临床诊断明确;②接受12个月的抗病毒干预;③既往无免疫调节剂应用史;④知情同意。
(2)排除标准 ①合并甲亢、恶性肿瘤;②妊娠、哺乳期妇女;③肝硬化;④因酒精、药物所致肝病;⑤糖尿病;⑥高血压;⑦精神病史。
四、方法
(1)分组方法 根据患者12个月后的抗病毒疗效,分为转归良好组、转归不良组。评价标准[3]:①转归良好:经干扰素等干预12个月,获得部分病毒学应答或完全应答;②转归不良:经干扰素等干预12个月,未能获得病毒学应答。
(2)基因多态性测定 主要试剂包括PCR引物、琼脂糖、乙醇、DNA提取试剂盒、探针。主要仪器为离心机、电泳仪、水浴槽、分光光度计、成像系统、移液器、PCR仪。DNA提取:①采集4 mL静脉血,抗凝;②取20 μL蛋白酶K加入,加200 μL结合液,混匀,水浴(恒温70℃)10 min,待其颜色变得清亮;③取异丙醇200 μL,混匀,于收集管内置入吸附柱,倒入反应溶液,离心30 s(10 000 rmp);④弃废液,取去除液400 μL倒入,离心30 s(12 000 rmp);⑤再次弃废液,取漂洗液600 μL倒入,离心30 s(12 000 rmp);⑥再次弃废液,下调水浴箱温度(68 ℃),加漂洗液500 μL,离心30 s(12 000 rmp);⑦弃废液,离心120 min(11 000 rmp),彻底清除漂洗液;⑧取新的离心管,置入吸附柱,对洗脱缓冲液进行预热,取50 μ洗脱缓冲液倒入,室温下等待3 min,离心60 s(12 000 rmp),将溶液置于吸附柱,反应2 min,离心60 s(10 000 rmp)。
完成DNA提取后,取1 μL样本行质量鉴定,给予凝胶电泳,并稀释为5~10 ng/μL。具体如下:①按照所需量对琼脂糖粉进行称重,并倒入电泳缓冲液;②将溶液加热使其完全溶解,时间为2 min,溶液变成透明色;③冷却,使溶液降至60 ℃,按照1 μL/1 mL比例取溴化乙锭EB加入,混匀;④倒入橡胶胶膜(内含梳子),观察梳子齿间、齿下有无气泡;⑤等待凝固,时间为25~30 min,将梳子撤除,使凝胶入电泳槽;⑥取电泳缓冲液加入,直到其高于胶面1 mm;⑦取样品2 μL倒至样品槽;⑧经成像系统进行分析,并获得图像。本研究主要分析rs12979860位点,包括TT、CT、CC三种基因型。
(3)血清学测定 在入院当天采集静脉血4 mL,离心20 min,转速为3 000 r/min,分离血清,测定血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TB)、白蛋白(Alb)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)水平,仪器为日本东芝TBA-40FR全自动生化分析仪。
五、统计学方法
结 果
一、患者转归情况分析
在130例患者中,转归良好101例,占77.69%,转归不良29例,占22.31%。根据疗效分成转归良好组、转归不良组。
二、rs12979860分型与预后的关系
转归良好组CC型90(89.11)例,CT型11(10.89)例,转归不良组CC型17(58.62)例,CT型12(41.38)例。转归良好组CC型占比高于转归不良组(χ2=14.382,P=0.000),见表1。
三、两组肝功能、脂代谢比较
转归良好组的HDL高于转归不良组,其余各指标低于转归不良组(P<0.05),见表1。
四、rs12979860分型与肝功能、脂代谢的关系
据表2得知CC型107例,CT型23例。CC型患者血清HDL高于CT型,其余各指标低于CT型(P<0.05),见表2。
讨 论
本研究发现130例患者经抗病毒干预后,有101例疗效良好,且疗效良好者的rs12979860位点CC基因型占比高于疗效不良者,提示其基因分型可能影响CHC抗病毒疗效。rs12979860是IL-28B基因的一个位点,有研究提示IL-28B基因变异对病毒性肝炎疗效影响较大,带有保护性基因的病毒学应答率高于无保护性基因者[4]。然而,既往研究关于IL-28B基因对抗病毒疗效的影响机制尚未完全明确。从本研究结果来看,在IL-28B基因位点中,rs12979860位点的CC基因型为保护性基因,具有宿主保护功能。有学者发现该位点的CC基因型能反映肝小叶炎症程度,它可降低肝细胞脂肪变性风险,对肝脏有保护作用[5],这为本研究开展提供了理论依据。研究表明在欧裔美洲人中,该位点CC基因型占比约33%,而亚洲人群的该位点CC基因型占比非常高,如日本约为84%,这类患者的预后往往也更为理想[6]。本研究也证实CHC患者rs12979860位点以CC基因型为主,且预后较好。因此,在日后的治疗中,医师可通过测定该位点的基因分型预测预后。
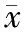
表1 两组肝功能、脂代谢比较(±s)
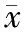
表2 rs12979860分型与肝功能、脂代谢的关系(±s)
通过观察两组患者的肝功能、脂代谢,发现转归良好组的肝功能、脂代谢改善较转归不良组更显著,与既往研究[7]基本相符。本研究创新之处在于分析rs12979860分型与肝功能、脂代谢的关系,发现带有CC基因型的患者肝功能、脂代谢改善较带有CT基因型的患者更显著。研究表明CHC患者肝功能、脂代谢异常可能与机体炎症反应有关,随着机体炎症反应越重,对肝功能损害越重,脂代谢紊乱更难以纠正[8]。另有研究提示rs12979860位点的CC基因型能影响肝脏炎症程度,在肝脏出现炎症前,该位点CC基因型便能提前预测,有利于保护肝脏[9]。因此,笔者推测带有CC基因型的患者可能因对肝脏有保护作用,从而缓解炎症,更利于改善肝功能与脂代谢。研究表明IFN-λ3作为IL-28B的表达产物,当IL-28B基因多态性改变后,IFN-λ3也会发生相应变化,而IFN-λ3具有调节免疫的作用,且具备抗病毒功能[10]。鉴于此,笔者推测CC基因型对肝脏的保护作用可能与IFN-λ3的免疫调节、抗病毒作用相关。
综上,IL-28B基因rs12979860位点的基因分型与CHC患者转归密切相关,其中带有CC基因型的患者转归更好,它对改善肝功能、脂代谢有益,临床可据此研究出新的治疗方向。此外,本研究也有不足,如仅选取130例样本,病例数少,未来将扩大样本量分析其他位点的基因分型情况。

