外周血γδT细胞在评估Peg-IFN α-2a治疗慢性乙型肝炎效果中的应用价值
支星 颜学兵
近年来,聚乙二醇干扰素(Peg-IFN)α-2a在慢性乙型肝炎(CHB)治疗中被应用,与常规α-干扰素相比,Peg-IFN α-2a的耐药率更低,疗效更可靠[1-2]。γδT细胞是比较特殊的一类T淋巴细胞,其组成部分包括γ链与δ链,既往有研究发现,γδT细胞在外周血中的异常表达参与了肝炎进展过程,如对慢性丙型肝炎患者而言,其外周血γδT细胞持续异常与肝脏炎症程度密切相关[3]。本研究分析外周血γδT细胞在评估Peg-IFNα-2a治疗CHB效果中的应用价值,旨在进一步了解Peg-IFN α-2a的临床疗效及外周血γδT细胞对CHB疗效的影响。
资料与方法
一、一般资料
回顾性分析我院2016年4月—2018年4月收治的106例CHB患者的临床资料,其中男59例,女47例,年龄32~74岁,平均(52.53±12.16)岁;病程1~5年,平均(3.41±1.37)年;肝纤维化程度:S1期15例、S2期41例、S3期38例、S4期12例;炎症程度:G1级14例、G2级45例、G3级35例、G4级12例。
二、纳入与排除标准
(一)纳入标准 (1)参考相关诊断标准确诊为CHB[4],诊断明确;(2)入院前6个月内无抗病毒治疗史;(3)病例资料完整;(4)入院后接受Peg-IFNα-2a治疗;(5)遵循医嘱定期入院复查。
(二)排除标准 (1)合并血液性疾病;(2)糖尿病患者;(3)既往有精神病史、神经病史;(4)妊娠、哺乳期妇女;(5)肾、心、脑等器官损害;(6)其他类型的肝病,如甲型肝炎、丙型肝炎等。
三、方法
(一)治疗方法 所有患者均给予Peg-IFNα-2a(派罗欣,罗氏制药,国药准字J20120075)治疗,每次180 μg派罗欣皮下注射,每周1次,治疗12个月。在治疗期间,患者每隔3个月入院复查一次,必要情况下进行降酶药物干预,期间不采用其他药物治疗。
(二)检测方法
1.乙型肝炎病毒DNA(HBV DNA)检测:选取3 mL空腹静脉血,经高压灭菌后置于EP管内,利用实时荧光定量PCR法测定血清HBV DNA水平,试剂盒源于生工生物,严格根据试剂盒完成操作。反应条件:37 ℃ 120 s,94 ℃ 120 s,(93 ℃ 15 s,60 ℃ 40 s,循环40次)。
2.外周血γδT细胞检测:主要仪器为酶标仪(生工生物)、培养箱(上海森信)、流式细胞仪(贝克曼),主要试剂为小牛血清(江苏宝莱)、酶联免疫试剂盒(生工生物)、rhIL-2(江苏宝莱)、RPMI1640(江苏宝莱)。采集4 mL空腹静脉血抗凝,将单个核细胞分离出来,经磷酸盐缓冲液进行洗涤,对白细胞予以收集,使其浓度为1 106个/mL,接入24孔板进行培养,分别加入IPP、rhIL-2,其中rhIL-2每隔2 d补加一次。按照细胞具体的增殖状态分孔培养。经Hanks液体进行3次冲洗,使细胞浓度调整为5 106个/mL,取细胞悬液100 μL加入流式管,取0.5 μg抗人TCR-γδ-FITC加入,充分混合,在4 ℃条件下反应30 min,离心、洗涤,经流式细胞仪测定。
四、观察指标
根据患者治疗12个月后的临床疗效分为病毒学应答组、病毒学无应答组,比较病毒学应答组、病毒学无应答组的外周血γδT细胞、HBV DNA水平。病毒学应答[4]:采取荧光PCR法检测HBV DNA,<300拷贝/mL则为病毒学应答,其他为无应答。
五、统计学方法
结 果
一、106例患者的治疗效果分析
在106例CHB患者中,病毒学应答85例(80.19%),病毒学无应答21例(19.81%)。
二、两组外周血γδT细胞、HBV DNA水平比较
治疗前,病毒学应答组、病毒学无应答组的外周血γδT细胞分别为(5.62±0.98)%、(5.60±0.95)%,治疗后分别为(2.39±0.62)%、(5.58±0.91)%。治疗前,病毒学应答组、病毒学无应答组的HBV DNA分别为(6.43±1.02)lg拷贝/mL、(6.45±1.04)lg拷贝/mL,治疗后分别为(3.32±0.73)lg拷贝/mL、(6.41±0.99)lg拷贝/mL。两组治疗前外周血γδT细胞、HBV DNA比较差异无统计学意义(P>0.05),病毒学应答组治疗后外周血γδT细胞、HBV DNA低于治疗前及病毒学无应答组(P<0.05)。
三、外周血γδT细胞对CHB疗效的评估价值分析
外周血γδT细胞评估CHB疗效的曲线下面积为0.653(标准误=0.061,P=0.012,95%CI=0.534~0.772),最佳截断值为4.11%,敏感度为60.06%,特异度为58.90%。ROC曲线见表1。
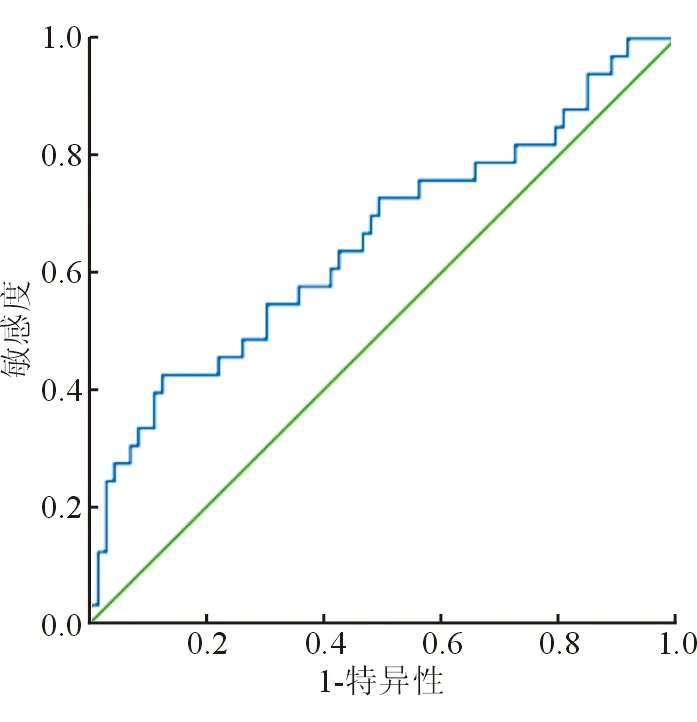
图1 外周血γδT细胞评估CHB疗效的ROC曲线
讨 论
约1%~5%CHB患者发展成原发性肝癌[5]。为了改善患者预后,本研究针对CHB患者采用Peg-IFNα-2a治疗,结果提示在106例患者中,总病毒学应答率为80.19%,与相关研究结论基本吻合[6]。Peg-IFNα-2a将普通干扰素、聚乙二醇相结合,可促使干扰素药物特性出现变化,延长半衰期,提高血药浓度的稳定性,能更持久地抑制HBV DNA,每周给药1次即可,且治疗安全性高。研究表明Peg-IFN α-2a的病毒抑制效果优于普通干扰素,且不会增加不良反应[7]。这进一步证实该药在CHB中适用。
本研究提示,病毒学应答组治疗后的外周血γδT细胞、HBV DNA水平较治疗前明显降低,且低于病毒学无应答组,提示二者在血液中的表达水平与患者的临床疗效密切相关。有研究者以慢性丙型肝炎患者为研究对象,发现γδT细胞在这类患者外周血中呈高表达,抗病毒干预时间越长,患者的外周血γδT细胞水平越低[8]。本研究通过绘制ROC曲线,证实外周血γδT细胞对CHB患者的抗病毒疗效也具有评估价值,创新之处在于明确了曲线下面积、最佳截断值以及相应的敏感度、特异度,提示以外周血γδT细胞>4.110%时,患者经Peg-IFN α-2a治疗病毒学无应答的风险越高。
本研究发现CHB患者的外周血γδT细胞与HBV DNA呈正相关,表明随着外周血γδT细胞水平越高,患者HBV DNA也相应增加,提示病情越重。在经Peg-IFN α-2a治疗后,患者的外周血γδT细胞水平下调,HBV DNA也相应下调,提示病情缓解。基于此,临床医师可将外周血γδT细胞、HBV DNA共同作为评估CHB患者病情的重要指标,便于进一步评估临床疗效,改善预后。

