胃肠道间质瘤的临床病理探讨
乐小莉,章婷,袁娟
东南大学附属中大医院溧水分院南京市溧水区人民医院病理科,江苏南京 211200
胃肠道间质 瘤 (gastrointestinal stromal tumor,GIST)是消化道最常见的间叶组织起源肿瘤,临床表现从良性到恶性,免疫组化检查通常表达CD117 和DOG1,显示卡哈尔细胞(Cajal cell)分化,多数病例伴有C-KIT 或PDGFRA 的活化突变[1]。选择2014—2018年在该院收治的胃肠道间质瘤20 例患者作为研究对象,进行其临床病例的探讨,报道如下。
1 资料与方法
现以该院诊断的20 例胃肠道间质肿瘤病例作为研究对象,对其进行病理观察,所有标本均采用3.7%的中性甲醛固定,常规脱水,石蜡包埋及4 μm 厚连续切片,进行HE 染色及免疫组化检查。免疫组化采用EnVision 两步法进行,操作步骤按试剂盒说明书进行。兔抗人单克隆抗体CD117、DOG-1,鼠抗人单克隆抗体CD34 购自上海基因科技有限公司。EnVision 试剂盒、DAB 显色试剂盒购自上海基因科技有限公司[2]。
2 结果
①该组20 例胃肠道间质瘤患者,来自内镜活检标本或手术切除标本。 内镜标本2 例,手术切除标本18 例,年龄最大者81 岁,最小者40 岁,平均年龄62.2 岁;男性13 例,女性7 例,发生于胃13 例,小肠6 例,腹腔1 例。
②大体特点:收集所有肿瘤标本,肿瘤大小0.9~14 cm 不等(除内镜活检标本外),≤2 cm 者7 例,2~5 cm者3 例,>5 cm 者10 例肿瘤多呈结节状,位于胃壁或肠壁,肿瘤大多切面实性、灰白色,少数伴出血、囊性变、坏死[3]。
③组织学特点:该组大多数肿瘤以梭形细胞为主,主要呈短束状或漩涡状,编织状或鱼骨样排列(图1),部分病例可见上皮样细胞形态(图2),或呈菊形团样(图3)、神经鞘瘤样(图4)、围血管呈套样结构(图5),间质可伴有粘液变(图6)、玻璃样变或钙化(图7)。低危进展的肿瘤中,通常瘤细胞密度低,梭形细胞纤细,呈束状或编织状,异型性小,核分裂罕见,常伴玻璃样变,而高危进展的肿瘤中瘤细胞明显密度增高,梭形细胞肥胖或呈卵圆形,核深染、核浆比增高,异型性明显,核分裂增多,可见出血、凝固性坏死(图8),或呈明显的肉瘤样改变[4]。
④免疫组化结果: 该组20 例患者均表达CD117
(图9),DOG-1(图10),CD34 不同程度阳性。
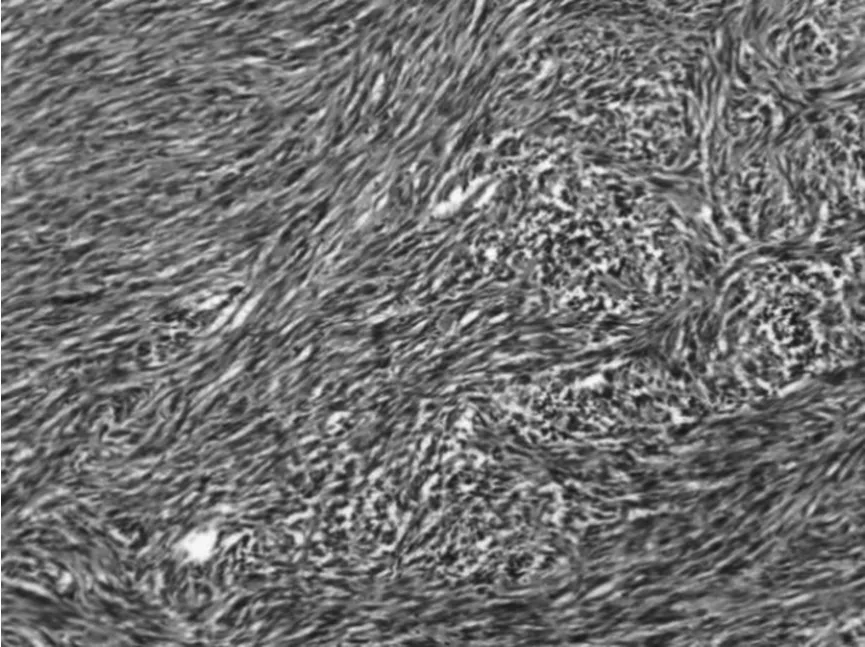
图1 HE*100 编织状、旋涡状结构
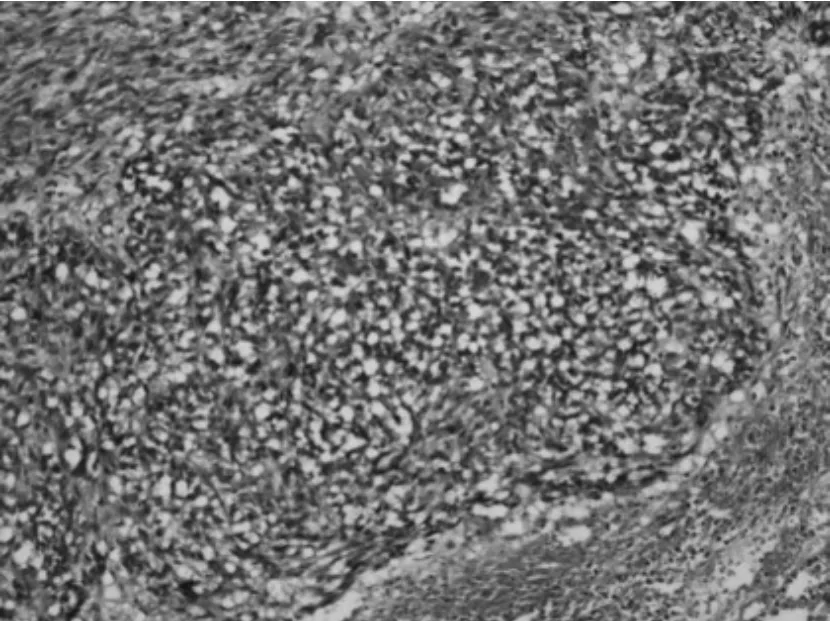
图2 HE*100 局灶呈上皮样、器官样结构
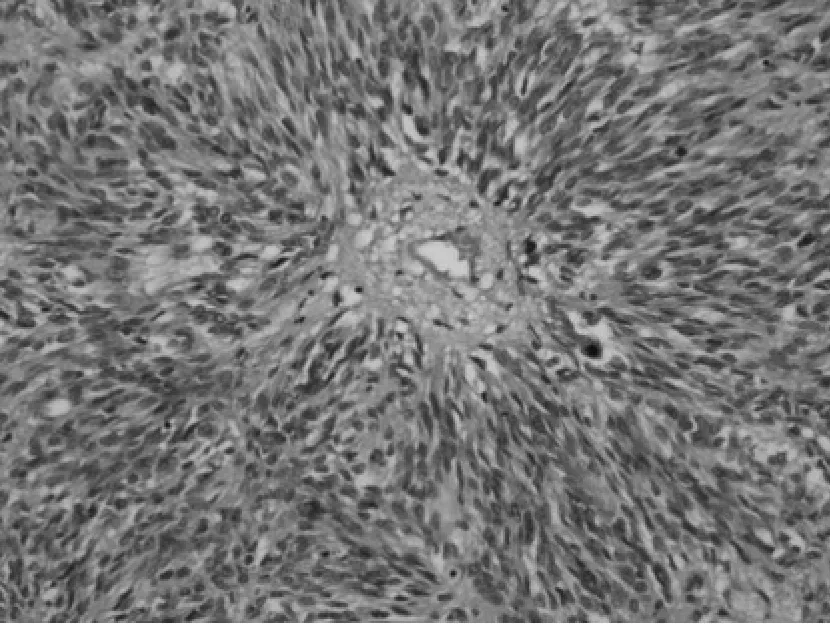
图3 HE*100 菊形团样结构
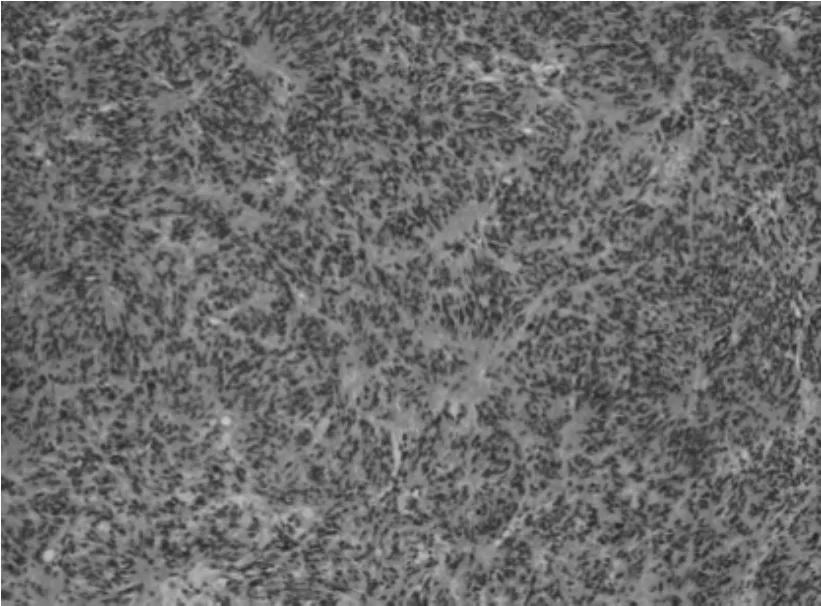
图4 HE*100 梭形细胞呈神经鞘样
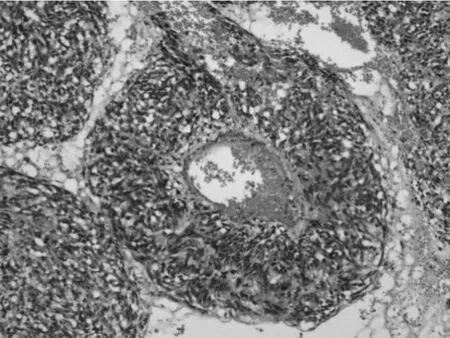
图5 HE*100 血管套样结构
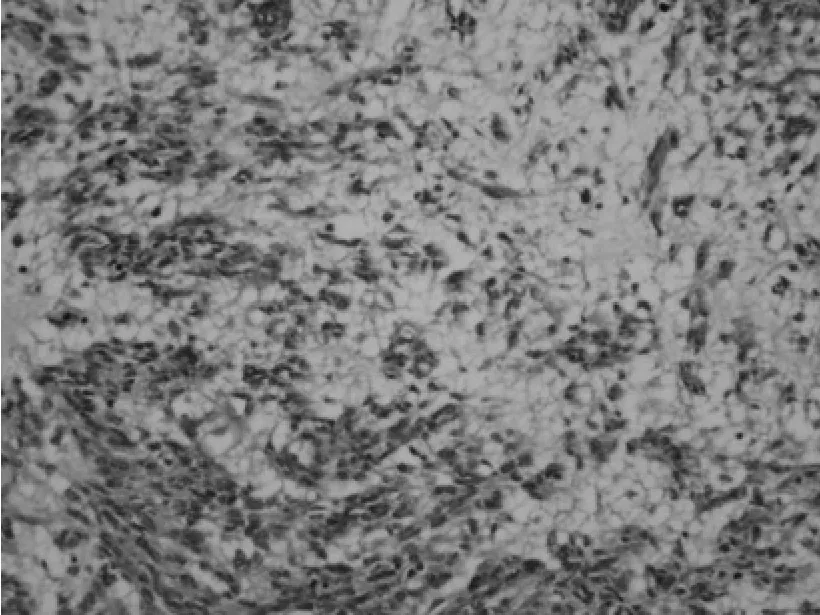
图6 HE*100 粘液样变区
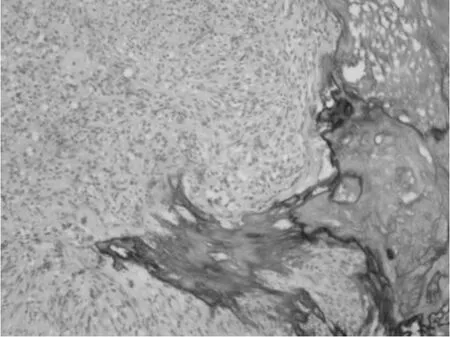
图7 HE*100 钙化
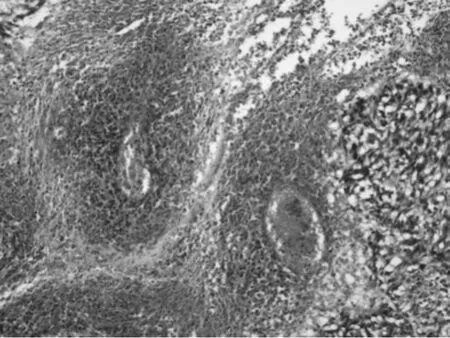
图8 HE*100 凝固性坏死

图9 CD117
图10 DOG-1
3 讨论
GIST 在临床上无明显特异性,与消化道上皮性肿瘤相比,其发病率较低,起病比较隐匿。患者可因上腹部不适、消化道出血、腹痛、腹部包块等情况就诊,部分患者因常规体检、内镜检查、影像学检查发现[5]。该组有患者因胆囊切除术、胃癌根治术、脾破裂手术中探查时偶尔发现。 内镜检查GIST 常表现为粘膜下的肿块,向腔内呈球形凸起,粘膜多光滑,部分病例粘膜面可见浅凹溃疡形成。内镜下活检由于病变通常位于粘膜下而难以获取肿瘤组织,有时甚至可致严重出血,内镜下取材病理确诊较适用于病变侵及粘膜表面的病例。
GIST 可位于粘膜下,消化道壁固有肌层内、浆膜下或腹腔内肿块,境界通常相对清楚,外观呈结节状,切面多实性、灰白或灰红色,部分伴有出血、囊性变或坏死。 根据瘤细胞的形态在肿瘤中所占比例:GIST 显微镜下的基本形态有3 种主要的类型,分别是梭形细胞型、上皮样细胞型和上皮样细胞-梭形细胞混合型[6]。梭形细胞型约占GIST 的50%~70%,该组20 例患者大多为梭形细胞型,仅见两例局灶区混有上皮样细胞形态,镜下形态差异主要表现在瘤细胞的形态、密度、以及核分裂象的计数。GIST 还可以有一些特殊形态,包括少数病例还可见多形性细胞,GIST 除了有出血、囊性变、坏死外,间质可伴有玻璃样变、钙化,或呈粘液样,发生于小肠的GIST 常可见嗜伊红色的丝团样纤维小结[7]。
GIST 的免疫组化: 按照中国胃肠道间质瘤病理诊断共识推荐联合使用CD117、DOG1,并加用阳性对照,但需注意的是少数非GIST 肿瘤如平滑肌肿瘤、恶性黑色素瘤也可表达CD117 或DOG1,所以还需联合CD34、S100、DESMIN、SMA、HMB45 等检测,必要时加做分子病理检测以鉴别,该组有一例中危患者选择了分子病理检测,其C-KIT 第11 外显子突变,受益于伊马替尼的治疗。
GIST 的诊断在观察了肿瘤的组织学形态后,免疫组化上联合使用CD117、DOG-1,可分为以下几种情况:①CD117+,CD34+,做出GIST 的诊断;②CD117-或弱+,DOG-1+,需加做分子病理检测;③CD117+,DOG-1-,排除其他CD117+的肿瘤如副神经节瘤、直肠肛管恶性黑色素瘤、精原细胞瘤等,及加做分子病理检测明确;④CD117-,DOG-1-,此类患者大多可以除外GIST,但当排除其他肿瘤后仍考虑GIST的话,可加做分子病理检测,并递交至GIST 病理学专家讨论后再诊断;⑤做出了明确GIST 的诊断,但是患者的分子病理检测无C-KIT 及PDGFRA 的突变,需考虑是否野生型的GIST,包括SDH 缺陷型、非SDH缺陷型。
随着靶向药物伊马替尼的推出,催生了GIST 危险度的分级方法,在全球范围内推广[8],其危险度评估系统包括NIH(2008 改良版)、WHO(2013 版)、AFIP、NCCN 指南等,根据我国的实际情况,2013 版、2017版中国胃肠道间质瘤诊断共识专家委员会推荐沿用NIH2008 版,可能更适合亚洲人种,且其便捷和操作简单。 需要注意的是在评估肿瘤危险度时,核分裂计数50 个HPF,也就是WHO 推荐的5 mm2,该院的显微镜均为目镜22 mm,根据换算约计数21 个HPF。总结该院20 例患者的危险度评估结果,其中极低危进展风险7 例,6 例发生于胃,1 例发生于小肠,直径均0.9~2 cm,核分裂均小于5 个;低危进展风险3 例,均发生于胃,直径2~5.5 cm,核分裂均小于5 个;中危进展风险4 例,2 例发生于胃,2 例发生于肠,直径4.5~10 cm,核分裂2~5 个;高危进展风险6 例,胃2 例,小肠3 例,腹腔1 例,直径8~14 cm,核分裂均大于5个。 按照中国2017 版中国胃肠道间质瘤诊断共识,修改后的NIH2008 改良版,该组有4 例2014 年、2015 年患者应重新分级,2 例发生于胃,1 例直径4.5cm,核分裂计数5 个,应从中危调整为低危;1 例直径5.5 cm,核分裂计数4 个应从低危调整为中危;2 例发生于肠,直径5.5~10 cm,核分裂计数小于5 个,应从中危调整为高危。 由于病理是不断发展和进步的,没有一种评估系统是完美或一成不变的,病理医生应结合实际情况具体选择,并不断学习更新。与普通型GIST 有所不同,核分裂计数危险度评估不适用于SDH 缺陷型GIST 评估。 王景艳[9]的研究结果表示,在间质瘤诊断过程中以病理学形态为基础,结合CD34、CD117 具有理想的诊断效果,而且特异性作用比较强。 该文研究结论与其(肿瘤直径为0.6~18.5 cm 之间,肿瘤部位在腹腔、盆腔、小肠、直肠、结肠、胃部等,其中6 例患者的检查结果显示肿瘤切面呈现为囊性病变以及出血现象)研究结果一致。
原发性GIST 患者首选手术治疗,并确定切缘情况。 体积较小的肿瘤可选择内镜下微创手术,该组2例胃镜标本均是粘膜下剥除,直径小于2 cm,切缘未见累及。中、高危风险进展患者术后推荐格列卫治疗,并需有分子病理检测结果支持,术前需靶向治疗患者需病理诊断明确及有分子病理检测结果。 对于中、高危患者应加强随访,该组1 例高危风险患者1 年后出现复发。
鉴别诊断: ①平滑肌肿瘤或神经源性肿瘤,在GIST 诊断出来以前,以前诊断为平滑肌肿瘤或神经源性肿瘤多为GIST,现可通过免疫组化检测鉴别;②炎性纤维性息肉,表达CD34,也可有PDGFRA 的突变;③纤维瘤病,通常形态为较为纤细的梭形细胞呈平行或束状排列,也可交织,免疫组化可表达βcatenin,SMA,不表达DOG-1、CD117;④炎性肌纤维母细胞瘤,需与伴有炎性改变的GIST 鉴别,该瘤多发生于儿童或青少年,间质中常有慢性炎细胞浸润,50%伴有ALK 基因重排,不同程度表达SMA 或DESMIN,不表达DOG-1、CD117[10]。
综上所述,对胃肠道间质瘤的诊断病理医生应在熟悉了其镜下形态后,选择具有高度一致性的抗体CD117、DOG1 联合使用,并联合其他标记物进行诊断和鉴别,精确测量肿瘤大小、核分裂象的计数,参照适合的危险度分级,对肿瘤进展风险进行评估,如果患者是中高危患者,做伊马替尼治疗前,建议患者行分子病理检测进一步明确。 一份完整GIST 的病理诊断报告必须包括的内容:肿瘤部位,大小,核分裂像计数,免疫组化结果,危险度的评估,由于胃镜活检组织、穿刺组织、复发、转移及靶向治疗后GIST 不做危险度的评估,病理医生应多与临床医生沟通,了解患者的手术和治疗情况。

