基于聚集诱导发光的荧光适体传感器检测Ag+
田会丽,孟 云,赵 森,糜唯钰,姬 华,王周平,,*
(1.石河子大学食品学院,新疆 石河子 832003;2.江南大学食品学院,江苏 无锡 214122)
银在自然界中分布广泛,主要应用于电气工业、摄影和成像工业以及制药工业[1]。关于银与必需营养素(尤其是硒、铜和VE和VB12)相互作用的研究越来越多,人们开始关注其潜在的毒性。美国环境保护局规定,水中的Ag+浓度不应超过0.9 µmol/L。相比其他形式的银,Ag+毒性最大[2]。因此,高灵敏和选择性方法的发展检测水介质中痕量的Ag+对环境和人类健康具有相当重要的意义。目前,Ag+的检测方法很多,如原子吸收光谱法[3]、催化动力学光度法[4]、电感耦合等离子质谱法[5]等。虽然这些方法具有高选择性和灵敏度,但也存在预处理复杂、耗时长、成本高等缺点,不利于实际应用。因此,传统的荧光探针已经不适用于检测水中的银离子,开发一种快速、简单、灵敏的银离子检测方法是非常重要的。
适配体由于亲和性高和易于修饰等优点,广泛应用于重金属的检测。DNA金属碱基对因其在传感应用中的潜力而备受关注。一些金属离子可以选择性地与DNA双链体中的一些天然或人工碱基结合,形成金属介导的碱基对[6]。这通常会导致DNA双链体的热稳定性增加。特别是,DNA-金属碱基对通常用于促进单链或双链寡核苷酸的结构变化,例如,DNA双链体中的C—C对能够专门捕获Ag+以形成C—Ag+—C结构,形成一个稳定的双链结构,从而提高DNA链的解链温度[7-11]。周学辉等[12]利用C—Ag+—C错配释放出富含G碱基的序列从而形成G-四聚体,建立了Ag+的传感比色检测方法,该方法的检测限可达6.3 nmol/L,具有操作简便、无需修饰等优点。
黑磷是一种新型的二维层状晶体。黑磷的直接带隙结构[13]和带隙稳定性使其广泛应用于光电领域,几乎覆盖了整个电磁波谱范围[13-15]。基于黑磷与氧化石墨烯性质相似,黑磷在生物医学领域的应用也得以迅速发展,包括药物输送、气体检测、疾病治疗和生物医学成像等领域。黑磷因具有良好的消光系数、热转换效率特性、良好的生物降解性和生物低毒性等优点,在光动力治疗、药物负载、热处理和光成像等方面也有很大的优势[16-19]。
聚集诱导荧光淬灭(aggregation-caused quenching,ACQ)现象很容易发生在传统有机荧光探针中,导致这种现象的主要因素是高浓度的荧光探针容易在聚集态发生荧光淬灭现象,影响探针灵敏度,这是使用荧光信号检测技术所极力避免的现象[20-23]。而9,10-二苯乙烯基蒽季铵盐(9,10-distyryl sulfonium quaternary ammonium salt,DSAI)生物荧光探针与其他传统的荧光分子相比,其最大的优势在于它在高浓度或聚集状态下不会发生ACQ现象,且操作简便、耗时短[24]。聚集诱导发光现象因其独特的性质及其在生物、医学领域以及食品安全领域的应用得到越来越多的科研工作者的关注。基于此,本研究旨在将聚集诱导发光材料与适配体识别技术以及荧光共振能量转移技术相结合并应用于食品安全检测中,通过将具有聚集诱导发光现象的分子与这些新型、便捷的分析技术结合起来以建立更高效、更灵敏、更准确的新型检测方法。聚集诱导发光技术的利用将会为食品安全检测方法提供一个新的平台。
1 材料与方法
1.1 材料与试剂
所有的试剂和材料均为商业材料且不需纯化即可使用。Ag+适配体(CCTCCCTCCCTCCCTTTTTCCCA CCCACCCACC)由生工生物工程(上海)股份有限公司合成;醋酸(HAc)、N,N-二甲基甲酰胺(均为分析纯),三(羟甲基)氨基甲烷(Tris,生物试剂) 国药集团化学试剂有限公司;AgNO3、HNO3等试剂均为分析纯;实验用水均为Milli水系统处理的去离子水。
1.2 仪器与设备
UV-1800紫外-可见光吸收光谱 日本Shimadzu公司;F-7000发光分光光度计 日本日立公司;JEM-2100透射电子显微镜 日本Jeol公司;Dimension ICON原子力显微镜 德国布鲁克科技有限公司;KQ-300E型超声波清洗器 昆山市超声仪器有限公司;TGL-16M台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;Starter 3C pH计 奥豪斯仪器(上海)有限公司;Direct-Q3超纯水制备仪 美国Millipore公司。
1.3 方法
1.3.1 BPNS的制备及结构表征
黑磷纳米片(black phosphorus nanosheet,BPNS)制备:黑磷粉末中加入超纯水,超声波分散机超声4 h,功率为300 W,然后将溶液于4 ℃、6 000 r/min离心30 min,取上清液备用。使用透射电子显微镜和原子力显微镜分别对BPNS的结构尺寸进行表征。
1.3.2 适配体浓度优化
适配体浓度直接影响反应液的荧光强度以及实验的最低检测限,所以要对适配体浓度进行优化。在EP管中加入不同浓度的适配体储备溶液(0、1、5、8、10、50、80、100 nmol/L)并与5 μL DSAI混合,然后加入Tris-HAc缓冲液(20 mmol/L、pH 7.0)确保反应总体系为500 μL,室温下测定荧光发射光谱。
1.3.3 BPNS浓度优化
BPNS作为荧光淬灭材料,其浓度会影响该传感系统的灵敏度。将优化好的适配体储备溶液与EP管中的5 μL DSAI混合,然后加入一系列不同浓度的BPNS上清液,然后将缓冲液加入到EP管中以确保反应总体系为500 μL,并且在室温下测定荧光光谱确定最佳浓度。
1.3.4 灵敏性和选择性测定
在最优条件下,将不同质量浓度的靶标Ag+(0、0.001、0.005、0.01、0.05、0.1、0.5、1、5、10、50、100、500 ng/mL)依次加入EP管中,加入Tris-HAc缓冲液(20 mmol/L、pH 7.0),保证反应总体系为500 μL,室温下测定荧光光谱。
为了评估该实验用于高度特异性检测Ag+的能力,选择7 种不同的金属离子(Fe3+、K+、Mg2+、Mn2+、Zn2+、Pb2+和Cu2+)分别进行测试,所有的金属离子都以相同的浓度进行实验。所有其他检测条件与Ag+检测中使用的条件相同。
1.3.5 纯净水中Ag+加标回收测定
为了证明这种方法的可行性,选择纯净水作为加标回收实验的样品。将3 种不同质量浓度的Ag+(1、10 ng/mL和50 ng/mL)加入水样品中以获得试验样品。将不同质量浓度的Ag+溶液分别与50 µL 120 nmol/L的适配体和60 µL/100 µL的BPNS进行混合,加入Tris-HAc缓冲液(20 mmol/L、pH 7.0)确保反应总体系为500 µL,孵育40 min。然后10 000 r/min离心10 min。最后将5 µL DSAI加入反应体系中,孵育30 min后室温测定荧光发射光谱。
1.4 数据处理
灵敏性和选择性实验和加标回收实验的所有数据均测量3 次。本实验的所有数据采用Origin pro 9.0对实验数据进行统计分析。
2 结果与分析
2.1 BPNS的制备及其结构表征
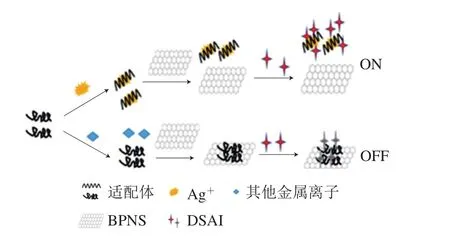
图1 用于检测Ag+的适配体传感器示意图Fig. 1 Schematic illustration of the aptasensor for detection of Ag+
如图1所示,选取一段富含胞嘧啶的Ag+核酸适配体,首先在Ag+存在下,适配体与靶标作用生成C—Ag+—C结构,从而使核酸适配体的构象从无序状态转变为U型结构[25-26]。这种结构一般情况下比较稳定,不会被破坏。由于适配体的U型结构,当加入BPNS后适配体不会被BPNS吸附。DSAI分子是带有正电的水溶性荧光探针,可以通过静电吸附作用以及疏水相互作用与核酸适配体进行结合[27],因此溶液体系荧光增强,当适配体与Ag+之间形成稳定的发夹型结构后,DSAI分子内旋转受限,能量以非辐射耗散的形式释放,因此,溶液体系的荧光进一步增强,从而产生聚集诱导发光现象。反之,若溶液中为其他金属离子时,适配体的构象不会发生改变,仍然保持无规则结构。加入BPNS后,BPNS通过静电吸附作用使适配体吸附在BPNS表面。DSAI通过静电吸附作用和疏水作用缠绕在适配体上,同时,DSAI的荧光因为荧光共振能量转移作用被BPNS淬灭,溶液不发光。所以通过观察DSAI荧光强度的变化,即可以检测溶液中的Ag+。
BPNS独特的物理化学性质取决于它的形状和厚度。利用液相剥离法,通过多次超声和离心清洗制备纳米尺寸的BPNS。BPNS的透射电子显微镜图像(图2A)显示,其结构近似为片状,表明BPNS制备成功。通过原子力显微镜进一步表征制备的BPNS的厚度。图2B~D为BPNS的原子力显微镜图像,通过计算得出所制备的BPNS的平均厚度约为15 nm(图2D)。

图2 BPNS的透射电子显微镜(A)和原子力显微镜(B~D)图像Fig. 2 Transmission electron microscope (A) and atomic force microscope (B-D) images of BPNS
2.2 适配体浓度优化
在该传感系统中使用的适配体浓度直接影响反应液的荧光强度以及实验的最低检测限,所以要对适配体的浓度进行优化。如图3所示,随着适配体浓度的增加,反应液的荧光强度逐渐增强。然而,当适配体浓度达到80 nmol/L后荧光强度基本保持恒定。因此选择适配体的浓度为80 nmol/L进行后续实验。

图3 DSAI在不同浓度的适配体中的荧光光谱Fig. 3 Fluorescence spectra of DSAI with different concentrations of aptamers
2.3 BPNS添加量的优化
BPNS作为荧光淬灭材料,浓度大小会直接影响实验结果的准确性以及灵敏度。因此,在确定适配体的浓度为80 nmol/L后,依次加入不同浓度的BPNS上清液并确定其最佳添加量。如图4所示,随着BPNS上清液添加量的增加,DSAI的荧光强度逐渐降低,表明DSAI的荧光被BPNS淬灭的程度越来越高。因为高浓度的BPNS会对荧光产生遮蔽效应以及为了提高实验结果的灵敏度以及准确性,最终选择60 µL/100 µL作为BPNS的最佳添加量。
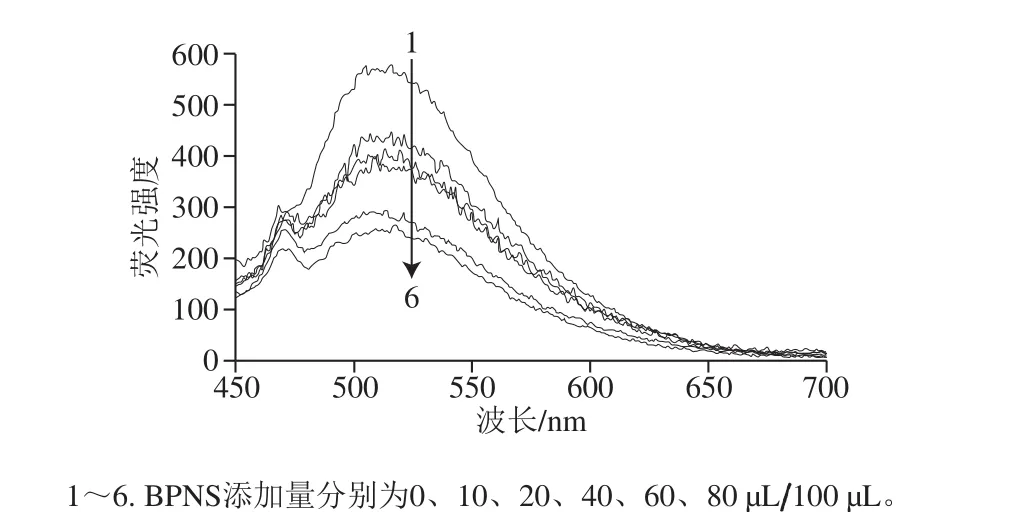
图4 DSAI在不同添加量的BPNS中的荧光光谱Fig. 4 Fluorescence spectra of DSAI with different concentrations of BPNS
2.4 荧光适体传感器的分析性能
为研究该荧光适体传感器的灵敏度,在优化的实验条件下检测0~500 ng/mL的Ag+。如图5所示,溶液的荧光强度恢复并增强,表明随着Ag+浓度的增加,DSAI/适配体/Ag+与BPNS之间的相互吸附作用减弱,使得DSAI/适配体/Ag+远离BPNS并且避免了DSAI的荧光被BPNS淬灭,使得溶液荧光恢复并增强。说明靶标Ag+可以被特异性识别。该荧光适体传感器的荧光强度(Y)与Ag+质量浓度的对数(X)呈正相关,且在Ag+质量浓度为0.01~100 ng/mL范围内具有良好的线性关系。其线性方程为Y=22.52X+675.12,R2=0.991 2,检测限为0.002 ng/mL。
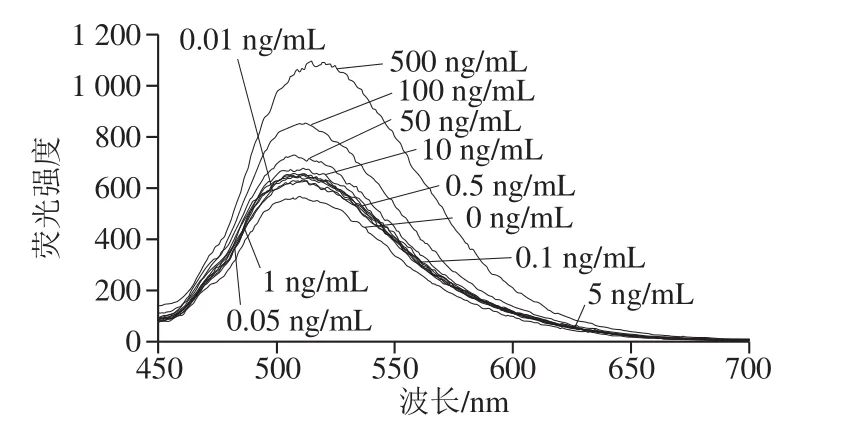
图5 不同质量浓度Ag+时DSAI的荧光光谱Fig. 5 Fluorescence spectra of DSAI with different concentrations of Ag+
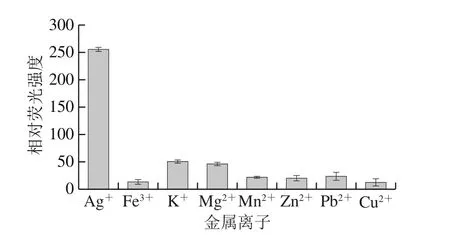
图6 其他金属离子干扰性考察Fig. 6 Relative fluorescence intensity of the biosensor in the presence of other coexisting metal ions
为了评估该荧光适体传感器对Ag+的特异性,利用该荧光适体传感器对其他重金属离子进行干扰性实验检测。如图6所示,Ag+适配体对钾离子和镁离子有一定的亲和性,但由于Ag+适配体对钾离子和镁离子产生的荧光强度低于对银离子的荧光强度的20%,并且含有Ag+溶液的荧光强度比检测系统中的其他干扰物具有更明显的信号,说明该方法具有良好的选择性,其他干扰物可能不会影响检测系统。这是由于适配体能与靶标Ag+特异性结合并形成稳定的发夹结构,导致适配体的构象发生改变,且DSAI从BPNS上释放并聚集吸附在发夹结构上,因此使得溶液的荧光能够恢复和增强。结果表明,所构建的生物传感器对Ag+具有良好的特异性。
目前报道的关于银离子检测的文献,如Sun Jian等[28]研究组报道了一种具有超灵敏检测银离子的纳米材料AuNCs,但这种材料在低浓度下具有较高的毒性;Anand等[29]开发了一种荧光探针Cysan,但这种探针的水溶性差,限制了其在实际中的应用;Yang Yue等[30]利用二萘嵌苯荧光探针结合适配体检测水中的银离子,探针在水溶液中会发射荧光,影响探针的灵敏度,使检测限上升。Ono等[31]开发了一个由荧光标记的寡核苷酸探针和淬灭剂,在核酸适配体的一端修饰荧光基团,另一端修饰荧光淬灭基团,它对Ag+检测灵敏且选择性高,但这种探针价格昂贵,不利于实际应用。与丁静等[32]开发的利用单壁碳纳米管猝灭效检测Ag+相比,本实验具有较低的检测限。除此之外,本实验无需进行FAM标记,从而降低了实验成本。
2.5 纯净水中Ag+加标回收测定
为了评估该传感系统在实际应用中的可行性和可靠性,通过标准加入法确定3 种不同Ag+浓度的回收率。将样品掺入不同Ag+量的水样中。在该实验中每组数据重复3 次。如表1所示,回收率在94.9%~105.82%之间。结果证明该传感器方法可用于分析实际样品。

表1 适配体测定法检测纯净水样品中Ag+的回收率Table 1 Recovery rates of Ag+ by aptamer assay in puri fied water samples
3 结 论
本实验开发了一种超灵敏的生物传感器,基于聚集诱导发光现象的荧光探针和适配体识别技术检测Ag+。由于巧妙的设计,检测限低至0.002 ng/mL,比世界卫生组织最新发布的指导标准[33]允许的Ag+限值低50 倍。与用于Ag+分析的其他方法相比,该方法不需要对所需适配体进行额外修饰,具有简单和低成本的优点。聚集诱导发光分子DSAI与其他传统的荧光分子相比,能很好地避免在高浓度或聚集状态下不会发生ACQ现象,且操作简便、稳定性强、耗时短。然而,在这项工作中只检测到一种分析物。因此,未来的工作应该集中在多分析物的测定上,为丰富和提高食品安全检测技术提供了新的思路。

