D-核糖及肉桂醛对四川泡菜菌群多样性和生物被膜的影响
刘 蕾,李娅琳,聂 蓉,钱 杨,厍 晓,陶雨飞,饶 瑜*
(西华大学食品与生物工程学院,四川 成都 610039)
四川泡菜是中国泡菜的典型代表,历史悠久,文化深厚,被誉为“川菜之骨”,堪称“国粹”[1]。四川泡菜因其独特的风味深受人们喜爱,其产业已成为四川乃至我国特色产业支柱之一。由于其在发酵、发酵后加工和货架期贮存中都保有丰富的微生物数量和多样性,在一定条件下,被抑制的腐败微生物能打破原有的微生物生态平衡而引发腐败[2]。目前对四川泡菜腐败的预防和控制,主要通过在发酵过程中采取措施和产品的防腐保鲜两个方面。但现有的防腐保鲜方法已遇到各种瓶颈,因此,寻求新型的生物防腐剂,开发新型的生物防腐技术,已迫在眉睫[3]。
四川泡菜作为传统的天然发酵食品,含有种类繁多的微生物。泡菜微生物组结构解析的相关研究已开始开展,研究表明乳酸菌主导了泡菜发酵进程,且本研究室前期也鉴定出多株与泡菜腐败有关的微生物[4]。在泡菜发酵环境中,微生物之间可以通过群体感应(quorum sensing,QS)系统进行交流,QS系统是细菌依赖于群体密度而调控其生理行为的一种机制。其中LuxS/AI-2型QS广泛存在于G+和G-菌中,在微生物跨种间信号交流方面发挥重要作用。近年来越来越多的研究发现食品腐败可能受QS系统调控。在不同的食品例如牛奶、肉和蔬菜中发现了QS信号分子AI-1和AI-2,同时发现一些与食品腐败相关的酶如果胶酶、聚半乳糖醛酸酶、纤维素酶、脂肪酶、几丁质酶、核酸酶、蛋白酶受QS调控[5-8]。群体感应抑制剂(quorum sensing inhibitor,QSI)能用于防止食品表面腐败菌或病原菌的定植、毒素产生和腐败菌的增殖,因此具备作为新型生物防腐剂的巨大潜力[9]。然而,关于QS阻断后会对发酵环境中的微生物菌群产生何种影响的相关研究尚处于起步阶段。
前期研究已发现D-核糖是一种通用QSI[10-11],且常被作用医药原料、保健品、中间体和食品添加剂[12-13]。已有报道称肉桂醛也是一种QSI[14-18],能够有效抑制微生物的生理行为[19-24]。本研究在发酵泡菜中分别加入D-核糖及肉桂醛,检测其对菌群多样性的影响,并进一步分析其对特定腐败菌生理特性的影响,以期为今后QS抑制效应在发酵泡菜防腐保鲜领域相关研究提供参考,并为发酵食品防腐保鲜技术开发提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 泡菜样品
样品来自成都红光地区发酵泡菜,泡菜原料为大白菜,发酵方式为添加6 g/100 mL食盐后天然发酵。
1.1.2 培养基
M R S培养基:包括蛋白胨1 0 g/L,酵母提取物5 g/L,柠檬酸二铵2 g/L,葡萄糖20 g/L,MgSO4·7H2O 0.58 g/L,牛肉浸膏10 g/L,K2HPO42 g/L,乙酸钠5 g/L,吐温80 1 mL/L,MnSO4·4H2O 0.25 g/L。
LB培养基:包括胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,调节pH值至7.4,121 ℃灭菌15 min后备用。
1.1.3 试剂
D-核糖、肉桂醛(均为食品级) 成都科龙化工试剂厂;2×Taq MasterMix(Dye) 康为世纪生物科技有限公司;细菌基因组提取试剂盒 天根生化科技有限公司;DNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
Appiled Biosystems GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Thermo Fisher公司;QuantiFluor™-ST蓝色荧光定量系统美国Promega公司;SpectraMax iD3多功能酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 泡菜样品处理
根据前期研究结果及文献[10],将D-核糖和肉桂醛的作用浓度分别确定为200 mmol/L和100 μmol/L。将泡菜样品(含泡菜液及泡菜)进行分装,之后分别添加D-核糖至终浓度200 mmol/L,即为D-核糖处理组,平行3 个样本;添加肉桂醛至终浓度100 μmol/L,为肉桂醛处理组,平行3 个样本;不添加D-核糖及肉桂醛的为对照组,平行3 个样本。室温保存1 个月至泡菜样品出现变色、气味不良、pH值升高的腐败现象。
1.3.2 泡菜发酵液微生物基因组提取与测序
测序的基本实验流程为:泡菜发酵液DNA抽提→设计合成引物接头→PCR扩增与产物纯化→PCR产物定量与均一化→构建PE文库→Illumina测序。
DNA抽提:经过PCR操作提取出DNA产物后,通过琼脂糖凝胶电泳检测抽提出的PCR产物。PCR扩增:按指定测序区域,合成带有barcode的特异引物。PCR采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase。每个样本3 个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,切胶回收PCR产物,Tris-HCl洗脱。荧光定量:根据琼脂糖凝胶电泳初步定量结果,将PCR产物进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
MiSeq文库构建:通过PCR将Illumina官方接头序列添加至目标区域外端,使用凝胶回收试剂盒切胶回收PCR产物,Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测,氢氧化钠变性,产生DNA片段。
MiSeq测序:DNA片段的一端与引物碱基互补,固定在芯片上;以DNA片段为模板,芯片上固定的碱基序列为引物进行PCR合成,在芯片上合成目标待测DNA片段;变性、退火后,芯片上DNA片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”;PCR扩增,产生DNA簇;DNA扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4 种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第1轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3’端黏性,继续聚合第2个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.3.3 生物信息学分析
MiSeq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析,基于OTU可以进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。
1.3.4 特定腐败菌的分离与鉴定
以上述静置1 个月的泡菜液为来源分离特定腐败菌。采用无菌生理盐水对原始泡菜液进行10 倍梯度稀释,并涂布于LB固体培养基中,37 ℃静置培养,直至长出单克隆菌落。对挑取菌落进行转接、液体培养,菌液为PCR扩增模板。分别以27F(3’-AGAGTTTGATCCTGGCTCAG-5’)和1541R(3’-AAGGAGGTGATCCACCC-5’)为上下游引物对上述菌液的16S rDNA序列进行PCR扩增,扩增体系为:27F 1 μL,1541R 1 μL,菌液模板2 μL,2×Mix 15 μL,ddH2O 11 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性5 min,55 ℃退火30 s,72 ℃延伸90 s,35 个循环;72 ℃延伸10 min,4 ℃保存。之后进行琼脂糖凝胶电泳。后直接将PCR产物或切胶产物送去成都擎科梓熙有限公司进行测序,测序结果与GenBank数据库进行比对分析。
1.3.5 生长曲线测定
将上述分离得到的特定腐败菌分别接种于LB培养基中,处理组分别添加终浓度为200 mmol/L的D-核糖或100 μmol/L的肉桂醛,将其置于37 ℃摇床振荡培养36 h,每2 h取样,测定OD600nm。以培养时间为横坐标,以OD600nm值为纵坐标,分别绘制生长曲线。
1.3.6 生物被膜测定
生物被膜形成量检测采用结晶紫染色法。将上述分离得到的特定腐败菌分别接种于LB培养基中,处理组分别添加终浓度为200 mmol/L的D-核糖或100 μmol/L的肉桂醛。将培养液加至96 孔细胞培养板中,每孔200 μL,37 ℃静置培养36 h。培养结束后用磷酸盐缓冲溶液轻柔冲洗3 次,去除悬浮菌体,室温晾干。每孔加0.1%结晶紫溶液,室温染色30 min,无菌水轻柔冲洗至洗液无色为止,室温晾干。加100 μL无水乙醇充分溶解结晶紫。检测OD595nm值。
1.4 数据分析
所有测试重复3 次,用GraphPad Prism 7.0软件进行统计分析(ANOVA)及作图。P<0.05,差异显著;P<0.01,差异极显著。
2 结果与分析
2.1 D-核糖及肉桂醛对四川泡菜微生物多样性的影响
微生物多样性测序的可操作分类单元(operational taxonomic units,OTU)信息统计结果如表1所示,样品检测到的微生物共分布于1 个域,1 个界,4 个门,5 个纲,9 个目,11 个科,13 个属,20 个种,OTU统计为22 个。在OTU水平进行分析,对照组中Pediococcus ethanolidurans(OTU16)的数目最多(36 735),其次是unclassified Lactobacillus(OTU20)(8 275),不含有L. paucivorans(OTU18)。D-核糖处理后有明显的变化,其中unclassified Lactobacillus(OTU15)的数目最多(34 646),其次是P. ethanolidurans(OTU16)(8 842),而不含有S. equorum(OTU4)、L. ginsenosidimutans(OTU6)、P. acnes subsp. acnes(OTU8)、L. lactis subsp. lactis(OTU9)。与对照组相比,肉桂醛处理后作用不明显,其中P. ethanolidurans(OTU16)的丰度仍然最大(28 955),其次为unclassifiedLactobacillus(OTU20)(2 827),不含有L. paucivorans(OTU18)。

表1 微生物多样性测序的OTU信息统计Table 1 OTU information from microbial diversity analysis
如图1所示,对照组P. ethanolidurans占比最多,为76.35%,其次为unclassifiedLactobacillus,占比为19.38%,此外,还检测出L. sakei,占比1.70%,以及B. gunnisoniana,占比1.45%。肉桂醛处理后的群落分布中P. ethanolidurans占比依然最多,上升为85.34%,unclassifiedLactobacillus、L. sakei及B. gunnisoniana占比分别变为10.22%、2.23%及1.28%。D-核糖处理组的变化显著,其中占比最多的是unclassifiedLactobacillus,占到80.10%,而P. ethanolidurans的占比降为19.21%。该结果表明D-核糖和肉桂醛会对四川泡菜的菌群结构产生影响,且D-核糖的作用强于肉桂醛。


图1 泡菜样品在属水平的微生物群落分布饼图Fig. 1 Genus-level distribution of microbial community in Sichuan pickle

图2 肉桂醛处理组与对照组在属水平的微生物Veen图(A)和Heatmap图(B)Fig. 2 Veen chart (A) and Heatmap (B) of microbial communities in control vs. cinnamaldehyde treatment groups at genus level

图3 D-核糖处理组与对照组在属水平的微生物Veen图(A)和Heatmap图(B)Fig. 3 Veen chart (A) and Heatmap (B) of microbial communities in control vs. D-ribose treatment groups at genus level
如图2所示,经肉桂醛处理后与处理组有18 个属为共同所有,Heatmap图表明样本群落结构变化不明显,Lactobacillus的占比下降,P. ethanolidurans占比上升。如图3所示,经D-核糖处理后与处理组有15 个属为共同所有,Heatmap图表明样本群落结构发生了显著变化,且Lactobacillus占比显著上调,这表明D-核糖对维持泡菜中的Lactobacillus比例具有积极的作用。
2.2 D-核糖及肉桂醛对四川泡菜源腐败微生物生长曲线的影响

图4 D-核糖及肉桂醛对P. calida(A)、P. ananatis(B)、P. anthophila(C)及S. saprophyticus(D)生物曲线的影响Fig. 4 Effects of D-ribose and cinnamaldehyde on growth curves of P. calida (A), P. ananatis (B), P. anthophila (C) and S. saprophyticus (D)
从四川泡菜样本中分离出多株特定腐败菌,选择其中4 株进行后续研究。分别为Pantoea calida、Pantoea ananatis、Pantoea anthophila以及Staphylococcus saprophyticus。
如图4所示,D-核糖对4 种微生物的生长均无显著影响,而肉桂醛对它们的生长有显著的抑制作用。其中,对P. calida从开始就表现出明显的抑制作用(图4A),对P. ananatis、P. anthophila及S. saprophyticus初期(0~10 h)生长没有明显的抑制作用,但是直至稳定期,三者的OD600nm数值均显著低于对照组。从OD600nm看,肉桂醛处理后P. calida菌量只能达到对照组的一半,P. ananatis、P. anthophila及S. saprophyticus的菌量也与对照组有显著差异。然而,2.1节中关于微生物不同属的相对占比结果却显示肉桂醛的影响不明显,这说明肉桂醛对单个微生物的抑菌作用并不会显著影响其菌群相对占比情况,菌群结构的变化更有可能是微生物群体信号交流改变的结果。
2.3 D-核糖及肉桂醛对四川泡菜源腐败微生物生物被膜形成的影响
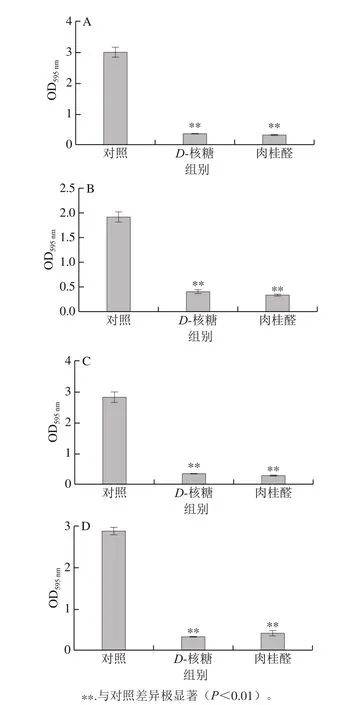
图5 D-核糖及肉桂醛对P. calida(A)、P. ananatis(B)、P. anthophila(C)及S. saprophyticus(D)生物被膜的影响Fig. 5 Effects of D-ribose and cinnamaldehyde on bio film formation of P. calida (A), P. ananatis (B), P. anthophila (C) and S. saprophyticus (D)
如图5所示,P. calida在加入D-核糖和肉桂醛之后,其生物被膜OD595nm值分别为0.353 3和0.313 7,对比对照组的OD595nm值3.132 5,分别降低至11%和10%,二者作用效果明显。P. ananatis在加入D-核糖和肉桂醛之后,生物被膜OD595nm值分别为0.401 8和0.330 5,对比对照组OD595nm值1.914 3,降低至21%和17%,作用效果也较明显。P. anthophila在加入D-核糖和肉桂醛之后,其OD595nm值分别为0.313 5和0.257 7,对比对照组的OD595nm值2.805 2,分别降低至11%和9%,作用效果明显。S. saprophyticus在加入D-核糖和肉桂醛之后,其OD595nm值分别为0.305 8和0.418 0,对比未加入对照组的OD595nm值2.856 7,分别降低至11%和15%,作用效果很明显。综上,D-核糖和肉桂醛对4 种腐败菌的生物被膜形成均具有显著的抑制作用(P<0.01)。
3 讨 论
多数研究表明,乳酸菌是发酵泡菜的主要微生物[25-27]。有研究人员对家庭制作的四川泡菜微生物组进行深度测序,发现厚壁菌门和变形菌门的微生物占99%,从种的角度看,占比最多的是Lactobacillus,其次是Pediococcus;从属的角度看,L. acetotolerans占比最多,其次是L. brevis和P. ethannolidurans[28]。在泡菜发酵的最后阶段,L. plantarum和L. casei为主要微生物[29]。也有报道称L. acteotolerans和L. brevis是家庭制作泡菜的主要微生物[28]。有研究人员对不同原料的四川发酵泡菜的细菌多样性进行了分析,发现Lactobacillus在榨菜、萝卜中为绝对优势菌,在豇豆中为主要优势菌[30]。本研究室曾对不同盐质量浓度泡菜正常发酵中的微生物数量、分布及变化进行了分析,发现Lactobacillus plantarum和Lactobacillus pentosus为主的乳酸菌主导了泡菜发酵过程,而Bacillus subtilis和Candida tanzawaensis等菌株与泡菜腐败有关[2]。在本研究中,检测的对照样品在室温条件下存放1 个月,其主要微生物为P. ethanoliduran,而Lactobacillus占比为第2位,这表明泡菜中的微生物群落发生了变化,不利于泡菜品质控制。而加入D-核糖的处理组中,依然是Lactobacillus占比最多,表明D-核糖可能具有维持泡菜品质,延长货架期的潜在应用价值。
关于核糖调控菌群结构的相关研究鲜见报道,但前期已有研究表明核糖可作为QSI调节单个微生物的生理行为。有报道称D-核糖能够抑制信号分子AI-2从而减弱很多种微生物生物被膜的形成,例如Fusobacterium nucleatum、Porphyromonas gingivalis、Tannerella forsythia、Treponema denticola[31-32]。在Aggregatibacter actinomycetemcomitans中,核糖对其生长没有显著影响,但可以与AI-2竞争受体LsrB和RbsB,从而抑制AI-2诱导的胞内信号级联反应,从而抑制其生物被膜的形成[33-34]。前期研究也发现200 mmol/L的D-核糖对Lactobacillus paraplantarumL-ZS9和Bifidobacterium animalisRH的生长情况没有显著影响,但可以抑制它们的生物被膜形成[10,35]。且通过蛋白质组学鉴定出L. paraplantarumL-ZS9中受D-核糖调控的基因[10]。本研究特定腐败菌生长曲线及生物被膜形成的相关结果与以上研究结果一致,表明D-核糖可以在不显著影响其生长的情况下抑制被膜的形成,这说明D-核糖对被膜形成的抑制作用可能是通用的。而关于D-核糖是通过抑制QS还是同时伴随着代谢途径的改变从而影响这几株菌的生理行为,还有待进一步研究。此外,本研究发现在泡菜发酵环境中,D-核糖可以对其菌群结构产生影响,且可以将Lactobacillus的占比大幅提高。
肉桂油因其特殊的芳香广泛应用于食品工业领域[36-38]。肉桂醛是一种无毒的风味物质,被认为是安全的,广泛应用于食品、饮料、口香糖、香料及食品化学领域[39]。有研究表明肉桂醛能够有效抑制两种酰基高丝氨酸内酯介导的QS及AI-2介导的QS[40],它能够在不影响细菌生长的前提下通过减弱LuxR的DNA结合能力从而干扰Vibriospp.的AI-2介导的QS[17]。研究发现,肉桂油能够有效拮抗Streptococcus mutans和L. plantarum的生物被膜[41]。肉桂醛能够影响Burkholderia multivorans、Burkholderia cenocepacia、Pseudomonas aeruginosa、Escherichia coli和Vibriospp.的生物被膜形成,且会提升被膜对抗生素处理的敏感性[15-17,42-45]。也有研究发现,生长于中国台湾的土肉桂能够明显抑制9 种革兰氏阳性及阴性菌的浮游态生长,其中包括methicillin-resistantStaphylococcus aureus和Staphylococcus epidermidis[37]。肉桂醛的作用机制可能是抑制质子动力势、呼吸链、电子传递和基质氧化,从而导致氧化磷酸化去偶联、主动运输抑制、代谢产物丢失、DNA、RNA、蛋白质、脂质和多糖的代谢受阻[46-50]。肉桂作为调味品添加进泡菜制品中[51]。关于肉桂醛及其衍生物对各种发酵环境中的微生物组的相关研究非常匮乏。曾有研究发现在瘤胃发酵环境中,肉桂醛可以抑制革兰氏阳性菌及阴性菌,但是具有浓度依赖性[52]。且有研究发现瘤胃微生物会对一些植物提取物在第7天左右产生适应,从而其对微生物发酵的影响消失[53]。本研究结果表明肉桂醛对泡菜环境中微生物组成的影响不显著,这有可能是所选择浓度不是最适宜作用浓度,也有可能是添加时间较长导致微生物组的产生适应。
4 结 论
本研究通过分别外源添加D-核糖和肉桂醛这两种QSI于四川泡菜发酵液中,经微生物多样性分析发现D-核糖处理可以使样本群落结构发生显著变化,且Lactobacillus相对占比明显上调,这表明D-核糖对维持泡菜中的Lactobacillus比例具有积极的作用;而肉桂醛的作用并不明显。进一步分析D-核糖及肉桂醛对分离自样品中的特定腐败菌的生长性能的影响,发现D-核糖及肉桂醛均可以显著抑制特定腐败菌P. calida、P. ananatis、P. anthophila及S. saprophyticus的生物被膜形成。以上研究为今后QS抑制效应在发酵泡菜防腐保鲜领域相关研究提供参考,并为发酵食品防腐保鲜技术开发提供新的思路。

