葱兰愈伤组织诱导及植株再生
熊 琴,付素静,鲁万贵
(1.铜仁学院 农林工程与规划学院,贵州 铜仁 554300;2.铜仁市万山区鱼塘侗族苗族乡初级中学,贵州 铜仁 554300;3.铜仁市园林局,贵州 铜仁 554300)
葱兰[Zephyranthes candida(Lindl.)Herb.],又叫葱莲、玉莲、白花菖蒲莲,为石蒜科葱兰属多年生常绿草本植物,植株高20~35 cm,7—11月开花,花期较长。花茎从叶丛中抽出,高出叶端,顶生一白色花,花径2~3 cm,花瓣6,果期9—10月[1],原产自南美洲。
葱兰株丛低矮、终年常绿、花朵繁多、花期长,是花境、花坛的镶边材料,也可用于林下、边缘或半阴处,作园林地被植物[1]。目前,对葱兰的研究主要集中在病虫害的防治、抗性[2-4]等方面。葱兰主要靠播种和分株繁殖,其种子易掉落,不易采收[1,5],加之分株繁殖的繁殖系数低,难以规模化育苗,从而,难以满足日益增长的园林绿化需求。组织培养可以快速获得大量种苗,弥补常规种子繁殖和分株繁殖繁殖系数低的缺陷。此外,用种子作为外植体还可获得无病毒的植株。葱兰的组织培养,可追溯到1992年,陈扬春[6]用鳞片作为外植体建立了葱兰的无菌体系,第一次获得了葱兰无菌植株。其后,邓祖丽颖等[7]分别用叶片、鳞叶和顶芽等作为外植体,建立了高效的再生体系。本研究采用葱兰种子作为外植体建立无菌体系,探讨其愈伤组织、丛生芽诱导的最佳培养基,旨在保留葱兰有性繁殖特征的同时,也可以快速获得大量健康种苗,从而为葱兰大规模生产提供技术指导,并为葱兰的园林应用提供保障。
1 材料和方法
1.1 材料
实验所用葱兰种子采于铜仁学院,经过人工授粉后所得。
1.2 方法
1.2.1 培养基的设计与制作 本试验基本培养基为MS,研究不同浓度的2,4-D、6-BA 和NAA 组合对葱兰愈伤组织及丛生芽的影响,组合设计见表1。每种培养基设置30 个重复处理,由于污染造成的重复数量不足的培养基补足至30 个。
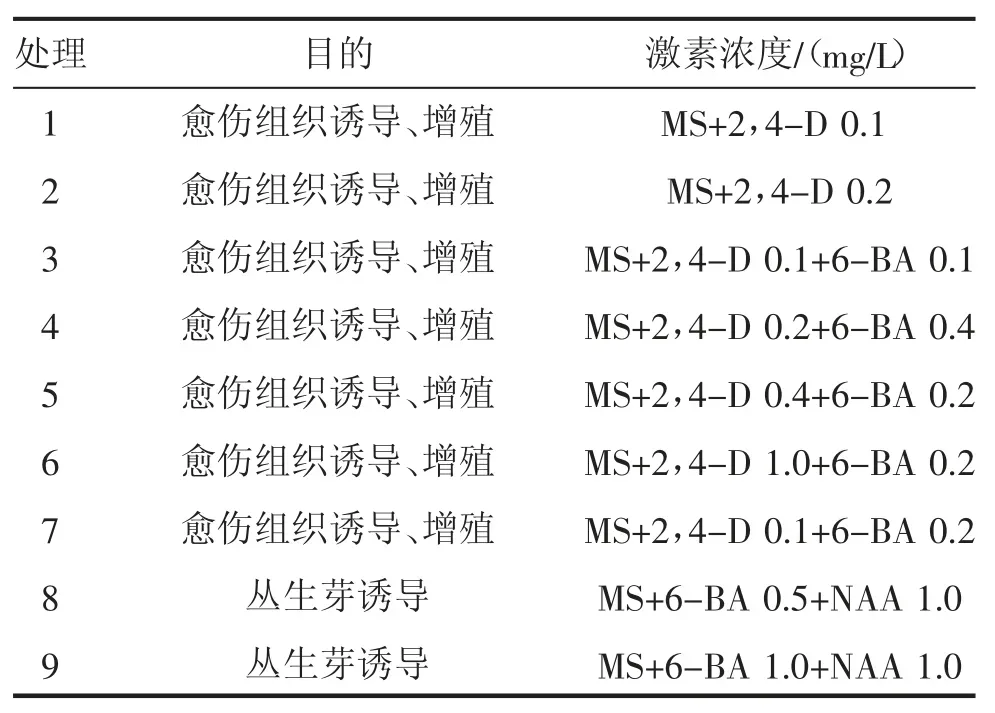
表1 培养基的设计
1.2.2 外植体的消毒与接种 用流水冲洗葱兰种子2 h。在超净工作台上,首先用75%酒精对种子消毒30 s,然后用无菌水冲洗3~4 次,用无菌滤纸吸干水分,再用含氯1%~2%的次氯酸钠溶液消毒20 min,最后放入无菌水中漂洗3~4 次,把消毒好的葱兰种子放在无菌纸上,吸干水分后接种到培养基。每种培养基接种30 瓶,每瓶内接种种子4~5 颗。继代或丛生芽诱导培养每支试管内接种1 块愈伤组织,大小为0.5 cm×0.5 cm。
1.2.3 培养条件与观察 培养条件为温度(25±2)℃,光照时间12 h/d,光照强度3 000 lx。接种后30 d 观察培养基中葱兰的生长情况并记录。
各培养基中均添加蔗糖30.0 g/L,琼脂粉6.5 g/L,pH 值5.8 左右,培养基配制好后在121 ℃下灭菌20 min。
1.3 数据统计与分析
实验数据采用Excel 2010 整理,SPSS 21.0 进行方差分析,Duncan 法进行差异显著性检验。愈伤组织诱导率、不定芽诱导率、丛生芽增殖系数的计算公式如下:

2 结果与分析
2.1 不同浓度激素及其组合对葱兰种子愈伤组织诱导的影响
由表2可知,不同浓度激素及其组合对葱兰种子愈伤组织诱导效果存在很大不同。在处理1 培养基中外植体褐化死亡,未生长出白色愈伤组织。增加2,4-D浓度后在处理2 培养基中只有1 瓶长出颗粒状的白色愈伤组织,但30 d 后褐化死亡,其愈伤组织诱导率仅为3.3%,说明2,4-D 对愈伤组织的诱导有一定的作用,但是单独的2,4-D 低浓度处理对葱兰种子愈伤组织诱导作用不明显,需与其他激素配合使用。
在复合了6-BA 的处理3 培养基(MS+2,4-D 0.1 mg/L+6-BA 0.1 mg/L) 中长出了白色愈伤组织,愈伤组织诱导率达70.0%,且部分愈伤组织上分化出了茎叶,但在继代培养基中愈伤组织逐渐褐化死亡。同时增加两种激素的浓度后,在处理4培养基(MS+2,4-D 0.2 mg/L+6-BA 0.4 mg/L)上诱导出了白色愈伤组织,愈伤组织诱导率达86.7%,且长出了绿色的叶子,连续继代培养后,虽仍有白色愈伤组织,但一段时间后逐渐变黄、死亡。在继续增加2,4-D 浓度、降低6-BA 浓度的处理5 培养基(MS+2,4-D 0.4 mg/L+6-BA 0.2 mg/L)上长出白色疏松的愈伤组织(图1),愈伤组织诱导率达90.0%,其中部分分化出芽,长势好,继代培养3 代后,愈伤组织仍具有增殖能力。处理6 培养基中继续增加2,4-D 浓度至1.0 mg/L、6-BA 浓度保持不变(MS+2,4-D 1.0 mg/L+6-BA 0.2 mg/L),愈伤组织的诱导率提高至93.3%,愈伤组织白色,部分分化出芽,长势好,但是继代培养后,白色愈伤组织增殖缓慢。处理7 培养基中保持6-BA 浓度不变,降低2,4-D 浓度至0.1 mg/L 时(MS+2,4-D 0.1 mg/L+6-BA 0.2 mg/L),能诱导出白色愈伤组织,诱导率为83.3%,但是愈伤组织易褐化,最终死亡。
各培养基对愈伤组织的诱导率差异显著,其中处理6 培养基诱导率最高,但愈伤组织继代培养后增殖缓慢,综合考虑诱导率及增殖效果,处理5 培养基(MS+2,4-D 0.4 mg/L+6-BA 0.2 mg/L)效果最好。

表2 不同浓度激素及其组合对葱兰种子愈伤组织的诱导结果

图1 葱兰愈伤组织
2.2 不同浓度激素组合对葱兰丛生芽诱导的影响
不同浓度激素组合对葱兰丛生芽的诱导结果见表3。在处理8 培养基(MS+6-BA 0.5 mg/L+NAA 1.0 mg/L)中的部分愈伤组织长出不定芽,不定芽为淡黄色,诱导率为33.3%,未分化的愈伤组织逐渐褐化;增加6-BA 浓度后,在处理9 培养基(MS+6-BA 1.0 mg/L+NAA 1.0 mg/L)中的愈伤组织多数能分化出芽,不定芽为淡黄色或白色,诱导率为66.7%,且生长状况较好,后期丛生芽长成正常的绿色幼苗(图2)。从丛生芽的增殖系数来看,处理9 培养基中平均每块愈伤组织上诱导出芽的数量也比处理8 培养基增加94.4%。

表3 不同浓度激素组合对葱兰丛生芽的诱导结果
3 结论与讨论
3.1 不同浓度激素及其组合对葱兰愈伤组织的诱导

图2 葱兰幼苗
从实验结果来看,MS+2,4-D 0.1 mg/L 和MS+2,4-D 0.2 mg/L 两个处理对葱兰愈伤组织的诱导有一定的促进作用,但效果不明显,当复合了6-BA 后,葱兰愈伤组织的诱导效果明显提高,愈伤组织诱导率提升至70.0%以上。随着2,4-D 浓度的增加,愈伤组织诱导率逐渐提高,MS+2,4-D 0.4 mg/L+6-BA 0.2 mg/L处理葱兰愈伤组织诱导率达90.0%,愈伤组织白色疏松,部分分化出芽,长势好,继代培养3 代后,愈伤组织仍具有增殖能力。MS+2,4-D 1.0 mg/L+6-BA 0.2 mg/L 处理葱兰愈伤组织诱导率最高,达93.3%,但其诱导出的愈伤组织继代培养后失去分裂能力,增生很困难。综合认为,在不考虑激素相互作用的前提下确定2,4-D 的最佳浓度为0.4 mg/L,这与邓祖丽颖等[7]的研究结果中2,4-D 适宜浓度1~2 mg/L 相比要低,更显经济。实验结果表明:2,4-D 与6-BA 复合能够有效地诱导葱兰愈伤组织,且部分能够分化出芽,与邓祖丽颖等[7]研究认为该激素组合不能由愈伤组织上分化出芽的结论不同,其原因可能与不同的激素浓度组合效果差异有关。
另外,在处理5 培养基MS+2,4-D 0.4 mg/L+6-BA 0.2 mg/L 中愈伤组织长势最好,长出了白色的芽,且继代培养中仍能保持愈伤组织增殖,这与龚雪琴等[8]在同科植物朱顶红的愈伤组织诱导上的研究结果很相似,该愈伤组织是否为胚性愈伤组织并未做进一步验证,但是,鲁娇娇等[9]研究证明朱顶红胚性愈伤组织的诱导需要TDZ 的参与。以上结果表明,诱导石蒜科植物愈伤组织可以使用激素2,4-D和6-BA 组合,并可通过调节二者的比例找到最适合的激素配方。
3.2 不同浓度激素组合对葱兰丛生芽的诱导
本研究选用了6-BA 与NAA 的激素组合对葱兰愈伤组织进行丛生芽的诱导,增加6-BA 浓度能够提高丛生芽的诱导率,MS+6-BA 1.0 mg/L+NAA 1.0 mg/L 处理丛生芽诱导率为66.7%,丛生芽的增殖系数为3.5,这与邓祖丽颖等[7]对同种激素组合的实验结果相近,与刘铎等[10]对朱顶红的研究结果相近。
3.3 葱兰种子愈伤组织、丛生芽最佳诱导培养基
本研究认为,葱兰种子愈伤组织的最佳诱导培养基为MS+2,4-D 0.4 mg/L+6-BA 0.2 mg/L,丛生芽诱导的最佳培养基为MS+6-BA 1.0 mg/L+NAA 1.0 mg/L。通过组织培养的方法,可以满足大规模园林绿化的需求,也丰富了生物技术在园林绿化植物上的应用。
4 展望与不足
用葱兰的种子作为外植体诱导愈伤组织和丛生芽取得了一定的进展,对葱兰大规模的生产具有一定的参考作用,但外植体的来源还不丰富,对丛生芽诱导培养基、胚性愈伤组织的诱导还需进一步优化,对不定根的诱导及幼苗的移栽都有待进一步研究。

