膳食中短链氯化石蜡的污染状况及风险暴露评估
陈慧玲,申金山,王雪光,杨立新*
(1.河北师范大学化学与材料科学学院化学实验教学中心,河北 石家庄 050024;2.河北省疾病预防控制中心,河北 石家庄 050021)
氯化石蜡(chlorinated paraffins,CPs)是石蜡烃的氯化衍生物,在工业上用作增塑剂、阻燃剂、润滑剂和金属加工添加剂等[1-4]。氯化石蜡可分为短链氯化石蜡(short chain chlorinated paraffins,SCCPs)(10~13 个碳原子)、中链氯化石蜡(middle chain chlorinated paraffins,MCCPs)(14~17 个碳原子)和长链氯化石蜡(long chain chlorinated paraffins,LCCPs)(18~30 个碳原子)3 类。CPs的氯化程度通常为30~70(质量分数)[5]。目前,我国是世界上最大的CPs生产国。截止2015年,我国CPs总产能达到160万 t,氯化石蜡产品中SCCPs的含量在6以上[6-7]。SCCPs具有较强的生物蓄积性、持久性、远距离迁移性和毒性[8-12],长期接触可能致癌[13-14],所以其受到广泛的关注。近年来,加拿大、美国、日本、欧盟等国家已禁止生产和限制使用SCCPs[15-16],并提交了多份风险评估报告[2,17-18]。2008年,《斯德哥尔摩公约》将SCCPs列入持久性有机污染物(persistent organic pollutants,POPs)备选清单中。2016年9月在意大利罗马召开的《斯德哥尔摩公约》POPs审查委员会第12次会议上,委员会审议通过了SCCPs风险管理评估草案[19]。2017年,《斯德哥尔摩公约》缔约国大会将讨论商用SCCPs的增列问题[20]。
SCCPs广泛存在于各种环境介质中。在土壤[8,21]、水体[10,22-23]、大气[24-25]及生物体[9,26-27],甚至在偏远地区都检测到SCCPs[28]。目前,SCCPs相对于其他POPs,其研究数据非常有限,而食品中SCCPs污染状况的检测数据较少,更没有开展膳食暴露评估研究的相关报道。因此,开展膳食中SCCPs的相关检测研究,对于了解我国膳食中SCCPs的污染状况及其对人体健康的影响极为重要。
本实验采用索氏提取技术对膳食中SCCPs进行提取,以酸化硅胶复合层析柱法对样品进行净化处理,建立了一种测定膳食中SCCPs的方法,即在线凝胶渗透色谱-气相色谱-负化学离子源-质谱(on-line gel permeation chromatography-gas chromatography-negative chemical ion source-mass spectrometry,GPC-GC-NCI-MS)。本实验对膳食中的SCCPs进行了定量分析,旨在了解中国北部膳食中SCCPs的污染现状。
1 材料与方法
1.1 材料与试剂
弗罗里硅土、硅胶、无水硫酸钠均在马弗炉中600 ℃高温活化4 h,制备质量分数为40的酸性硅胶。
正己烷、二氯甲烷、丙酮、环己烷和壬烷(农残级)德国默克公司;SCCPs、六氯环己烷、反式氯 德国Dr. Ehrenstorfer公司;无水硫酸钠(分析纯) 天津永大化学试剂有限公司;浓硫酸(优级纯) 天津科密欧化学试剂有限公司。
SCCPs混合物标准溶液:将质量浓度为100 ng/μL、3 种不同氯质量分数(51.5%、55.5%和63.0%)的SCCPs用正己烷配成0.500 ng/μL的标准溶液。然后用所配混合物标准溶液1∶1(V/V)混合得到氯质量分数分别为53.5%和59.25%的SCCPs混合物标准溶液,其混合物标准溶液的质量浓度均为0.500 ng/μL。六氯环己烷和反式氯丹分别作为进样内标和提取内标。
1.2 仪器与设备
GCMS-QP2010 Ultra气相色谱质谱联用仪(gas chromatograph-mass spectrometer,GC-MS) 日本岛津公司;N-EVAPTM112氮气吹干仪 美国Organomation公司;KQ-600E型超声波清洗器 昆山超声仪器有限公司;CoolSafe55-4冷冻干燥仪 丹麦LaboGene公司;SX2-5-12箱式电阻炉 天津东丽实验电炉厂;KSW温度控制器 捷达温度仪表厂;38-1-B电子调温电热套天津市泰斯特仪器有限公司;SB-35旋转蒸发仪 日本Rikakikai公司。
1.3 方法
1.3.1 样品采集
膳食样品采集地区:北京、石家庄、张家口、承德、秦皇岛、廊坊、邢台、唐山以及内蒙古呼伦贝尔地区,以内蒙古呼伦贝尔地区作为背景地区。
采用混合食物样品法将食物样品归为9大类:豆类及其制品、谷类及其制品、蔬菜类及其制品、薯类及其制品、水果类及其制品、蛋类及其制品、乳类及其制品、肉类及其制品、水产类及其制品。分别在各个调查点所在的居委会或村附近的食物采购点,如菜市场、副食店、粮店、农贸市场或农民家采集各种食物样品,实际采集量略大于计算的采样量。估计采样量为每类食物4~5 kg。采集选择新鲜的食物样品。采集后马上运到烹调加工地点进行加工。如不能立即烹调,则放入4 ℃冰箱保存,生肉和水产品则贮存在冰箱冷冻室内备用。采用入户称质量加三餐记帐法结合三餐24 h询问加登记法获得膳食消费量。按一定原则聚类后形成采样单,在调查点附近采样并按当地膳食习惯进行烹调。按聚类后成人男子平均消费量制备分类食品混合样品。
1.3.2 样品前处理
准确称取9.00 g无水硫酸钠、1.00 g样品,混合均匀,装入无胶滤筒里。将所盛样品的无胶滤筒放入提取管内。称5.00 g酸性硅胶放入提取瓶内,然后加入120 mL正己烷-二氯甲烷(1∶1,V/V)混合溶液进行8 h索氏提取。将提取液旋转蒸发浓缩至近干(1~2 mL),待净化。
净化步骤:复合层析柱(内径26 mm)填料自下而上依次为3 g弗罗里硅土、2 g硅胶、8 g质量分数为40%的酸性硅胶和4 g无水硫酸钠。用50 mL正己烷淋洗层析柱,加入待测样品(该样品经索氏提取、旋转蒸发后,用正己烷润洗3~5 次,将润洗液加入酸化硅胶复合层析柱中);待测样品吸附后,先加入35 mL正己烷进行洗脱;更换干净且用正己烷润洗过的烧瓶作为接收瓶,再加入100 mL正己烷-二氯甲烷(1∶1,V/V)混合溶液进一步洗脱样品中极性稍强的SCCPs组分。将洗脱液旋转蒸发浓缩近干(1~2 mL),然后用5 mL正己烷溶解。将溶解了SCCPs的正己烷溶液用氮吹仪吹至近干,用200 μL正己烷定容并转移至进样小瓶中,待上机测试。
1.3.3 定量方法及仪器分析条件
利用Reth等[28]的定量方法,计算SCCPs混合物标准样品的总相对响应因子及氯质量分数,获得线性回归方程:Y=43.448X-1 911.284,R2=0.962(氯质量分数45%~65%)。利用Zeng Lixi等[29]提出的一种通过解二元一次方程组消除干扰的数学计算方法来排除干扰物质MCCPs,定性定量离子见表1。
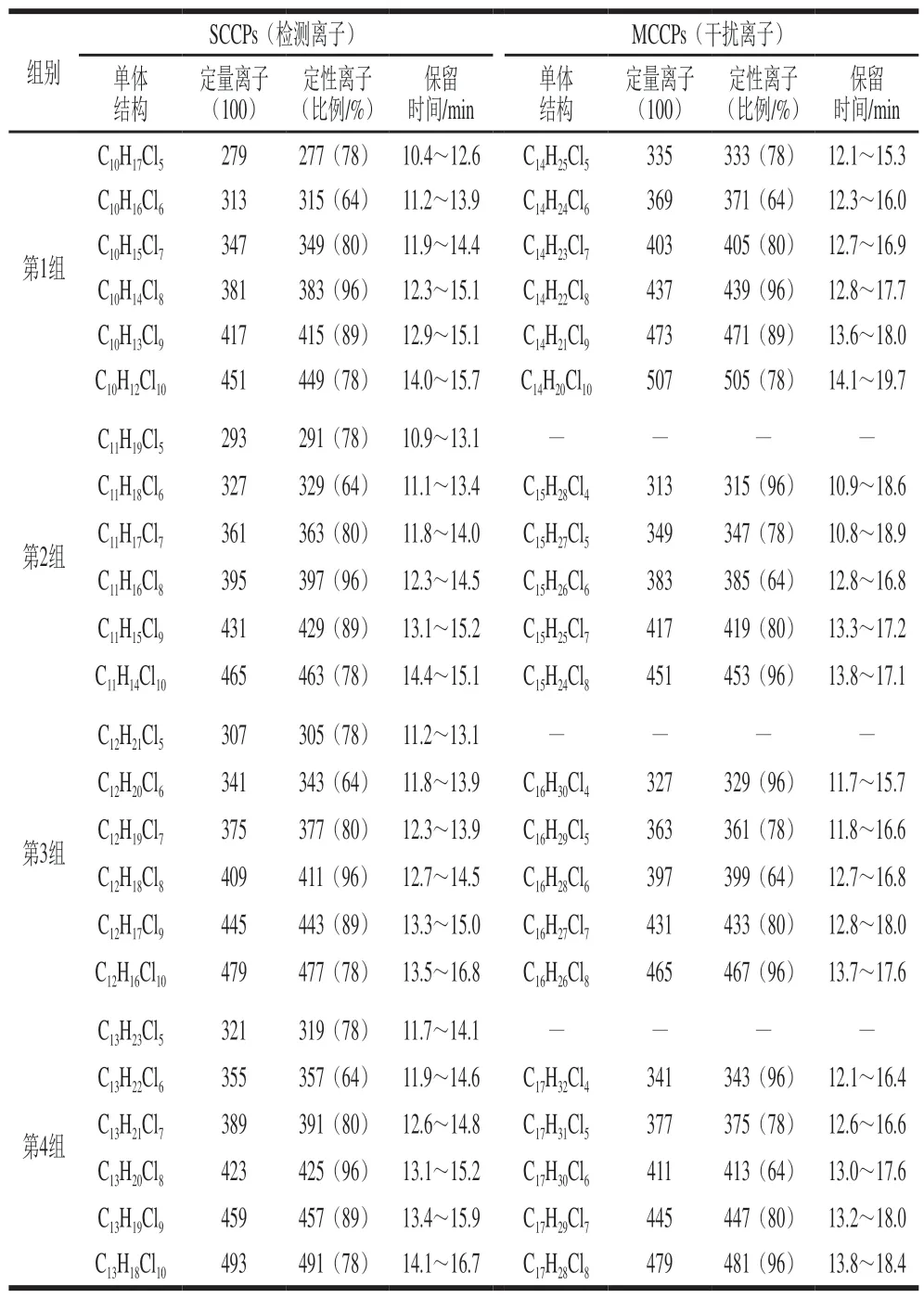
表 1 SCCPs和MCCPs检测[M-Cl]-离子的分组及质荷比Table 1 Mass-to-charge ratios of [M-Cl]- ions in SCCPs and MCCPs with the most abundant isotopes
色谱条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 µm)。升温程序:82 ℃保持5 min;以8 ℃/min升至100 ℃,保持10 min;然后以30 ℃/min迅速升至180 ℃,保持5 min;最后以30 ℃/min升至310 ℃,保持22 min。进样量为1 μL,不分流进样。以氦气(纯度≥99.999)作为载气,流速为1 mL/min。反应气为甲烷(纯度99.995),流速2 mL/min。进样口温度为280 ℃。离子源和传输线温度分别为150 ℃和260 ℃,溶剂延迟9 min。SCCPs的扫描离子参照Tomy等[22]的报道。反式氯丹和六氯环己烷的扫描离子分别为419.8和254.9。
1.3.4 质量控制
所用玻璃器皿均在浓硫酸中浸润过夜,然后用蒸馏水进行冲洗,烘干,待用。使用前均用正己烷润洗。填料均在600 ℃高温活化4 h后使用。
在仪器条件下,SCCPs的检出限(RSN≥3)和定量限(RSN≥10)分别为10.7、35.7 ng。平均回收率为78.2,相对标准偏差(n=6)为5.7。每批4 个样品均加一个过程空白以检查玻璃器皿或有机溶剂等的干扰。实际样品中同位素内标的回收率为84~102。
1.3.5 膳食暴露风险评估
根据所测得膳食样品中SCCPs的污染水平和居民的食物消费量数据计算得到每人每日膳食暴露量,平均暴露量根据公式(1)计算。
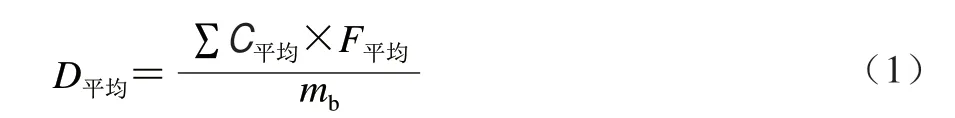
式中:D平均为平均暴露量/(ng/kgmb);∑C平均为某类食物中SCCPs的平均含量/(ng/g);F平均为某类食物的人群平均消费量/(g/d);mb为被评估人群的平均体质量/kg,通过分析2016年采样地区居民营养和健康状况的检测结果,得出本研究目标人群的mb是63 kg。
在暴露量计算过程中,遵循国际惯例,假设SCCPs在体内100吸收。将获得的膳食样品中SCCPs的平均暴露量与推荐的SCCPs的暂定每日最大耐受摄入量(provisional maximum tolerated daily intake,PMTDI)进行比较,得出暴露量占PMTDI的比例(PMTDP),以此考察SCCPs膳食摄入量的安全性。若膳食摄入量小于PMTDI,即膳食摄入量占PMTDI的比例小于100,说明膳食暴露风险可接受,若膳食摄入量大于PMTDI,即膳食摄入量占PMTDI的比例大于100,说明存在膳食暴露风险不可接受。PMTDP根据公式(2)计算。
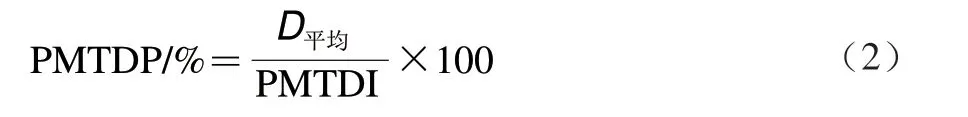
其中北京市膳食调查数据采用河北省相关数据,内蒙古呼伦贝尔地区靠近黑龙江省,因此采用黑龙江省调查数据(表2)。
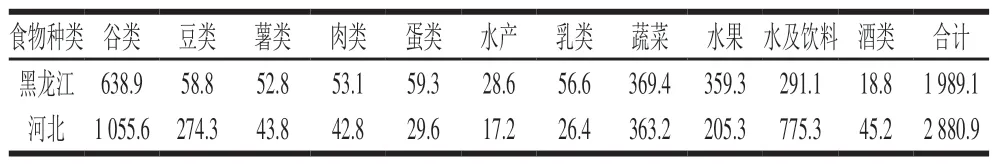
表 2 2016年膳食调查黑龙江及河北食物消费数据Table 2 Dietary survey of food consumption in Heilongjiang and Hebei province in 2016 g/d
1.4 数据统计分析
数据统计分析采用SPSS 13.0软件,采用单因素方差分析,显著水平小于0.05时认为差异显著,相关性具有统计意义。使用Origin 7.0软件绘图。
2 结果与分析
2.1 膳食样品中SCCPs的含量
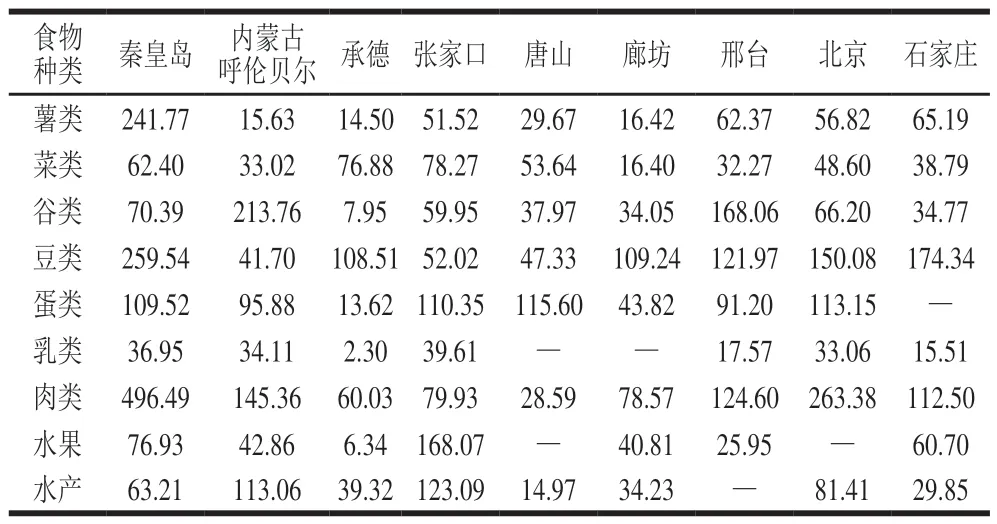
表 3 膳食样品中SCCPs含量Table 3 SCCPs contents in foodstuff samples ng/g
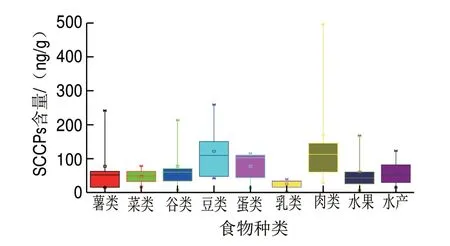
图 1 不同样品中短链氯化石蜡的含量(湿质量)Fig. 1 SCCPs contents in different kinds of foodstuffs (wet basis)
按照1.3节所述方法对膳食样品中的SCCPs进行检测,在所有样品中均检测出SCCPs,检测结果见表3和图1。膳食样品中SCCPs含量范围是2.30~496.49 ng/g(湿质量),平均值为77.22 ng/g。在采集的9 种膳食样品中,肉类污染最严重。肉类中SCCPs含量范围为28.59~496.49 ng/g(湿质量),平均值为154.38 ng/g。在秦皇岛采集的肉类,SCCPs含量最高,为496.49 ng/g;在唐山采集的肉类,SCCPs含量最低,为28.59 ng/g。乳类污染最小,乳类中SCCPs含量范围为2.30~39.61 ng/g(湿质量),平均值为25.59 ng/g。
就地区而言,各地区膳食样品中SCCPs平均值含量范围是36.61~157.47 ng/g。在秦皇岛采集的膳食样品中,SCCPs平均值含量最高,为157.47 ng/g;其次是北京,为101.59 ng/g;在承德采集的膳食样品中,SCCPs平均值含量最低,为36.61 ng/g。由于采样城市都集中在华北地区,所以就地区而言,没有明显差异。
本实验研究的9 种膳食样品中,薯类、菜类、谷类、豆类和水果属于植物性食品,蛋类、乳类、肉类和水产属于动物性食品。实验结果显示,植物性食品中SCCPs含量低于动物性食品中SCCPs含量,这可能是SCCPs具有生物累积性所致。人们食用动物性食品越多,体内SCCPs含量可能越多,对人体危害可能越大。
姜国等[30]检测了上海食用鱼体内的SCCPs含量,得到食用鱼肌肉中SCCPs的含量范围为36~801 ng/g。王成等[31]检测了渤海辽东湾海域的底栖动物、浮游动物和鱼类并分析了其SCCPs含量,结果显示,采集的水生动物中SCCPs的含量变化范围为0.66~20.31 µg/g(干质量)。Harada等[32]检测了中国、日本和韩国1993年—2009年间的60 个膳食样品,结果显示我国的膳食样品中2009年的最高浓度达到了28 ng/g,其含量水平高于日本和韩国膳食样品中SCCPs的含量。总地来说,本研究膳食样品中SCCPs含量高于世界已报道的膳食样品中SCCPs含量。
2.2 膳食样品中SCCPs的同系物分布模式
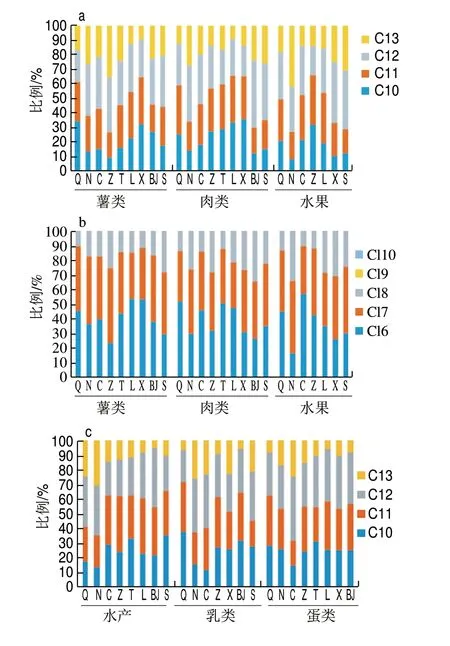
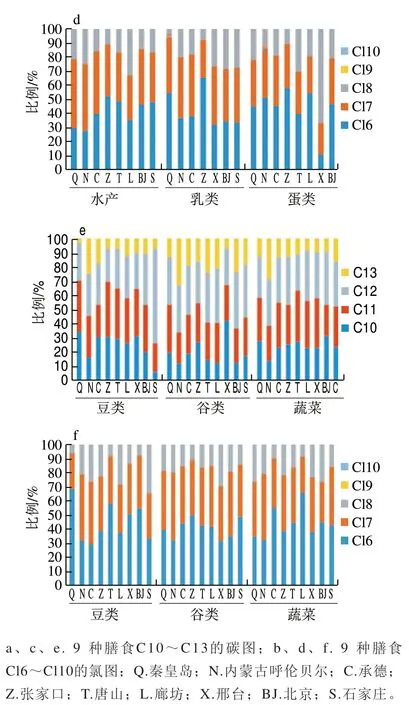
图 2 短链氯化石蜡在膳食中的同系物分布Fig. 2 Distribution of SCCP homologues in foodstuffs
图2为膳食样品中SCCPs各同系物的色谱峰面积占总SCCPs色谱峰面积的比例。Cl6和Cl7组分是氯分布中相对丰度较高的组分,分别约占SCCPs总丰度的45.89和36.09;其次是Cl8组分,约占总丰度的18.02;Cl9和Cl10组分在膳食样品中几乎没有。对于Cl6和Cl7组分而言,豆类中含量最多,水产中含量最少;对于Cl8组分而言,含量相对较少。采集的膳食样品之间,短链氯化石蜡的同系物分布基本相似,C10、C11、C12组分占总丰度的比例相对较高,C13最少。在膳食样品中,SCCPs同系物组分分布为C12>C11>C10>C13。其中,C12和C11组分相近,分别约占SCCPs总丰度的30.71和29.89;C10组分约占SCCPs总丰度的26.60;而C13组分约占SCCPs总丰度的12.80。
姜国等[30]检测了上海食用鱼体内的SCCPs含量,发现食用鱼肌肉中SCCPs以C10和C11为主要组成部分。王成等[31]检测的水生动物中SCCPs以C10和C11为主要组成部分,并且SCCPs的含量随着食物链或食物网中营养级的增高呈增大的趋势。而本研究膳食样品中SCCPs以C10、C11和C12为主要组成部分,与文献报道有差异。
2.3 膳食暴露评估结果
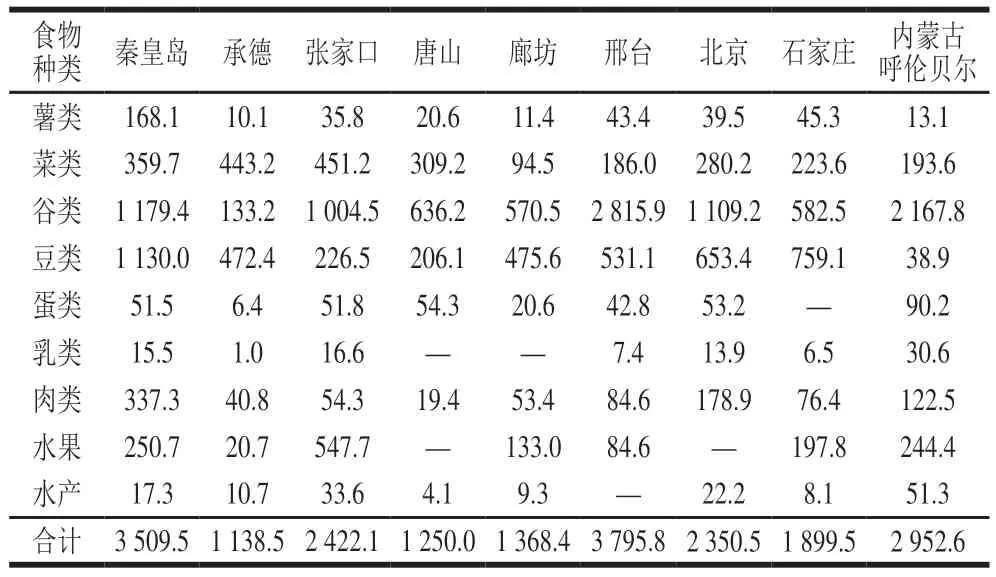
表 4 膳食暴露评估结果Table 4 Assessment of dietary exposure to SCCPs ng/(kg·d mb)
由表4可知,膳食暴露最为严重的地区出现在邢台,达到了3 795.8 ng/(kg·dmb)。秦皇岛地区次之,暴露量为3 509.5 ng/(kg·dmb)。暴露量最小的地区为承德,暴露量为1 138.5 ng/(kg·dmb)。邢台处于我国的工业污染物腹地,秦皇岛处于沿海地区,水环境可能污染比较严重。呼伦贝尔地区膳食暴露水平为2 952.6 ng/(kg·dmb),在各个检测地区中处于相对较高的水平。呼伦贝尔虽然远离我国的重工业区,也不存在明显的污染源,其严重的膳食污染,可能是由于当地纬度高,气温常年偏低,对于SCCPs有较强的蓄积能力,这从侧面也反映了SCCPs较强的远距离迁移能力及在高纬度地区蓄积的迁移规律。采样地区的整体污染平均水平为2 298.5 ng/(kg·dmb)。
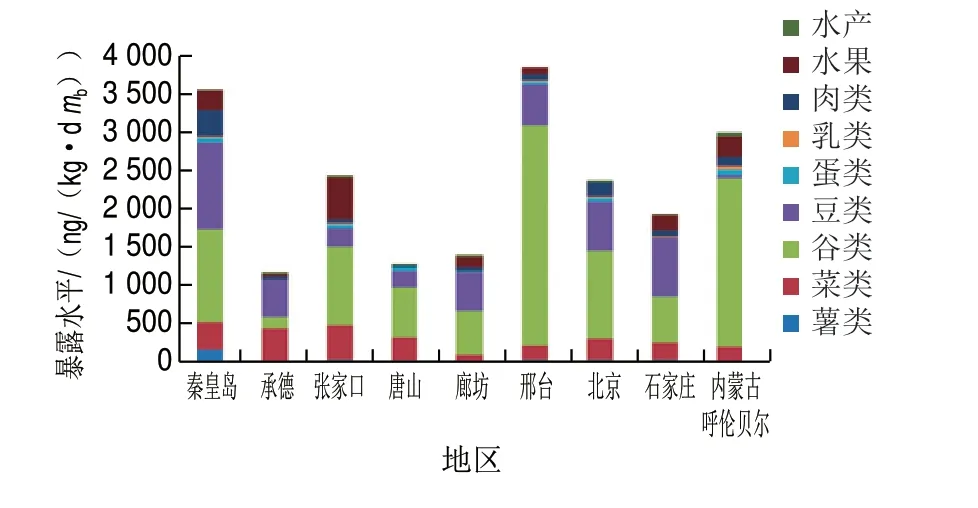
图 3 膳食中短链氯化石蜡的来源Fig. 3 Dietary sources of SCCPs
从图3可以看出,各地SCCPs暴露来源差异比较大。其中谷物是SCCPs的最大来源,所占比例最高,可以达到73.8(邢台)和73.4(内蒙古呼伦贝尔),第二大来源为豆类,所占比例最高可以达到41.5(承德)和39.0(石家庄)。实验检测结果显示,动物性食品浓度明显高于植物性食品,而膳食暴露来源中,动物性食品所占比例远低于植物性食品,这是由于我国偏重于谷物的膳食结构所致。
Harada等[32]曾检测过中、日、韩三国1993年—2009年间膳食中SCCPs摄入量,结果显示在2009年我国北京人群膳食样品中SCCPs的平均摄入量为620 ng/(kg·dmb),比1993年增加了约10 倍,比同一时期日本和韩国高出1~2 个数量级。本研究膳食样品中北京人群SCCPs摄入量约为2 350.5 ng/(kg·dmb),比2009年提高近4 倍。
1996年,《国际化学品安全方案》给出的SCCPs的每天最大耐受摄入量是100 μg/(kg·dmb)[33-34]。采用SCCPs 100 μg/(kg·dmb)作为毒理参考值,我国华北地区人群的膳食暴露风险在1.1~3.8之间。膳食暴露风险小于100,即说明膳食暴露风险尚可接受,膳食中SCCPs的含量对人体健康尚未构成威胁。虽然膳食中的SCCPs总体暴露风险不高,但是应该注意到在过去的8 年,我国人群中膳食污染浓度增速很快,增长了近4 倍。因此,应该注意到SCCPs可能带来的潜在风险。
3 结 论
膳食样品中SCCPs含量变化范围是2.30~496.49 ng/g(湿质量)。在肉类中SCCPs含量最多,为496.49 ng/g;在乳类中SCCPs含量最少,为2.30 ng/g。本研究膳食样品中SCCPs含量处于世界已报道的膳食样品中SCCPs含量变化范围的中高水平。
采集的膳食样品之间SCCPs的同系物分布模式相似,均以低氯取代Cl6~Cl7的C10-/C12-SCCPs为主要组成部分,与文献报道有差异。
结合膳食消费量数据,对我国华北地区人群的SCCPs膳食暴露风险进行了评估,发现我国华北地区人群的膳食暴露风险在1.1~3.8之间。膳食暴露风险小于100,即说明膳食暴露风险尚可接受,但这并不意味着人类健康没有存在风险。在过去的8 年内,膳食中SCCPs污染浓度增长迅速,应该注意其可能带来的潜在风险。
目前,膳食中SCCPs污染状况的检测数据较少。因此,测定膳食中SCCPs的含量并分析其分布模式,能为了解我国膳食中SCCPs的污染状况及其对人体健康的影响,提供数据参考。

