硫酸化羊肚菌多糖调控胆固醇代谢作用
唐瑜婉,张月巧,李 瑶,雷 琳,李富华,2,赵吉春,2,吴素蕊,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715;3.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
高脂血症是引起心血管疾病的危险因素之一,其主要特征是血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)水平升高。研究表明,他汀类、贝特类等降胆固醇药物会带来不良反应或禁忌症[1]。因此,近年来开发治疗高脂血症的天然脂质调节剂受到了越来越多的关注,黑脉羊肚菌(Morchella angusticepsPeck)就是其中之一。据报道,羊肚菌广受欧洲、亚洲和北美地区欢迎,其多糖具有改善免疫功能、抑制微生物和肿瘤生长、促进降血脂、抗氧化和抗疲劳等功效[2-7]。
多糖的生物活性主要受其单糖组成、主链的糖苷键、分支度、取代度和主链构象的影响[8]。研究表明,多糖的羟基被硫酸基团部分取代可以增强其生物活性[9-10]。本课题组前期报道了纯化的水溶性黑脉羊肚菌多糖(polysaccharides fromMorchella angusticepsPeck,PMEP)及其羧甲基化衍生物的制备、结构表征和生物活性[11-12]。对多糖进行结构修饰已成为提高其生物活性的常用方法[13-14]。但是,目前鲜有关于硫酸化PMEP(sulfated PMEP,SPMEP)降血脂活性的研究。
本实验旨在对SPMEP和PMEP进行结构表征,并研究其在高胆固醇血症大鼠体内的降胆固醇活性。同时,研究SPMEP和PMEP对血浆脂蛋白、短链脂肪酸(short-chain fatty acids,SCFA)水平和胆汁酸排泄的影响。为探讨其潜在机制,进一步测定参与胆固醇代谢的酶和受体(包括3-羟基-3-甲基戊二酰CoA还原酶(3-hydroxy-3-methyl-glutaryl-coenzyme A reductase,HMG-CoA)、7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、低密度脂蛋白受体(low-density lipoprotein receptor,LDL-R)和肝清除细胞B1受体(scavenger receptor class B member 1,SR-B1))的表达。
1 材料与方法
1.1 动物、材料与试剂
雄性SD大鼠(SPF级),生产许可证号:SCXK-(军)2011-0011,购自重庆腾鑫生物技术有限公司。
黑脉羊肚菌(Morchella angusticepsPeck) 昆明食用菌研究所;TG、TC、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒四川迈克生物科技公司;Western blotting试剂盒、载脂蛋白(apolipoprotein,Apo)AI、ApoB、卵磷脂胆固醇脂酰基转移酶(lecithin-cholesterol acyltransferase enzyme,LCAT)试剂盒 南京建成生物工程有限公司;胆汁酸试剂盒 上海研谨生物有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Spectrun100型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪 美国Perkin Elmer公司;MOS-450型圆二色光谱仪 法国Bio-Logic公司;3400N型扫描电子显微镜 日本Hitachi公司;ModeIII5500型原子力显微镜 美国Agilent Technologies公司;GC-2010型气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 PMEP的制备
以黑脉羊肚菌(Morchella angusticepsPeck)为原料,烘干后经过水提醇沉,过DEAE-52纤维素柱后层析,采用Sephadex G-100凝胶柱分离纯化制得PMEP[11]。参考Reitz等[15]的氯磺酸吡啶法对PMEP进行硫酸化修饰,并作适当修改。制备硫酸酯化试剂:向冰浴的三角瓶中缓慢加入预冷无水吡啶,充分冷却15 min,剧烈搅拌下向三颈瓶中滴加氯磺酸(每12 mL吡啶滴加1 mL氯磺酸)。取100 mg PMEP置于无水甲酰胺中磁力搅拌20 min,迅速75 ℃水浴搅拌1.5 h,反应结束后加入50 mL预冷纯水,加2.5 mol/L NaOH中和,自来水透析48 h,纯水透析12 h,旋转蒸发浓缩,乙醇沉淀,冷冻干燥得SPMEP。
1.3.2 PMEP和SPMEP的表征
1.3.2.1 SPMEP取代度的测定
参考Zaleska等[16]的方法并稍作改进,将100 mg SPMEP溶解在10 mL 1 mol/L HCl中,并于100 ℃水浴水解4 h,取1.0 mL消化液用1 mol/L盐酸溶液稀释至10 mL。再准确量取0.5 mL稀释液,加入7.50 mL三氯乙酸溶液和2.0 mL氯化钡-明胶溶液,混匀后在真空条件下脱气,然后在360 nm波长处测吸光度,根据由硫酸钾构建的校准曲线(其线性回归方程为:y=0.012 3x+0.013 9,R2=0.990 1)计算SPMEP的硫酸根含量。取代度根据下式计算。
式中:ω为SPMEP中硫酸根质量分数/%。
1.3.2.2 FT-IR分析
通过KBr压片法进行PMEP和SPMEP的FT-IR光谱分析。将5 mg PMEP或SPMEP与100 mg KBr粉末混合充分研磨,然后分别压片,在4 000~400 cm-1范围进行扫描[17]。
1.3.2.3 扫描电子显微镜观察
分别称取适量干燥的PMEP和SPMEP黏着于锡箔纸片上,将其置于真空喷镀仪内喷金、镀导电层,采用3400N型扫描电子显微镜进行观察[18]。
1.3.2.4 圆二色光谱分析
将0.61 mg/mL PMEP和0.78 mg/mL SPMEP于180~500 nm范围进行圆二色光谱扫描,时间常数为1 s,狭缝宽度为1 nm,扫描点间隔为1 nm[14]。
1.3.2.5 原子力显微镜观察
配制一定质量浓度的PMEP和SPMEP,在3~4 nN、2 kHz条件下进行原子力显微镜观察。
1.3.3 动物实验
1.3.3.1 动物分组与饲养
48 只雄性SD大鼠((190±20)g),在温度(25.0±0.5)℃、相对湿度(50±5)%、正常日夜循环条件下饲喂,实验前自由进食饮水一周,根据体质量随机分为6 组,分别按以下方式饲喂:模型(高脂)对照组(MC):喂食高胆固醇饲料;阳性(药物)对照组(PC):喂食高胆固醇饲料,灌胃15 mg/(kg•d)的辛伐他汀药物;PMEP低剂量组(PMEP-L):喂食高胆固醇饲料,灌胃25 mg/(kg•d)的PMEP;PMEP高剂量组(PMEP-H):喂食高胆固醇饲料,灌胃75 mg/(kg•d)的PMEP;SPMEP低剂量组(SPMEP-L):喂食高胆固醇饲料,灌胃25 mg/(kg•d)的SPMEP;SPMEP高剂量组(SPMEP-H):喂食高胆固醇饲料,灌胃75 mg/(kg•d)的SPMEP;高胆固醇饲料含有基础饲料87.6%(质量分数,下同)、胆固醇2%、猪油10%、猪胆盐0.4%。
饲喂4 周后禁食12 h,在乙醚麻醉下断头取血,4 ℃,4 000 r/min离心5 min,收集血清。摘除肝脏,用冷生理盐水清洗,吸干水分后称质量,然后在液氮中冷冻。取出小肠,收集内容物真空冷冻干燥备用。收集实验最后3 d大鼠粪便,真空冷冻干燥后贮存备用。所有样品于-80 ℃条件贮存。
1.3.3.2 生化分析
参照Li Yao等[12]的方法用试剂盒测定血清中的TC、TG、HDL-C质量浓度。TC质量浓度与HDL-C质量浓度的差即为non-HDL-C质量浓度[19]。ApoAI、ApoB、LCAT质量浓度采用试剂盒检测。参考Folch等的方法[20],用氯仿-甲醇溶液(体积比2∶1)提取肝脏TC和TG,用试剂盒进行测定。粪便和小肠总胆汁酸(total bile acids,TBA)含量采用试剂盒检测。
1.3.3.3 肝组织学分析
将一部分肝组织用波恩试剂固定,贮存在体积分数70%乙醇溶液中,石蜡包埋,然后用切片机切成5 μm厚的半脉血管组织切片[12]。载玻片用苏木精和曙红染色,使用配备Olympus B红染色显微镜的高分辨率数码相机获得图像。
1.3.3.4 Western blotting分析
取0.2 g肝脏组织全蛋白,采用试剂盒进行测定。参考Burnette[21]的方法进行Western blotting分析,并略作修改。蛋白质采用质量分数5%~15%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,然后转移到Hybond-P聚偏二氟乙烯膜上。膜的非特异性结合位点被脱脂乳阻断后,加入用一抗稀释液稀释200 倍体积的一抗(anti-HMGCoA-R或anti-LDL-R、anti-SR-B1、anti-CYP7A1),于4 ℃温育过夜;洗涤膜,在二抗(用二抗稀释液4 000 倍体积稀释)中于4 ℃下再孵育1~2 h,显影,通过Quantity One®软件分析图像。HMG-CoA、LDL-R、SR-B1和CYP7A1的质量浓度用β-肌动蛋白标准化。
1.3.3.5 SCFA含量分析
SCFA含量的测定参考Zhao Guohua等[22]的方法并略有修改。称取大鼠粪便0.5 g,加入生理盐水4 mL,均质、离心,过有机滤膜后取上清液1 mL,加入11 μL内标物质(2-乙基丁酸)于-4 ℃条件下贮存备用。用气相色谱法对粪便中的SCFA组成及含量进行分析。检测条件如下:RTX-WAX柱(30 m×0.25 mm,0.25 μm),氢火焰离子检测器,N2为载气,压力88 kPa。进样量1 μL,进样口温度200 ℃,分流进样,分流比25∶1,线速率26.4 cm/s。总流量24.8 mL/min,柱流量0.91 mL/min,吹扫流量1.0 mL/min,柱温100 ℃;平衡时间3.0 min;总程序时间17.5 min。
1.4 数据统计与分析
数据表示为平均值±标准偏差,n=8。利用Origin 8.6软件进行数据处理与作图。运用SPSS 17.0软件进行不同动物分组之间的方差分析和Duncan’s检验,P<0.05为差异显著。
2 结果与分析
2.1 PMEP及SPMEP的取代度及FT-IR分析结果

图 1 PMEP及SPMEP的FT-IR图谱Fig. 1 FT-IR spectra of PMEP and SPMEP
根据硫酸钾构建的校准曲线(其线性回归方程为:y=0.012 3x+0.013 9,R2=0.990 1)计算得到SPMEP的硫酸根相对含量为39.04%,取代度为1.106 7。由图1可知,PMEP和SPMEP的FT-IR均显示在3 200~3 250 cm-1附近有典型的吸收峰,为O—H的伸缩振动。硫酸化后,在2 960 cm-1附近出现新的吸收峰,为—CH2—(亚甲基)的对称伸缩振动,在2 850.07 cm-1处增加的峰是—CH2—的对称伸缩振动。在1 046.77 cm-1处是O—SO2—O(硫酸基团)中S=O的对称伸缩振动,748.68 cm-1处是C—O—SO2中C—O—S的伸缩振动,这一组峰是硫酸化多糖的特征吸收峰,说明PMEP硫酸化修饰成功。
2.2 PMEP及SPMEP的扫描电子显微镜观察结果

图 2 PMEP(A)及SPMEP(B)的扫描电子显微镜图Fig. 2 Scanning electron micrographs of PMEP (A) and SPMEP (B)
利用扫描电子显微镜得到PMEP修饰前后的显微成像(图2),从而观察二者的形貌差异。由图2A可知,PMEP呈不对称棒状聚集态,由许多分子或基团聚集而成的,表面粗糙不平,有许多小孔。由图2B可知,SPEMP呈光滑碎片状,表面积增大,多个片层紧密堆积,层次感强,说明经过硫酸化修饰后,PMEP的分子间作用力增大,形成了更大的分子聚集体。
2.3 PMEP及SPMEP的圆二色光谱和原子力显微镜分析结果

图 3 PMEP和SPMEP的圆二色光谱图(A)和原子力显微镜图(B、C)Fig. 3 Circular dichroism (A) and atomic force microscopic (B, C)images of PMEP and SPMEP
图3A为PEMP和SPMEP的圆二色光谱图。PMEP和SPMEP均在180~210 nm波长之间具有正峰值,而SPMEP在182 nm和195.5 nm波长左右有两个负峰。说明经过硫酸化修饰后PMEP在182 nm和195.5 nm波长处增加了两个负峰,使多糖分子发生不对称的变化,这是硫酸基团的贡献结果,导致PEMP在溶液中的构象发生了变化。
为获得多糖的链结构,采用三维原子力显微镜分别观察了PEMP和SPMEP的形貌(图3B、C)。和PMEP相比,SPMEP的振幅参数均较低,有更多不同尺寸的球形颗粒,其表面高峰变少,突起的陡峭度下降,高度分布差异变小,说明引入呈强电负性的硫酸基团后,糖环构象发生了扭曲或转变,其排斥作用使多糖的卷曲构象伸展,糖链伸长,突起的陡峭度和高度下降。
2.4 PMEP及SPMEP对大鼠体质量、采食量及饲料效率的影响
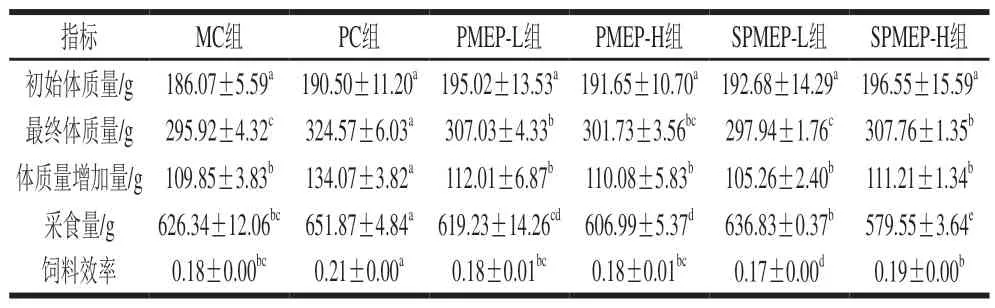
表 1 PMEP及SPMEP对大鼠体质量、采食量及饲料效率的影响Table 1 Effects of SPMEP and PMEP on body mass gain and food intake of SD rats
由表1可知,与MC组相比,PMEP-L组、PMEP-H组、SPMEP-L组、SPMEP-H组大鼠体质量增加量差异不显著,PC组显著升高(P<0.05)。与MC组相比,PMEP-L组和PMEP-H组的饲料效率差异不显著,SPMEP-H组的饲料效率上升。说明灌胃PMEP和SPMEP对高脂膳食大鼠的体质量增加量影响不大,高剂量SPMEP能显著提高高脂膳食大鼠的饲料效率。
2.5 PMEP及SPMEP对大鼠血清和肝脏指标的影响

表 2 PMEP及SPMEP对大鼠血清和肝脏指标的影响Table 2 Effects of SPMEP and PMEP on serum and liver parameters of SD rats
如表2所示,4 周后MC组大鼠血清TC、TG质量浓度分别为92.85、117.75 mg/dL,而PC组(辛伐他汀)能显著阻止血清TC质量浓度(下降约22%)和TG质量浓度(下降约23%)的升高(P<0.05)。SPMEP在阻止血清TC质量浓度(71.26~78.50 mg/dL)和TG质量浓度(86.44~91.72 mg/dL)升高方面比PMEP(TC质量浓度(79.13~82.75 mg/dL)、TG质量浓度(90.77~97.45 mg/dL))更有效(P<0.05)。与MC组相比,PC、PMEP、SPMEP组血清HDL-C、ApoAI、LCAT质量浓度显著升高(P<0.05),ApoB质量浓度显著降低。高脂饮食引起肝脏脂质堆积,与MC组相比,辛伐他汀、PMEP-H、SPMEP-H均能显著降低肝脏TC(分别降低28.05%、23.08%、28.52%)、TG(分别降低14.79%、10.15%、10.57%)含量,SPMEP显著升高肝脏LCAT质量浓度(P<0.05)。
2.6 PMEP及SPMEP对大鼠粪便和肠道中SCFA和TBA含量的影响

表 3 PMEP及SPMEP对大鼠粪便和肠道中SCFA和TBA含量的影响Table 3 Effects of SPMEP and PMEP on the contents of fecal shortchain fatty acids and intestinal bile acids in SD rats
由表3可知,PC、SPMEP和PMEP组中乙酸、丙酸、异丁酸和丁酸含量均显著低于MC组(P<0.05)。此外,SPMEP-H组中丙酸、异丁酸和丁酸含量显著高于PMEP-H组(P<0.05)。与MC组相比,PC、PMEP和SPMEP组粪便TBA的排泄量增加(P<0.05),然而,只有PC和SPMEP组肠道TBA含量显著增加(P<0.05)。
2.7 PMEP及SPMEP对大鼠CYP7A1、HMG-CoA、SR-B1、LDL-R蛋白表达及肝脏组织的影响


图 4 PMEP及SPMEP对大鼠肝脏CYP7A1(A)、HMG-CoA(B)、SR-B1(C)、LDL-R(D)的表达水平及肝组织形态(E)的影响Fig. 4 Effects of PMEP and SPMEP on hepatic protein expression levels of CYP7A1 (A), HMG-CoA (B), SR-B1 (C), and LDL-R (D) as well as morphological changes (E) in SD rats
与MC组相比,喂食辛伐他汀、PMEP和SPMEP可上调大鼠肝脏CYP7A1的表达(图4A);然而,除PMEP-L组之外,其他组大鼠肝脏HMG-CoA的表达均显著下调(P<0.05)(图4B);仅PC组和SPMEP-H组肝脏LDL-R的表达显著增加(P<0.05)(图4D)。图4E显示,在大鼠的染色肝组织中观察到白色液滴形式的细胞内脂质积累。与MC组相比,加入辛伐他汀、SPMEP和PMEP均可以预防肝脏脂质积聚的增加。
3 讨 论
FT-IR、圆二色光谱和原子力显微镜分析结果表明,PMEP硫酸化修饰成功,其原始结构、光学活性和构象发生了明显变化。一方面,1 150~1 240 cm-1附近的弱峰表明存在吡喃糖[23],在1 046.77 cm-1处是O—SO2—O(硫酸基团)中S=O的对称伸缩振动[14](图1);另一方面,原子力显微镜分析表明PMEP和SPMEP的颗粒粒径高度大于单链多糖(约0.1~1 nm),说明存在分子间和/或分子内聚集[24](图3B、C)。SPMEP链上的硫酸基团具有较强的分子间和分子内相互作用[25]。扫描电子显微镜作为一种强有力的工具,有助于更好地了解多糖的基本物理性质。先前有研究报道了类似的蘑菇多糖和微生物多糖的多孔网状微结构[26]。本研究结果表明,经硫酸化处理后,多糖片段的外观改变为规则的均匀结构。不同的多糖和硫酸化过程中所涉及的反应可能在影响硫酸多糖的外观方面发挥重要作用[14,25]。
本课题组前期研究表明,PMEP具有降低大鼠血清TC水平的潜力[11],这与本研究结果一致。此外,SPMEP在降低大鼠血脂方面的能力强于PMEP,这与前人的研究结果[27-28]一致。本研究表明,SPEMP通过降低血清TC、TG、non-HDL-C水平,增加HDL-C水平,从而有利地改变血清脂蛋白水平。与MC组相比,SPMEP-H组粪便和肠道TBA含量增加28%~86%,而PMEP组仅增加9%~18%(表3),表明SPMEP在降低胆固醇方面比其天然结构更有效。细胞内胆固醇合成的调控和胆汁排泄在调节胆固醇体内平衡中起重要作用。
辛伐他汀是一种通过下调肝脏HMG-CoA、同时上调LDL-R表达而降低血浆脂质水平的药物,通常用作对照[29]。本研究结果显示肝脏HMG-CoA(一种负责胆固醇合成的限速酶)表达量在PC、PMEP和SPMEP组中降低(图4B)。相反地,在PMEP和SPMEP组中,LDL-R(一种负责血清LDL胆固醇摄取的受体)的表达呈增加趋势(图4D)[30-31]。与MC组相比,SPMEP-H组血清TC质量浓度降低23%,肝脏TC质量浓度降低29%,而PMEP仅使血清TC质量浓度降低11%~15%,肝脏TC质量浓度降低15%~23%(表2)。CYP7A1是一种将肝脏TC转化为胆汁酸的限速酶,有助于降低血清TC水平[32]。结果显示,辛伐他汀和高剂量SPMEP引起肝脏CYP7A1的表达分别显著增加了26%和28%,而高剂量PMEP使肝蛋白表达增加19%(图4A)。
PMEP和SPMEP都会被肠道菌群部分或全部发酵,主要发酵终产物为SCFA,如乙酸、异丁酸、丙酸、丁酸、戊酸、己酸等[33],这些SCFA通过抑制肝脏胆固醇合成来降低血清胆固醇浓度,例如限制HMG-CoA的作用或增加LDL-C的分解代谢[34]。本研究中,PC组、SPMEP组、PMEP组的乙酸、丙酸、异丁酸、丁酸含量均显著低于MC组(P<0.05)(表3)。并且除乙酸外,SPMEP-H组的丙酸、异丁酸和丁酸含量均显著高于PMEP-H组(P<0.05)(表3)。这可以部分解释SPMEP降胆固醇能力比PMEP强的原因[35]。
4 结 论
从黑脉羊肚菌中提取的PMEP经硫酸化修饰获得取代度为1.106 7的SPMEP,对SPMEP和PMEP进行结构表征,发现两者具有不同的光学活性和构象。通过动物实验证明:与PMEP相比,SPMEP降低血清TC、TG、non-HDL-C、ApoB水平和增加HDL-C、ApoAI、LCAT水平的效果更强,具有更好的降低大鼠血清胆固醇的能力。同时,SPMEP降低了粪便SCFA含量、提高了粪便和肠道TBA含量,其机制可能是通过下调肝脏HMG-CoA表达、上调肝脏CYP7A1、LDL-R表达介导。综上,PMEP通过硫酸化修饰可以增强降低大鼠胆固醇含量的活性,这可能为SPMEP作为一种天然化合物应用于预防高脂血症提供思路。

