不同热处理方式对鲈鱼品质的影响
向雅芳,熊光权,乔 宇*,廖 李,汪 兰,吴文锦,丁安子,李 新,石 柳
(湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064)
传统水产品的热加工方式主要有水煮、汽蒸、微波、油炸等,这些方法加热温度高,对鱼肉的品质有一定的影响。真空低温烹调(Sous-vide)是一种新型热加工方式,在法语中意为“真空”,被定义为“原料或含有中间食物的原料,在控制温度和时间的状态下,于热稳定的真空袋内进行烹饪”[1]。真空低温烹调技术是将食品原料装入热稳定性好的真空袋内,抽真空、密封后,在设定温度下(低于100 ℃)处理一定时间,快速冷却后进行低温贮藏的一种技术[2]。自20世纪70年代以来,餐馆和家庭越来越多地采用真空低温烹调技术对原料进行加工[3]。真空低温与传统烹饪方法的不同之处在于:原料在热稳定的食品级塑料袋中真空密封,并通过精确控温进行加热烹饪。真空低温烹调有以下优点:抑制氧化的异味产生;防止烹饪过程中风味物质和水分的损失[4];抑制好氧细菌的生长,最大程度保证食物的美味和营养不被破坏[5];确保食品的安全性,延长货架期。同时,其还能减少蛋白质和脂质的热损伤,减少水分、芳香化合物和热敏感营养素的损失。
目前,有部分研究者将此技术应用到牛排、猪肉、羊肉、鱼类等产品的加工中[6-7]。真空低温烹调处理可以有效控制肉制品中肉毒杆菌、沙门氏菌、大肠杆菌等微生物生长[8]。Espinosa等[9]探讨了真空低温烹调处理对鲷鱼微生物含量的影响,研究结果表明在整个贮藏期,鱼体保持着稳定的微生物数量,且未检出沙门氏菌和单增李斯特菌。牛排经过高压加工(high pressure processing,HPP)和真空低温烹调处理后微生物数量减少,安全性更具保障,且对牛排的品质影响较小[10]。一些研究者发现,将真空低温烹调处理的参数经响应面优化后可以延长鱼排保质期[11]。Nieva-Echevarría等[12]对水煮、汽蒸、真空低温烹调处理过程中海鲈鱼脂质的变化进行研究,发现这3 种处理方式都没有引起鲈鱼脂质含量的显著变化,仅产生了轻微的脂质氧化。唐彬等[13]研究发现真空低温烹调处理中心温度70 ℃保持5 min的加工工艺,可有效控制冷藏条件下鲶鱼菌落总数,同时最大程度地保持鱼肉品质。
随着消费者对预制调理食品、即食加热食品的需求增加,真空低温烹调加工技术将大规模应用于工业化生产[14]。因此,真空低温烹饪法既能保证食品的质量,又能延长货架期[3],经过此加工方式的产品在加热后可直接食用,为消费者提供了一个方便快捷的选择[15]。本研究以低盐腌制鲈鱼为原料,对比水煮、汽蒸、真空低温烹调 3 种加热方式对鱼肉品质的影响,探讨真空低温烹调在调理水产品加工上的应用前景。
1 材料与方法
1.1 材料与试剂
新鲜鲈鱼采购于湖北省武汉市武商量贩农科院店。选择标准为:大小一致,体质量0.4~0.6 kg,鱼体鱼鳍无破损,鱼鳃鲜红,鱼眼饱满且黑白分明无浑浊,肉质弹性较好,冰藏条件下30 min以内运输至实验室进行处理。
真空高温蒸煮袋(聚乙烯材质,8 cm×8 cm) 雄县旭日真空包装有限公司。
硫酸、盐酸、氯化钠、乙醇、冰乙酸、2-硫代巴比妥酸、无水碳酸钠、硼酸、三氯乙酸、高氯酸、氢氧化钠 国药集团化学试剂有限公司;营养琼脂 青岛高科园博生物技术有限公司;1,1,3,3-四乙氧基丙烷上海士锋生物科技有限公司;溴甲酚绿、甲基红、次甲基蓝 连云港市鑫源化工股份有限公司。
1.2 仪器与设备
TA.XT Plus质构仪 英国Stable Micro Systems公司;CR-400色差计 日本柯尼卡美能达株式会社;JHK-A洁净工作台 天津市中环实验电炉有限公司;SPX-250B-Z生化培养箱 上海博迅实业有限公司医疗设备厂;GQ-160气调保鲜箱 广州标际包装设备有限公司;FSH-2A可调高速均质机 常州越新仪器制造有限公司;NMI20-025V-I核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;DZD-400/S真空包装机 江苏腾通包装机械有限公司;FG2 pH计 梅特勒-托利多仪器(上海)有限公司;3K15高速冷冻离心机 北京博劢行仪器有限公司;D2D-500-ZZSC电子鼻 北京盈盛恒泰科技有限责任公司。
1.3 方法
1.3.1 鲈鱼的前处理与分组

表 1 鲈鱼的不同处理方式Table 1 Different processing methods for largemouth bass
将新鲜宰杀的鲈鱼置于冰盒中暂时贮存,迅速用灭菌后的超纯水对鲈鱼进行冲洗,洗干净后,沥干。然后将鱼进行去皮、取背肉,切成相同尺寸鱼肉块(2 cm×3 cm×1 cm),随机分成4 份,经3 g/100 mL的盐水腌制10 min后,按照表1的方式进行处理,然后均置于12 ℃下贮藏5 d(经过课题前期大量数据监测,湖北省30%淡水产品在无严格冷链情况下的贮藏温度为10~12 ℃。因此,本实验贮藏温度选择为12 ℃),每天测定一次指标,每组3 个平行。
1.3.2 品质指标测定
1.3.2.1 汁液流失率
汁液流失率的测定参考文献[9]。分别称取处理前后鱼肉的质量,按照公式(1)进行计算。

式中:m1表示新鲜鲈鱼沥干水后的质量/g;m2表示经过处理贮藏后的质量/g。
1.3.2.2 水分分布的测定
使用核磁共振分析及成像系统测定样品的水分分布。核磁共振分析参数为:共振频率21.3 MHz,磁体强度0.55 T,线圈直径60 mm,磁体温度32 ℃;将不同处理的样品切成3.0 cm×1.5 cm×1.5 cm鱼肉块,称质量,放置于室温下使样品的温度与环境的温度达到平衡,然后放入核磁共振成像分析仪中进行测定;使用Q-FID及标准品对机器进行校正,然后使用CPMG(Carr-Purcell-Meibom-Gill)脉冲序列采集样品T2信号,CPMG脉冲序列的参数:回波时间TE=0.4 ms,重复采样等待时间TR=3 000 ms,回波个数NECS=5 000,采样点数TD=199 998,累加采集次数NS=4,P2为16.00 μs,回波时间TE=0.400 ms,回波个数NECH=10 000;得到的图为指数衰减图形,然后将衰减曲线代入弛豫模型中进行Bi-指数拟合并反演,对反演结果进行归一化处理。每组样品3 个平行,每个平行样测3 次。然后用Origin Pro 8.5软件处理数据并作图。
1.3.2.3 挥发性盐基氮含量的测定
挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定参考GB 5009.228—2016《食品安全国家标准 食品挥发性盐基氮的测定》[16]。取鱼肉10 g于均质杯中,加入50 mL 20 g/L三氯乙酸溶液,均质2 min,过滤。将盛有10 mL硼酸吸收液及5~6 滴甲基红-次甲基蓝指示剂的锥形瓶置于半微量定氮器蒸馏冷凝管下端,并使其下端插入吸收液的液面下。准确吸取5.0 mL上述试样滤液于蒸馏器反应室内,加5 mL 10 g/L氧化镁溶液,迅速盖塞,并加水以防漏气,进行蒸馏,蒸馏5 min后将冷凝管末端移离锥形瓶中吸收液的液面,再蒸馏1 min,用少量水冲洗冷凝管末端,洗入锥形瓶。吸收液用盐酸标准溶液(0.01 mol/L)滴定至溶液显蓝紫色为终点,同时进行空白实验。根据式(2)计算TVB-N含量。
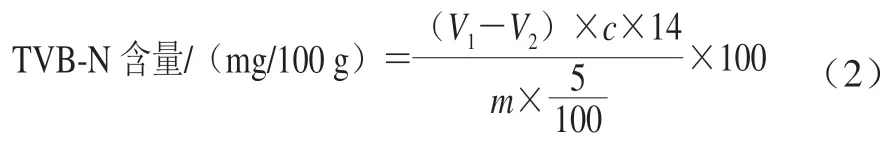
式中:V1、V2分别表示实验组和空白组消耗的盐酸标准溶液体积/mL;c表示盐酸实际浓度/(mol/L);m表示样品的质量/g。
1.3.2.4 菌落总数的测定
菌落总数的测定参考GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[17]。取10 g鱼肉剪碎并加入90 mL灭菌处理的生理盐水,充分振荡,根据样品贮藏时间及样品新鲜度制备稀释样品悬浊液。采用稀释平板计数法,取1 mL样品悬浊液接种于营养琼脂培养基中,适当摇匀,冷却凝固后,翻转平板,放置在30 ℃恒温箱内培养72 h,进行菌落计数。
1.3.2.5 TBARS值的测定
硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值的测定参照Salih等[18]的方法并有所修改。准确称取鱼肉样品5.00 g,加入25 mL 20 g/100 mL三氯乙酸和20 mL蒸馏水,匀浆60 s,静置1 h。8 000 r/min离心10 min,取上清滤液过滤后,定容至50 mL,取5 mL滤液加入5mL 0.02 mol/L 硫代巴比妥酸溶液,沸水浴反应20 min,取出,流动水冷却5 min后,以蒸馏水替代滤液为空白样,在532 nm波长处下测定吸光度。TBARS值用丙二醛(malondialdehyde,MDA)含量表示,单位为mg/kg。
1.3.2.6 色度的测定
白度参考范凯等[19]的方法测定。采用便携式色差仪测定L*、a*、b*值,通过不同处理的鱼肉在贮藏期间白度的变化,反映鱼肉经过不同处理在贮藏期间颜色的变化。根据式(3)计算白度。
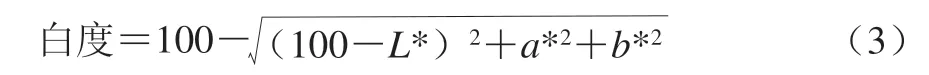
1.3.2.7 感官评定
评定人员由6 名经过培训的评价员组成,以鲈鱼的色泽、气味、质地作为评价标准进行感官评定,标准如表2所示。感官评价总分通过加权统计计算,色泽、气味、质地指标分别设置权重为0.3、0.4、0.3,所得评分结果取平均值。

表 2 鲈鱼感官评定标准Table 2 Criteria for sensory evaluation of largemouth bass
1.3.2.8 质构的测定
鲈鱼质构采用质构仪测定,采用质地剖面分析法。将鱼样切成20 mm×20 mm×10 mm块状,每个待测样品取6 块。测定其硬度和咀嚼性。测定参数设置:测试前速率5 mm/s、测试速率5 mm/s、测试后速率5 mm/s、压缩程度50%、停留间隔时间5 s、测试探头为平底柱形P/36R。
1.3.2.9 鲈鱼气味的测定
取2.0 g样品置于20 mL进样瓶中,加盖密封,35 ℃顶空30 min,利用电子鼻依次进行检测。电子鼻分析参数:气体流速1 L/min,数据采集时间80 s,间隔清洗时间240 s。取各传感器的最大值作为特征值进行分析。
1.4 数据处理与分析
各组实验做3 个平行,数据间差异通过统计软件SPSS 22.0中的Duncan新复极差法进行方差分析和多重比较,P<0.05表示差异显著,采用Origin 8.0软件绘图。
2 结果与分析
2.1 不同热处理方式对鲈鱼贮藏过程中汁液流失率的影响

表 3 不同热处理方式对鲈鱼贮藏过程中汁液流失率的影响Table 3 Effects of different heat treatments on juice loss rate in largemouth bass during storage
鱼肉的保水性可通过肌肉的系水能力进行衡量[20]。如表3所示,在冷藏期间,随着贮藏时间的延长,不同热处理鲈鱼肉的汁液流失率整体均呈逐渐上升趋势。2 d以后,未加热组鱼肉的汁液流失率增长较为迅速,汁液流失率增加的主要原因是腐败菌使得鱼肉蛋白质降解,导致肌原纤维蛋白的持水能力降低,进而降低了肌肉持水能力[21-22]。而水煮、汽蒸、真空低温烹调处理组汁液流失率上升较为缓慢,这3 个热处理组汁液流失率增加主要是由于热加工使得蛋白质变性,促进了肌球蛋白与肌动蛋白的结合,使肌原纤维收缩,引起可存储水分的网格空间结构变小,导致鱼肉的持水性能降低[23]。与贮藏初期(0 d)相比,贮藏结束时水煮、汽蒸、真空低温烹调处理组汁液流失率分别增长了0.78%、0.46%、0.41%,真空低温烹调处理组的增长最缓慢,且在贮藏期间汁液流失率均在2%以下,同时真空低温烹调处理的鲈鱼鱼片在贮藏第5天汁液流失率显著低于水煮、汽蒸处理组(P<0.05),说明真空低温烹调处理能够有效地抑制鱼肉汁液的流失,使鲈鱼肉保持良好的品质。
2.2 不同热处理方式对鲈鱼贮藏过程中水分变化的影响
横向弛豫时间T2可反映样品内部氢质子所处的化学环境,其大小与氢质子所受到的束缚力和自由度有关。束缚氢质子的力越大或自由度越小,T2则越小,在图谱上峰位置相对靠左;反之,T2越大,在图谱上峰位置则较靠右。其中,T21(0.01~10 ms)为结合水,T22(10~300 ms)为不易流动水,T23(>300 ms)为自由水[24]。

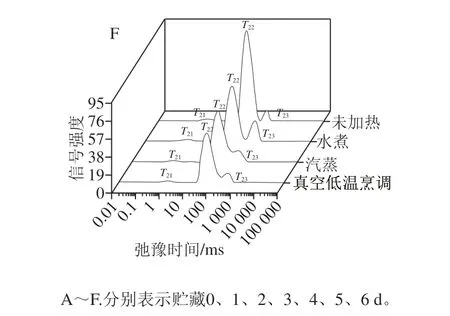
图 1 不同热处理组鲈鱼肉贮藏过程中的水分分布Fig. 1 Water distribution of largemouth bass meat with different heat treatments during storage
由图1可知,鲈鱼贮藏过程中,与未加热组对比,经过水煮、汽蒸、真空低温烹调处理后的鲈鱼鱼肉T2都发生向左偏移的现象,说明3 种处理方式使鲈鱼鱼肉中的水分受到的束缚力增加,自由度减小,水的移动性下降,可能是肌原纤维蛋白空间结构发生了变化,粗丝和细丝之间的网格结构变的更加紧密[25]。贮藏5 d时,水煮、汽蒸、真空低温烹调处理组不易流动水峰面积占总峰面积比例(S22)分别为76.993%、86.593%、89.403%,真空低温烹调处理组的S22较大,对不易流动水的束缚能力更强,可以抑制水分流失,这与汁液流失率的测定结果一致,说明真空低温烹调处理组的保水性较好。肌肉的组织结构对其持水性和水分子状态都有一定的影响[26],肌肉的持水性主要依靠肌浆蛋白分子、水分子极化基团间引力作用截留水分,其中,大部分水分被吸附在细胞膜内的肌浆中,少部分通过毛细管力被滞留在肌纤维细胞膜外,又被肌束膜紧紧包围,流动性降低;也有研究认为,由肌原纤维膨胀引起的肌丝空间扩大,同样可以提高持水力[27]。
2.3 不同热处理方式对鲈鱼贮藏过程中TVB-N含量的影响

图 2 不同热处理方式对鲈鱼贮藏过程中TVB-N含量的影响Fig. 2 Effects of different heat treatments on TVB-N content in largemouth bass during storage
有研究显示,TVB-N含量与细菌数目有着一定的联系,因此生鲜水产品初期的TVB-N含量可以反映其腐败程度[28]。由图2可知,贮藏期间各实验组TVB-N含量均呈现不同程度的上升趋势,真空低温烹调处理组相较于其他实验组的TVB-N含量增长缓慢,这与唐彬等[13]研究真空低温烹调处理对鲶鱼TVB-N含量的影响结果一致。贮藏4 d时,未加热组、汽蒸处理组、真空低温烹调处理组TVB-N含量分别达到25.216、24.974、20.570 mg/100 g,此时鲈鱼均已散发出腐臭味。在第5天时,未加热组TVB-N含量最高,其次是汽蒸和水煮处理组,真空低温烹调处理组最小,说明真空低温烹调处理组的鱼肉在贮藏末期腐败程度较低。这与Singh等[11]所发现经响应面优化的真空低温烹调加工即食鱼排TVB-N含量较小的结果相近。综上所述,在12 ℃贮藏过程中,真空低温烹调处理在一定程度上能抑制TVB-N含量的上升,可以有效地抑制细菌生长和酶的活性,延缓鱼肉的腐败变质。
2.4 不同热处理方式对鲈鱼贮藏过程中菌落总数的影响
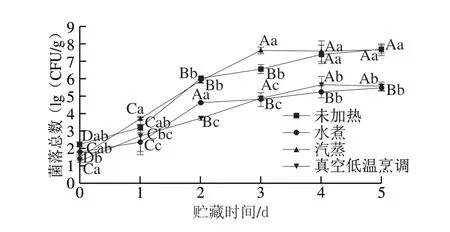
图 3 不同热处理方式对鲈鱼贮藏过程中菌落总数的影响Fig. 3 Effects of different heat treatments on total colony count of largemouth bass during storage
菌落总数可反映氨基酸和蛋白质分解代谢情况,因此常用于衡量鱼肉腐败程度[29]。由图3可知,在贮藏期间,各实验组菌落总数均随着贮藏时间的延长而增加。0 d时,水煮、汽蒸、真空低温烹调处理组比未加热组菌落总数分别低0.45、0.70、0.95(lg(CFU/g)),真空低温烹调处理的减菌效果较好。在贮藏期间,未加热处理鲈鱼的菌落总数增长迅速,而真空低温烹调处理组和水煮处理组增长较缓慢,腐败程度较低。贮藏第5天时,未加热、水煮、汽蒸、真空低温烹调处理组的菌落总数分别为7.67、5.50、7.69、5.58(lg(CFU/g)),其中水煮、真空低温烹调处理组显著低于未加热组,说明真空低温烹调处理和水煮可以有效抑制微生物的生长,这与González-Fandos等[30]在90 ℃下真空低温烹调处理3.3 min并于2 ℃贮存的鲑鱼菌落总数较小的结论一致。一些学者也发现真空低温烹调处理能有效地控制肉制品肉毒杆菌、单核细胞增生李斯特菌、沙门氏菌、大肠杆菌等微生物生长[9]。本研究未对腐败类特定微生物进行研究,今后将继续深入探讨。综上所述,在贮藏期间,真空低温烹调处理的鱼肉菌落总数增长缓慢,此加工方法具有减菌效果,可以有效地延缓微生物的生长速率,从而延长鲈鱼的货架期。
2.5 不同热处理方式对鲈鱼贮藏过程中TBARS值的影响
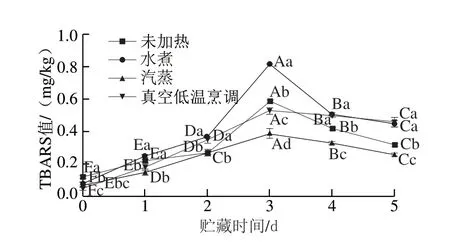
图 4 不同热处理方式对鲈鱼贮藏过程中TBARS值的影响Fig. 4 Effects of different heat treatments on TBARS value in largemouth bass during storage
脂质氧化是加工肉制品的一个重要问题,其可导致产品品质的劣化并产生腐臭味。有学者发现加热会促进肉类脂质氧化[31-32],烹饪方法、烹饪温度和烹饪时间不同也会导致肉类产品中TBARS值的差异[32-33]。由图4可以看出,贮藏过程中,各处理组TBARS值均呈现先上升后下降的变化。0 d时,未加热组、水煮组、汽蒸组、真空低温烹调组的TBARS值分别为0.12、0.08、0.07、0.05 mg/kg,水煮、汽蒸、真空低温烹调处理组显著低于未加热组。贮藏第3天,相比于未加热处理组、水煮处理组,真空低温烹调处理组的TBARS值显著较低(P<0.05),这与del Pulgar等[33]研究真空煮熟的猪肉在80 ℃下贮藏5 h和12 h的TBARS值较小的结果一致。真空低温烹调处理组有较低的TBARS值可能是由于真空包装后烹调时的真空作用[34]。贮藏3~5 d,各组TBARS值呈现下降趋势,可能是由于二级脂质氧化化合物MDA很容易与肉类中存在的其他化合物反应,如蛋白质、磷脂、DNA或氨基酸。同时MDA与其他反应性脂质羰基化合物之间的反应也可能导致MDA含量降低,从而降低TBARS值[35]。贮藏5 d时未加热组、水煮组、汽蒸组、真空低温烹调组较贮藏3 d时TBARS值分别下降了0.27、0.37、0.13、0.07 mg/kg,其中真空低温烹调处理组TBARS值下降速率明显低于其他处理组,说明贮藏后期,真空低温烹调处理的鱼肉脂肪氧化速度变慢。
2.6 不同热处理方式对鲈鱼贮藏过程中白度的影响

表 4 不同热处理方式对鲈鱼贮藏过程中白度的影响Table 4 Effects of different heat treatments on whiteness of largemouth bass during storage
颜色是消费者评价鱼肉类产品新鲜程度的一个重要指标,可为消费者提供有关肉类产品采购质量属性的可靠信息[36]。在贮藏过程中,由于机体发生脂肪氧化、色素降解等一系列的反应,鱼肉的颜色会出现一定的变化[37]。由表4看出,随着贮藏时间延长,未加热组的鱼肉白度呈现上升趋势,水煮处理组白度呈先下降后上升趋势,真空低温烹调处理组的白度呈现下降趋势。0 d时,真空低温烹调处理组白度大于水煮、汽蒸处理组,且各处理组之间的白度存在显著差异性,说明加热温度、加工方式使得蛋白变性程度不同,导致鱼肉色泽产生差异。贮藏3 d后,真空低温烹调组白度下降速度加快,说明真空低温烹调处理方式在贮藏期间对鱼肉色泽有一定的影响。贮藏第5天,水煮处理组白度显著高于其他处理组,且与第0天无显著性差异。
2.7 不同热处理方式对鲈鱼贮藏过程中感官评分的影响
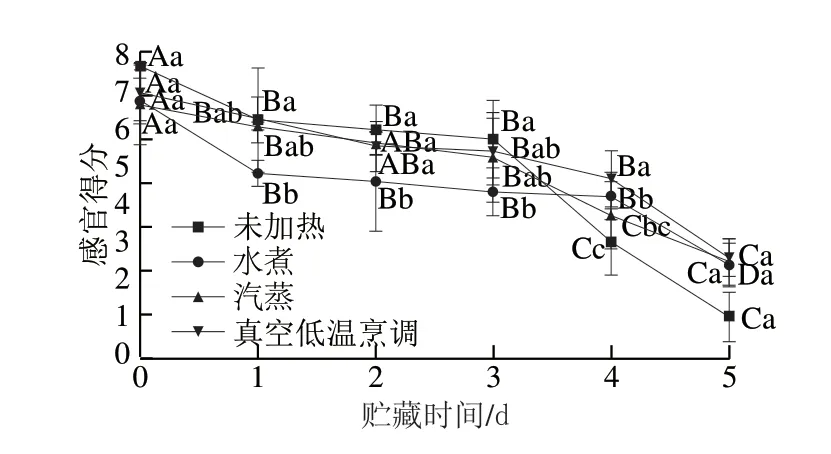
图 5 不同热处理方式对鲈鱼贮藏过程中感官得分的影响Fig. 5 Effects of different heat treatments on sensory evaluation of largemouth bass during storage
感官评定能最直观地评价鱼肉品质变化[38]。由图5可知,在贮藏过程中,各组鲈鱼的感官得分均呈下降趋势。3 d以后,未加热组在12 ℃贮藏期间感官得分大幅下降。真空低温烹调处理组在贮藏第4天感官得分显著高于水煮、汽蒸组,且其在贮藏过程中下降趋势较为平缓,说明真空低温烹调处理具有一定的保鲜效果,使鱼肉可以维持较好的贮藏品质,这与González-Fandos等[39]对真空低温烹调处理组鲑鱼片的感官评价结果相近。在贮藏终点时,各个处理组鱼肉均出现不同程度的腐烂变质,未加热组最为明显,其感官得分为1.94,鱼肉色泽变暗,肌肉切面无光泽,且有腥味、胺味。
2.8 不同热处理方式对鲈鱼贮藏过程中质构特性的影响

表 5 不同热处理方式对鲈鱼贮藏过程中硬度的影响Table 5 Effects of different heat treatments on hardness of largemouth bass during storage

表 6 不同热处理方式对鲈鱼贮藏过程中弹性的影响Table 6 Effects of different heat treatments on elasticity of largemouth bass during storage
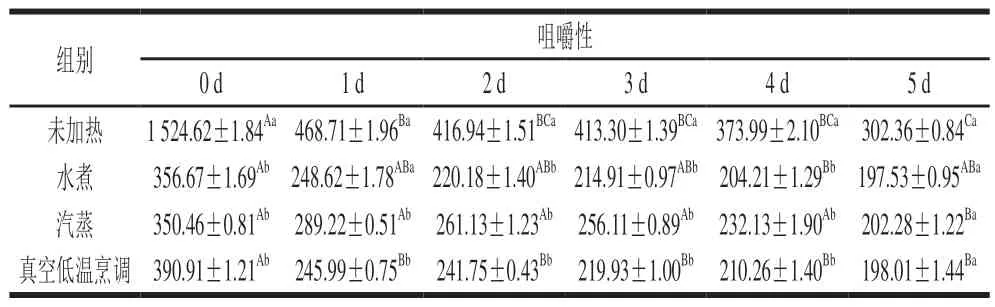
表 7 不同热处理方式对鲈鱼贮藏过程中咀嚼性的影响Table 7 Effects of different heat treatments on chewiness of largemouth bass during storage
加热处理后的鱼肉质构特性会发生变化,质构特性可反映鱼肉在贮藏期间肉质的变化情况[40]。由表5~7可知,随着贮藏时间的延长,不同处理的鱼肉硬度、弹性、咀嚼性均呈现下降趋势,可能是由于肉质中的蛋白质被降解,发生组织结构的变化,汁液流失率不断增长,微生物不断生长繁殖[41]。贮藏过程中,水煮、汽蒸、真空低温烹调处理组的硬度和咀嚼性无显著性差异(P>0.05)。贮藏1~3 d,水煮、汽蒸、真空低温烹调处理组的硬度分别下降15.15%、33.69%、5.31%,真空低温烹调处理组硬度下降速度明显小于其他处理组。各组硬度下降可能是由于在水解酶与微生物双重作用下,鱼肉蛋白质发生水解,致使鱼肉组织结构破坏[13]。贮藏0~4 d,真空低温烹调处理组的弹性均大于水煮处理组;贮藏5 d时,水煮、汽蒸、真空低温烹调处理组之间弹性差异显著(P<0.05)。
2.9 不同热处理方式对鲈鱼贮藏过程中气味的影响
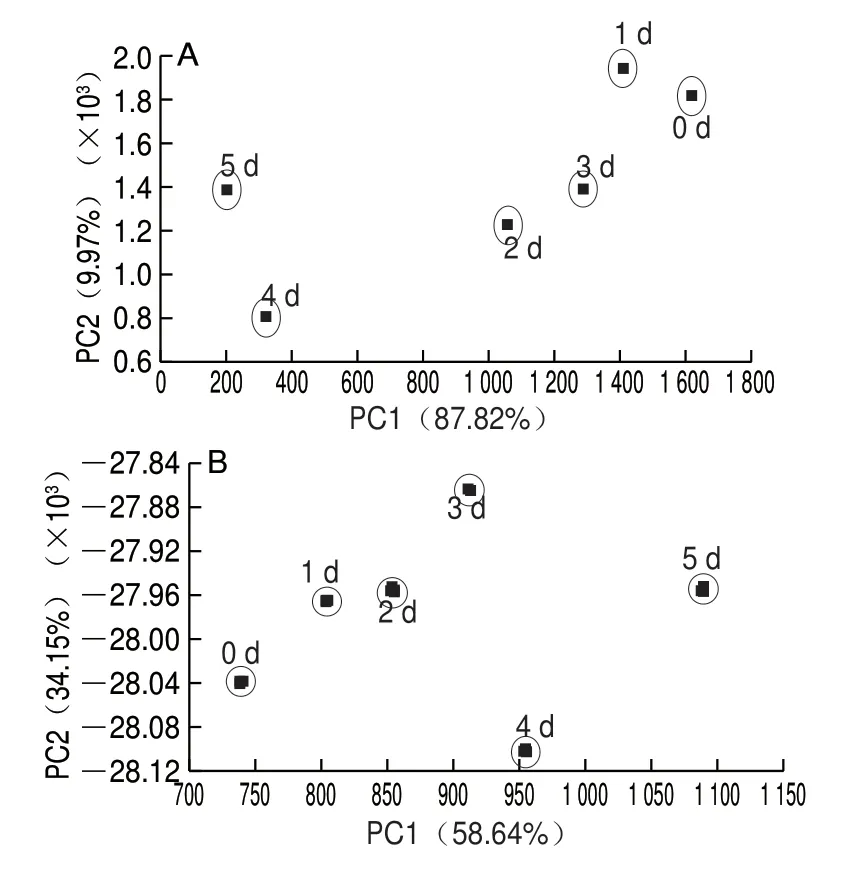

图 6 不同热处理方式对鲈鱼贮藏过程中气味的影响Fig. 6 Effects of different heat treatments on odor profile of largemouth bass during storage
不同热处理方式对鱼香气有重要影响,香气对于消费者偏好和接受度的影响至关重要[42]。由图6可知,在PCA图中,未加热组、水煮组、汽蒸组、真空低温烹调组第1主成分(PC1)的贡献率分别达到87.82%、58.64%、84.58%、64.97%,同时第2主成分(PC2)的贡献率分别达到9.97%、34.15%、9.12%、20.82%,两种主成分累计贡献率均超过80%,说明这2 个主成分可代表样品的所有信息特征[43]。由图6A可知,未加热鲈鱼片在不同贮藏时间的风味物质响应值对应的区域没有重叠,区分情况良好。从图6B可以看出,随着贮藏时间的延长,水煮处理鲈鱼的挥发性风味物质发生变化,且不同贮藏时间的鲈鱼风味物质响应值对应的区域没有重叠部分,区分情况很好,气味分布0~3 d距离较近,贮藏5 d与其他时间距离较远。如图6C所示,汽蒸处理组0~2 d响应值区域有相互重叠部分,说明在此贮藏期间鲈鱼片新鲜度区分情况较差,贮藏3~5 d鱼片挥发性物质响应值区域与初期区域距离明显增大,说明贮藏2 d后鲈鱼片开始出现明显的腐败变质。如图6D所示,真空低温烹调组0~5 d气味相应值明显分为两部分,第一部分为0~3 d,第二部分为4~5 d,表明0~3 d与4~5 d挥发性气味差异较大,3 d可用于表示鱼肉新鲜度的跃变时间,其中真空低温烹调处理组鱼片0~3 d有明显重叠,可知0~3 d鲈鱼鱼片新鲜度变化缓慢。鲈鱼挥发性物质PCA分析检测结果与鲈鱼的TVB-N含量的变化趋势大致相同。
3 结 论
真空低温烹调处理的鲈鱼在贮藏过程中的菌落总数、TVB-N含量增长缓慢,且电子鼻检测结果与TVB-N含量结果相近,说明真空低温烹调处理能有效抑制微生物的生长繁殖,延长货架期。同时,真空低温烹调处理可控制鲈鱼肉的汁液流失在2%以下,且在贮藏末期能束缚不易流动水,抑制其流失;对鲈鱼片的色泽有一定影响,但对鱼片的硬度、咀嚼性的影响与水煮、汽蒸的影响无显著差异。因此,真空低温烹调加工技术可以应用于水产品、熟肉制品加工中,延长产品的货架期,但还应深入研究其对肉制品感官的改善作用,让消费者能够享受到高品质的、精确烹制的肉类,逐步将其推广到休闲和快餐食品领域。

