赋型剂乳液粒径和菠菜加工方式对菠菜中β-胡萝卜素生物可给性的影响
袁 曦,刘晓娟*,曹 庸
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东 广州 510642)
蔬菜和水果是人们摄取β-胡萝卜素的重要膳食来源[1],但由于果蔬中的β-胡萝卜素难以从食物组织中释放、在胃肠道消化液中的溶解度较低、易发生转化等原因,其具有较低的生物利用率[2]。如何提高果蔬中类胡萝卜素的生物利用率一直是人们关注和研究的热点。McClements等[3]于2014年首次提出设计excipient food(由成策等[4]翻译为赋型剂食品)与食物或活性成分共同摄入,来增加活性成分的生物利用率。研究发现,将酸奶与姜黄素共同摄入可显著提高姜黄素的生物可给性[5];将水苏糖溶液和茶多酚共同摄入可以改善茶多酚在小鼠体内的吸收情况[6]。赋型剂乳液是一类针对性设计用于与食物或活性成分共同摄入的水包油型乳液,是目前研究较多的一类赋型剂食品[3]。Liu Xuan等以玉米油为油相,以吐温20为乳化剂,制备赋型剂纳米乳液与黄椒[7]和芒果[8]共同体外模拟消化,显著提高了黄椒和芒果中类胡萝卜素的生物可给性。
在大部分类胡萝卜素的体外消化研究中,都采用生物可给性作为评价其生物利用率的重要指标。在乳液体系中,乳液的粒径影响着其在胃肠道中的消化速率、吸收和代谢途径、活性成分的释放以及向混合胶束的转移,与活性成分的生物可给性有着密切联系[9-13]。Salvia-Trujillo等[9]的研究结果表明,与大粒径(表面积平均粒径(d3,2)为19 μm)乳液相比,较小粒径(d3,2=170 nm)乳液与番茄汁混合体系中油脂消化速率更快,番茄红素的生物可给性更高。Zou Liqiang等[10]的研究结果表明,较小粒径乳液会加快其消化速率,可能导致活性物质在未到达吸收部位之前就已发生转化、降解。调控乳液粒径、减少活性物质在胃肠道消化过程中的降解、改善活性物质的释放和溶解对于提高果蔬中活性物质的生物可给性具有重要作用。
食物组织的状态是影响类胡萝卜素生物可给性的另一重要因素[14]。一般认为,致密的食物组织结构会在一定程度上抑制活性成分的释放,因此,常通过破碎、均质、热烫等机械处理及热处理方式来破坏其组织结构[15-16]。然而,目前热加工对类胡萝卜素生物可给性的影响仍无统一定论。Ryan等[17]的研究表明,蒸煮、烧烤和微波等热处理方式均提高了红辣椒和番茄中β-胡萝卜素的生物可给性;Tydeman等[18]的研究结果表明,热处理降低了胡萝卜中类胡萝卜素的生物可给性。这些研究结果表明加工方式对活性成分生物可给性的影响可能与食物和活性成分本身的性质密切相关。针对特定的食物和活性成分,探讨合适的加工方式,对于促进活性成分的释放、提高生物可给性具有重要意义。
因此,本实验以β-胡萝卜素含量丰富的菠菜为原料,利用体外模拟消化模型,研究了赋型剂乳液粒径和加工方式对菠菜中β-胡萝卜素生物可给性的影响。本研究中赋型剂乳液完全由食品级成分(水、玉米油和酪蛋白酸钠)组成,安全性高、无特殊风味,可制成沙拉或以酱汁等形式添加到日常膳食中。本研究旨在为科学合理地设计赋型剂乳液,提高菠菜中类胡萝卜素的生物利用率,充分发挥果蔬中类胡萝卜素的潜在功效,从而改善人体健康状况提供参考。
1 材料与方法
1.1 材料与试剂
菠菜、玉米油购于广州当地超市,其中菠菜于4 ℃冰箱冷藏,玉米油于室温下避光贮藏。
胃蛋白酶(250 U/mg)、脂肪酶(100~500 U/mg)、Mucin(猪胃黏液素II型) 美国Sigma-Aldrich公司;酪蛋白酸钠 上海阿达玛斯试剂有限公司;猪胆盐 上海源叶生物科技有限公司;氢氧化钠、盐酸、丙酮、正己烷(均为分析纯) 天津市富宇精细化工厂;四氢呋喃、二氯甲烷、三乙胺(色谱纯) 天津市科密欧化学试剂有限公司;乙腈、甲醇(色谱纯) 美国J.T.Baker公司。
1.2 仪器与设备
FJ200-S型高速分散均质机 上海嫩谷机电设备有限公司;AH-BASIC高压均质机 德国ATS工业系统有限公司;D3024R冷冻离心机 美国赛洛捷克公司;LC-15C分析高效液相色谱系统 日本岛津公司;90 Plus动态光散射粒度分析仪 美国布鲁克海文仪器公司;CX41光学显微镜 奥林巴斯(中国)有限公司;DL-55全自动电位滴定仪 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 不同粒径赋型剂乳液的制备
将质量分数1%酪蛋白酸钠溶解于5 mmol/L pH 7.0的磷酸盐缓冲液(phosphate buffered saline,PBS)中,常温下磁力搅拌3~5 h,直至酪蛋白酸钠完全溶解,4 ℃冷藏过夜,得到水相溶液。水相溶液使用前用滤纸过滤,去除未溶解的大颗粒物质。待水相溶液恢复至室温后,将玉米油与水相溶液按照质量比1∶9混合,利用高速分散均质机在10 000 r/min下分散2 min(制备10 μm乳液),然后分别利用高压均质机在20 MPa下均质1 次(制备500 nm乳液)、在120 MPa下均质5 次(制备200 nm乳液)。均质过程中,外部加冰对乳液进行冷却,防止不饱和脂肪酸受热分解。
1.3.2 不同混合体系样品制备
不同粒径赋型剂乳液/菠菜混合体系的制备:将菠菜去根、茎,洗净,沥干多余水分,叶片切成长约为15 mm的正方形。将菠菜与PBS(5 mmol/L、pH 7.0)等质量混合,用料理机高速搅拌1 min得到菠菜泥。用PBS(5 mmol/L、pH 7.0)将不同粒径赋型剂乳液稀释至含油质量分数4%,再分别与菠菜泥以质量比1∶1混合。100 r/min磁力搅拌2 min(避光)以保证体系混合均匀,制备得到初始阶段样品。以玉米油(非乳液状态)为对照,进行相同操作。
不同加工方式菠菜/赋型剂乳液混合体系的制备:生菠菜/赋型剂乳液混合样品的制备流程同上;将去根茎的菠菜叶于沸水浴中热烫1 min,其余操作同上,制备热烫菠菜/赋型剂乳液混合样品;使用小粒径(d3,2≈200 nm)赋型剂乳液。
1.3.3 菠菜与赋型剂乳液共同体外模拟消化
结合蛋白质、油脂的消化特点,参考文献[19-20]的标准静态体外模拟消化程序并稍作修改,构建模拟消化道,包括模拟口腔、模拟胃、模拟小肠3 个消化阶段。
模拟口腔消化:模拟唾液由0.03 g/mL Mucin和多种无机盐溶于蒸馏水中配制而成[20]。取20 mL初始阶段样品与20 mL模拟唾液混匀,用盐酸溶液调至pH 6.8,在恒温摇床中(37 ℃、100 r/min)模拟口腔消化10 min,得到口腔消化样品。
模拟胃消化:模拟胃液由3.2 g/mL胃蛋白酶、2 g/L NaCl和体积分数0.7%盐酸溶于蒸馏水中配制而成。取20 mL模拟口腔消化后的样品与20 mL模拟胃液混合,调节至pH 2.5,在恒温摇床中(37 ℃、100 r/min)模拟胃消化2 h,得到胃消化样品。
模拟小肠消化:取30 mL经模拟胃消化的样品,调节至pH 6.8~7.0,加入1.5 mL模拟肠液(36.6 g/L CaCl2·2H2O和219 g/L NaCl溶于蒸馏水中)、3.5 mL胆盐溶液(0.187 5 g胆盐溶液溶于3.5 mL PBS(5 mmol/L、pH 7.0)中)。再次调节至pH 7.0,加入2.5 mL脂肪酶溶液(含脂肪酶24 g/L)。然后采用pH-stat法,利用恒电位滴定仪不断向体系中加入0.25 mol/L NaOH溶液,使体系恒定保持在pH 7.0,并记录2 h内消耗NaOH溶液的体积。在整个消化过程中,体系温度维持在37 ℃,搅拌头以50%最大速率不断均匀搅拌。
1.3.4 粒径和ζ-电位的测定
采用90 Plus动态光散射激光粒度仪测定样品的d3,2、粒径分布、多分散指数(polydispersity index,PDI)及ζ-电位。在测量前,先对赋型剂乳液及各阶段消化液进行逐级稀释和静置沉淀,以消除多重光散射和菠菜组织对测量结果的干扰。在测量粒径时,用PBS(5 mmol/L、pH 7.0)稀释赋型剂乳液、初始阶段及经模拟口腔和小肠消化的样品,用pH 2.5的去离子水稀释经模拟胃消化的样品。由于pH值和盐离子浓度对ζ-电位有较大影响,应尽量使样品处于原始环境中,因此在测定ζ-电位时使用PBS(5 mmol/L、pH 7.0)稀释赋型剂乳液、初始阶段和经模拟小肠消化的样品;用pH 6.8的模拟唾液稀释模拟口腔消化的样品;用pH 2.5的模拟胃液稀释模拟胃消化的样品。测定温度:为25 ℃,检测角度为90°,波长为658 nm。
1.3.5 消化过程混合体系微观结构的观察
用光学显微镜(10 倍目镜和100 倍物镜)对不同消化阶段的样品进行微观结构的观察。为反映样品最真实的状态,在各消化阶段完成时立即取消化液进行观察,不需稀释。
1.3.6 pH-stat测定游离脂肪酸释放量
利用恒电位滴定仪不断向体系自动滴加0.25 mol/L NaOH,使消化体系恒定维持在pH 7.0,记录在120 min消化过程中NaOH的消耗量,通过公式(1)计算游离脂肪酸释放量,从而反映油脂的消化速率和最终消化程度[21]。利用相同质量分数的水相溶液/菠菜混合体系进行消化,测定NaOH消耗量并从赋型剂乳液/菠菜混合体系样品的测量值中扣除,保证NaOH的消耗是由油脂消化引起。
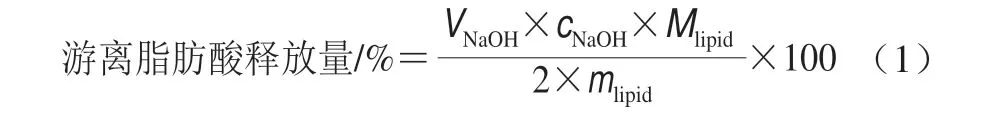
式中:VNaOH是消耗NaOH的体积/L;cNaOH是用于滴定的NaOH浓度/(mol/L);mlipid是小肠消化液中油脂的总质量/g;Mlipid是油脂的摩尔质量/(g/mol)。
1.3.7 生物可给性的测定
β-胡萝卜素的生物可给性是指经体外模拟消化后,消化液中的β-胡萝卜素进入混合胶束中的比例,可反映β-胡萝卜素进入混合胶束的能力[22]。赋型剂乳液/菠菜混合体系经体外模拟消化后,取小肠消化液15 000 r/min、4 ℃离心50 min,离心后的消化液分为3 层,从下到上分别为不溶性沉淀、胶束相和未消化油脂。用注射器小心吸取中间层的胶束相,用0.45 μm微孔滤膜过滤,提取并检测胶束相中的β-胡萝卜素质量浓度。β-胡萝卜素生物可给性的计算如公式(2)所示。

式中:ρ胶束为胶束相中β-胡萝卜素的质量浓度/(μg/mL);ρ小肠消化液为小肠消化液中β-胡萝卜素的质量浓度/(μg/mL)。
1.3.8 类胡萝卜素提取和检测
参考Biehler等[23]的方法并加以改进,分别取5 mL各阶段消化液或10 mL胶束相,加入正己烷-丙酮(体积比1∶1)进行振荡,4 000 r/min离心2 min并收集上层清液,下层溶液重复该步骤,萃取至上层清液无色,将所有的上层清液合并。将收集到的上清液与体积分数10%氯化钠溶液混合、振荡,再次收集上层清液,利用正己烷萃取下层溶液,萃取至正己烷层溶液呈无色状态。所有上层清液于25 ℃下旋转蒸发至体积小于5 mL,转移至10 mL离心管并氮气吹扫至有机溶剂挥发完毕。冷冻干燥后于-20 ℃下贮存备用。进样前用二氯甲烷将冷冻干燥后的提取物重新稀释至合适质量浓度。所有步骤均在低温下进行,并注意避光。
利用高效液相色谱法分析和定量样品中的β-胡萝卜素。具体条件为:色谱柱:Diamonsil C18(2)(250 mm×4.6 mm,5 μm);流动相A:乙腈-甲醇(体积比95∶5);流动相B:乙腈-甲醇-四氢呋喃(体积比60∶20∶20),所有乙腈中均含有体积分数5%三乙胺;梯度洗脱程序为:0~20 min,0~30% B;20~30 min,30%~100% B;30~50 min,100% B。流速:1 mL/min;检测波长:450 nm;进样量:20 μL;柱温:30 ℃。
1.4 数据统计与分析
所有实验至少重复两次,实验数据以平均值±标准差表示。采用Origin 8.5软件作图。用SPSS 17.0软件进行单因素方差分析,并采用Duncan’s检验,P<0.05表明数据间存在显著性差异。
2 结果与分析
2.1 不同粒径大小赋型剂乳液的表征
利用高速分散均质机和高压均质机在不同均质压力下均质不同次数,分别制备了小粒径(d3,2=205 nm)、中等粒径(d3,2=510 nm)和大粒径(d3,2=9.822 μm)乳液。小、中、大粒径乳液的PDI分别为0.099、0.141、0.651。一般认为,PDI<0.3表明乳液具有较好的均一性[24-25],因此,使用本研究方法制备得到的小粒径和中等粒径乳液均一性较好。此外,小、中、大粒径乳液的ζ-电位分别为-29.87、-26.56、-19.62 mV。这表明3 种乳液表面均带有大量的负电荷,且负电荷的量随着粒径的增大而减小。乳液表面带有较多负电荷主要是由于酪蛋白酸钠作为乳化剂包裹在油滴表面,酪蛋白酸钠的等电点为pH 4.5左右,其在中性条件下会带有大量的负电荷。一般认为,ζ-电位的绝对值越大,乳液的稳定性越好[26]。小粒径(d3,2≈200 nm)和中等粒径(d3,2≈500 nm)乳液ζ-电位的绝对值显著高于大粒径乳液(d3,2≈10 μm)(P<0.05),这表明与大粒径乳液相比,小粒径和中等粒径乳液的稳定性更好。
2.2 赋型剂乳液粒径对乳液/菠菜混合体系消化过程中粒径、ζ-电位和微观结构的影响
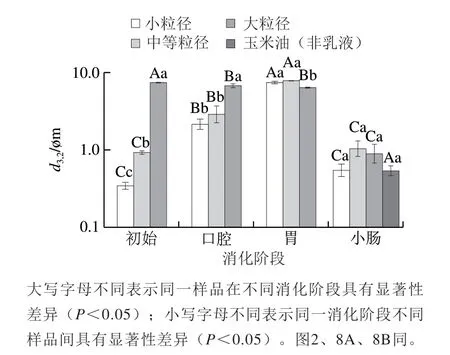
图 1 不同粒径赋型剂乳液/菠菜混合体系各消化阶段的d3,2Fig. 1 Mean particle size (d3,2) of mixed systems of spinach and excipient emulsions with different particle sizes at each stage of simulated GIT digestion
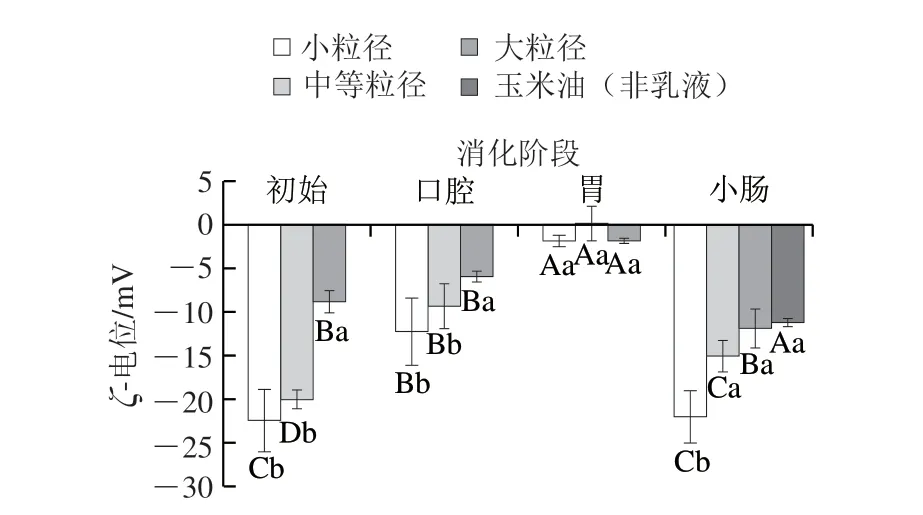
图 2 不同粒径赋型剂乳液/菠菜混合体系各消化阶段的ζ-电位Fig. 2 ζ-Potential of mixed systems of spinach and excipient emulsions with different particle sizes at each stage of simulated GIT digestion
在胃肠道消化过程中,乳液的粒径影响着油脂暴露于消化酶和消化液其他成分的表面积;油脂的聚集状态会影响消化酶接触油脂的能力;混合体系的ζ-电位对于了解消化过程中乳液与胃肠液中其他带电组分的相互作用具有重要意义。这些因素都可能对活性成分的生物可给性造成影响。因此,本研究对样品各消化阶段的粒径、ζ-电位和微观结构进行表征,以了解混合体系在模拟胃肠道消化过程中发生的变化,并为生物可给性的差异提供相关信息。
图 3 不同粒径赋型剂乳液/菠菜混合体系各消化阶段的粒径分布Fig. 3 Particle size distribution of mixed systems of spinach and excipient emulsions with different particle sizes at each stage of simulated GIT digestion
由于未经均质化的油脂粒径过大,无法使用动态光散射粒度仪进行测量,因此未对玉米油/菠菜混合物的初始、口腔、胃3 个阶段的粒径和ζ-电位进行表征。不同粒径赋型剂乳液与菠菜混合后的d3,2(图1)和ζ-电位(图2)变化呈相同趋势,与混合前的赋型剂乳液相比,各样品粒径呈增加趋势,ζ-电位的绝对值呈减小的趋势。这可能是由于菠菜释放出的一些带电成分(如矿物离子)通过静电屏蔽作用降低了乳滴表面的ζ-电位,从而促进了乳滴的絮凝。
经模拟口腔消化后,小粒径、中等粒径和大粒径乳液/菠菜混合体系经模拟口腔消化后的d3,2分别为2.19、2.97、6.73 μm。小粒径、中等粒径乳液/菠菜混合体系的d3,2较初始阶段显著增加,大粒径乳液样品的d3,2较初始阶段显著减小(P<0.05)。从粒径分布图(图3)也可以看出,小粒径和中等粒径乳液/菠菜混合体系经口腔消化后,粒径峰右移,说明体系中小粒径颗粒减少,大粒径颗粒增加,表明在口腔消化过程中油滴可能发生了聚集。显微镜观察结果也证明了这一点,从图4中可以看到,小粒径、中等粒径乳液/菠菜混合体系经口腔消化后,油滴发生了聚集,而初始样品中的大粒径乳液/菠菜混合体系在模拟口腔消化阶段被分解成了较小的油滴。在模拟口腔消化阶段油滴发生聚集可能是由模拟唾液中的Mucin对油滴的桥接或消耗絮凝作用引起[27]。桥接是由于Mucin与两个或更多油滴的表面结合引起,而未被吸附的Mucin会增加油滴之间的渗透吸引力,使得消耗絮凝发生,最终促使油滴发生聚集[28-29]。相反,大粒径乳液/菠菜混合体系和玉米油/菠菜混合体系样品的粒径变化呈现不同趋势,可能是由于大油滴(d3,2≥10 μm)能够抵抗Mucin对其的絮凝作用,且在消化过程中这些大油滴易在外力的作用下发生破裂。经模拟口腔消化后,与初始阶段(ζ-电位为-8.78~-22.43 mV)相比,所有样品带有的负电荷均显著减少(ζ-电位为-5.88~-12.34 mV)(P<0.05)。这种现象可能归因于模拟唾液溶液的静电屏蔽效应以及Mucin与油滴表面的相互作用[30]。
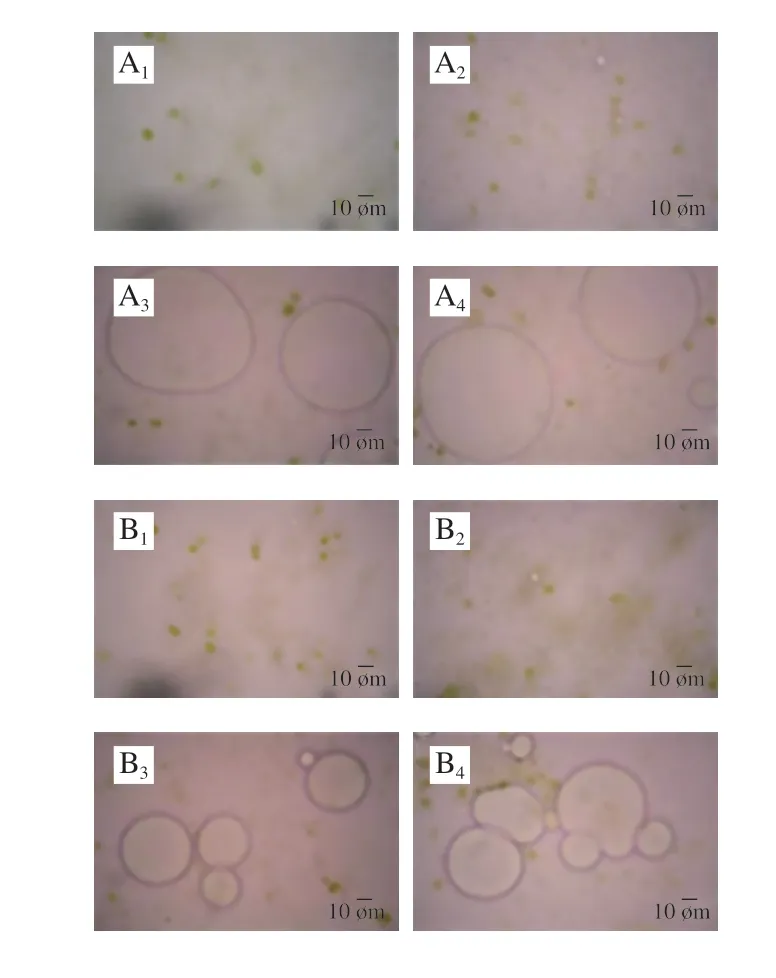
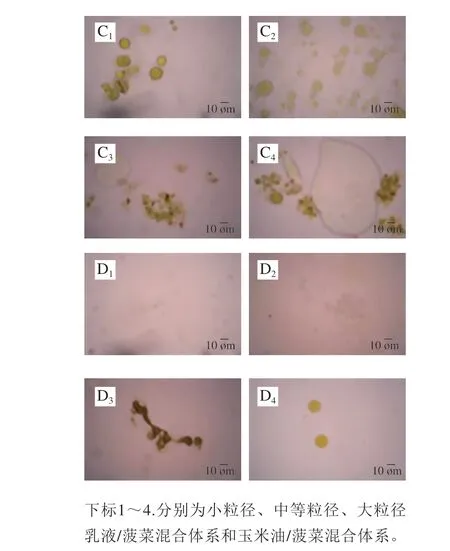
图 4 不同粒径赋型剂乳液/菠菜混合体系各消化阶段的显微镜观察结果Fig. 4 Microscopic images of mixed systems of spinach and excipient emulsions with different particle sizes after exposure to each stage of simulated GIT
经模拟胃消化后,小粒径和中等粒径乳液/菠菜混合体系的d3,2(约7 μm)显著增加(P<0.05),大粒径乳液/菠菜混合体系的d3,2(6.40 μm)无显著变化。粒径分布图(图3)同样显示经模拟胃消化后,小粒径、中等粒径乳液/菠菜混合体系中出现了大量大粒径(d3,2≈10 μm)颗粒。显微镜观察结果(图4)也表明经模拟胃消化后,小粒径和中等粒径乳液/菠菜混合体系中的油滴发生了明显的聚结,形状变得不规则;大粒径乳液/菠菜混合体系和玉米油/菠菜混合体系经模拟胃消化后仍呈较大油滴,无明显变化。小粒径和中等粒径乳液/菠菜混合体系的样品经模拟胃消化后粒径增加可归因于以下因素:1)在模拟胃液中含有胃蛋白酶,可以酶解吸附在油脂表面的酪蛋白酸钠,减弱其抑制油脂聚集的能力;2)包裹在油脂表面的蛋白乳化剂处于高度酸性的环境时会带有正的净电荷,位于模拟唾液中的阴离子Mucin可能促进被阳离子蛋白(酪蛋白酸钠)包裹的油脂发生絮凝[31]。大粒径乳液/菠菜混合体系和玉米油/菠菜混合体系中变化趋势不同可能是因为这些大油滴容易在外力作用下发生破裂。经模拟胃消化后,所有样品的ζ-电位都接近于零。这可能也是由于酪蛋白酸钠被胃蛋白酶水解,导致油滴表面的负电荷减少。此外,阴离子Mucin被吸收到被阳离子蛋白质包裹的油滴表面也可能导致电荷中和[31-32]。
从图4可以看出,与其他阶段相比,经模拟胃消化后油滴的颜色最深,表明在模拟胃消化阶段有大量的脂溶性色素进入油脂之中。这是由于在模拟胃消化时,强酸性的环境和胃蛋白酶的作用会增强脂溶性色素(如类胡萝卜素)在菠菜组织中的释放[33]。同时,包裹在油脂表面的蛋白乳化剂被胃蛋白酶水解,脂溶性色素更容易进入油脂之中。从图4还可看出,较小粒径油滴的颜色较大粒径油滴深,这表明较小粒径乳液可能更有效地渗入植物组织并溶解一些脂溶性色素物质,增强植物组织中脂溶性活性成分的释放。
所有赋型剂乳液/菠菜混合体系经模拟小肠消化后,通过动态光散射法测得的d3,2均较模拟胃消化阶段显著减小(d3,2≤1 μm)(P<0.05)(图1)。从显微镜观察结果(图4)中可以看到,经过模拟小肠消化后,小粒径和中等粒径乳液/菠菜混合体系中的油脂几乎被完全消化;大粒径乳液/菠菜混合体系或玉米油/菠菜混合体系中油脂未被完全消化。该结果表明,在模拟小肠消化阶段,脂肪酶开始水解三酰基甘油分子,并且在一定的消化时间内,较小粒径乳液/菠菜混合体系的油脂消化程度更高。经模拟小肠消化后,赋型剂乳液/菠菜混合体系所带负电荷数量均显著增加(ζ-电位为-11.17~-22.01 mV),这种现象可能归因于模拟小肠消化液中存在着各种类型的阴离子胶体,如胆盐和油脂消化产生的游离脂肪酸等[9]。不同样品间ζ-电位的差异可能与油脂消化程度以及其他阴离子胶体的形成有关。
2.3 赋型剂乳液粒径对乳液/菠菜混合体系消化过程中油脂消化特性的影响
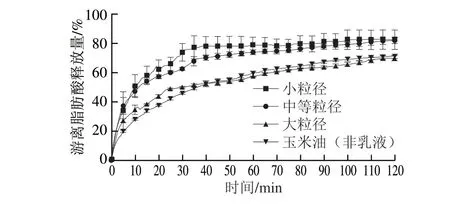
图 5 赋型剂乳液粒径对乳液/菠菜混合体系中游离脂肪酸释放的影响Fig. 5 Effect of excipient emulsion particle size on the amount of free fatty acids released from excipient emulsion/spinach mixtures
小肠中形成的混合胶束的性质已被证明是影响类胡萝卜素生物可给性最重要的因素之一,游离脂肪酸是混合胶束的重要组成成分,其影响着混合胶束对脂溶性活性成分的溶解能力[22]。因此,本实验研究了赋型剂乳液粒径对乳液/菠菜混合体系消化过程中油脂消化特性的影响,结果如图5所示。不同混合体系中油脂消化的初始速率为:小粒径乳液≈中等粒径乳液>大粒径乳液>玉米油(非乳液),即油脂的初始消化速率与乳液初始粒径成反比。不同混合体系中油脂的最终消化程度为:小粒径乳液≈中等粒径乳液>大粒径乳液≈玉米油(非乳液)。这种现象可能归因于油脂与消化酶接触表面积的差异。粒径较小的油脂拥有较大的比表面积,更容易与脂肪酶接触,因此油脂的消化速率随着油滴粒径的减小而增加。虽然经模拟胃消化后,小粒径、中等粒径乳液/菠菜混合体系的d3,2大于大粒径乳液,但小粒径、中等粒径乳液/菠菜混合体系在模拟胃消化阶段较大的d3,2主要是由于油滴的聚集和絮凝造成(图4);当这些油滴暴露在中性的模拟肠液中时,包裹在油脂表面的蛋白质(酪蛋白酸钠)的ζ-电位会由阳性变为阴性,导致阴离子Mucin的解吸,在一定程度上破坏这些絮状物的结构,最终重新释放出具有高比表面积的油脂,从而导致油脂的快速消化[34]。
2.4 乳液粒径对菠菜中β-胡萝卜素生物可给性的影响
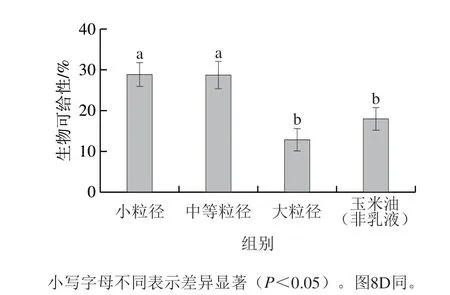
图 6 赋型剂乳液粒径对菠菜中β-胡萝卜素生物可给性的影响Fig. 6 Effect of excipient emulsion particle size on bioaccessibility of β-carotene from spinach
如图6所示,小粒径、中等粒径、大粒径赋型剂乳液及玉米油与菠菜共同进行体外模拟消化时,β-胡萝卜素的生物可给性分别为28.78%、28.65%、12.80%和17.93%。较玉米油和大粒径乳液相比,较小粒径(d3,2≈200、500 nm)的赋型剂乳液与菠菜共同进行体外模拟消化时,β-胡萝卜素的生物可给性显著较高(P<0.05)。菠菜/乳液混合体系各消化阶段高效液相色谱图如图7所示。
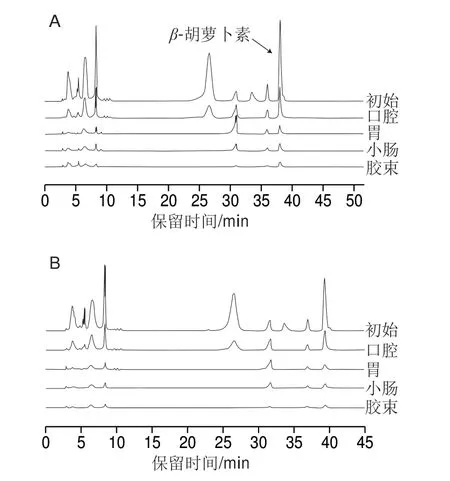
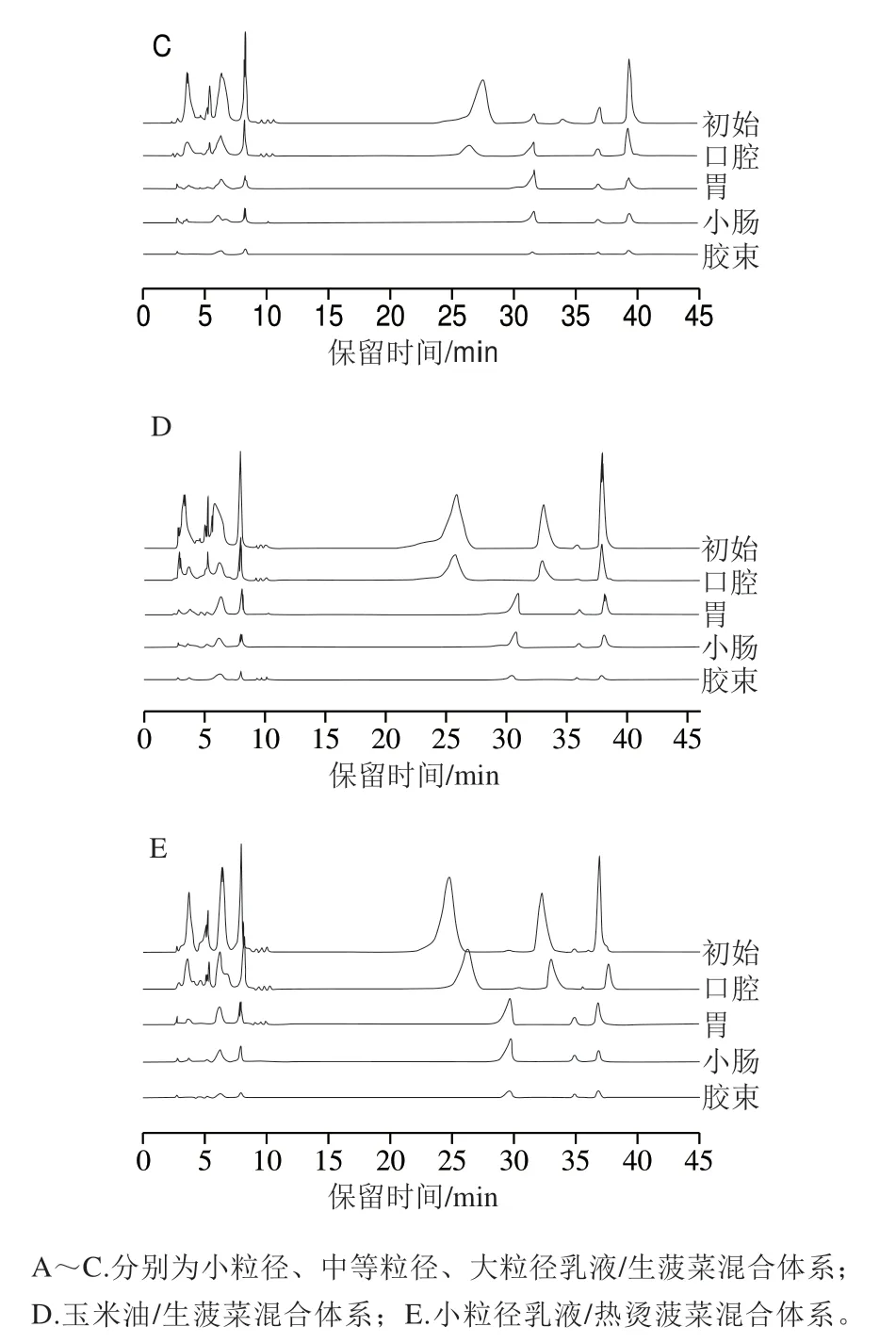
图 7 菠菜/乳液混合体系各消化阶段高效液相色谱图Fig. 7 HPLC profiles of emulsion/spinach mixed system following exposure to different GIT regions
对于β-胡萝卜素而言,油脂的加入可促进其从植物组织向胶束相转移,油脂消化产生的大量游离脂肪酸有利于混合胶束的形成,这些均有利于提高β-胡萝卜素的生物可给性[35]。与较大粒径乳液相比,小粒径和中等粒径赋型剂乳液对提高菠菜中β-胡萝卜素生物可给性的效果更佳,这是由于:1)小粒径乳液更加有利于菠菜组织中脂溶性物质从植物组织转移到油脂之中,特别是对于疏水性极强的β-胡萝卜素而言,油脂是其从菠菜组织转移到胶束的中间介质,对于其生物可给性有重要影响;2)较小粒径乳液(d3,2≈200、500 nm)油脂的初始消化速率较快、最终消化程度较高,释放出较多的游离脂肪酸,有利于形成更多的胶束来容纳β-胡萝卜素;3)大粒径油脂的消化速率相对缓慢,从菠菜组织中释放出来的类胡萝卜素分子在它们溶入混合胶束之前可能发生氧化降解。但大粒径乳液和普通食用油脂对β-胡萝卜素的生物可给性的影响无显著差异(P<0.05),这可能是由于非乳液态的玉米油经模拟胃肠道阶段消化时,在外力及各种消化酶的作用下,其粒径与大粒径乳液无明显差异。
2.5 菠菜加工方式对β-胡萝卜素生物可给性的影响
综上所述,小粒径乳液对于提高菠菜中β-胡萝卜素的生物可给性效果最佳。因此,选择粒径约为200 nm的赋型剂乳液分别与生、熟菠菜开展共同体外模拟消化,进一步研究日常加工方式对菠菜中β-胡萝卜素生物可给性的影响。
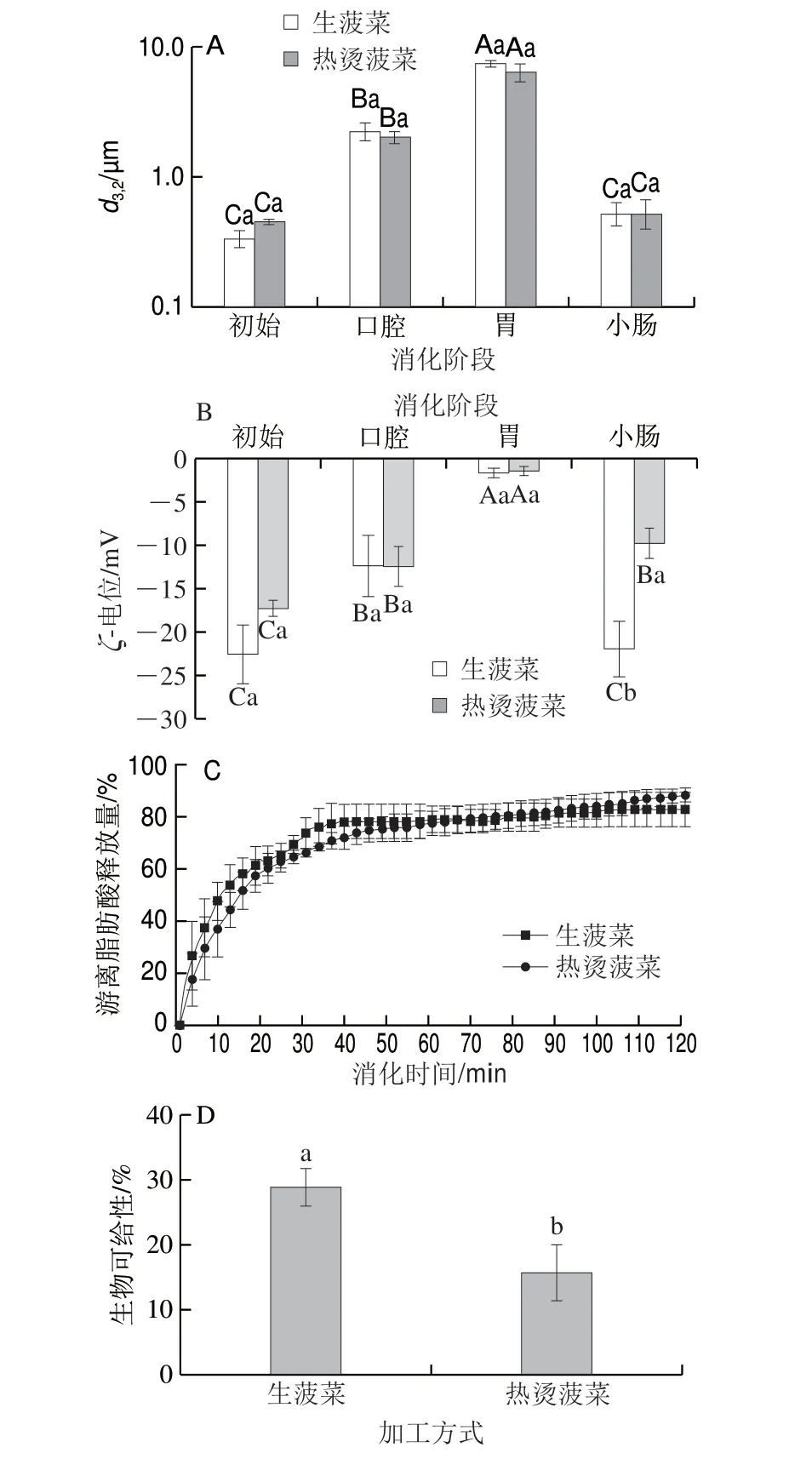
图 8 菠菜加工方式对乳液/菠菜混合体系体外模拟消化过程中的d3,2(A)、ζ-电位(B)、油脂消化特性(C)和β-胡萝卜素生物可给性(D)的影响Fig. 8 Effects of processing methods on mean particle size (d3,2) (A),ζ-potential (B), oil digestibility (C) and bioaccessibility of β-carotene (D)in emulsion/spinach mixtures during simulated GIT digestion
从图8中可以看出,加工方式总体上并未对乳液/菠菜混合体系体外模拟消化过程中的粒径(图8A)、ζ-电位(图8B)及油脂消化特性(图8C)造成显著影响,但显著影响β-胡萝卜素的生物可给性(图8D)。生菠菜/赋型剂乳液混合体系和热烫菠菜/赋型剂乳液混合体系中β-胡萝卜素的生物可给性分别为28.78%和15.66%,这表明与生菠菜相比,短时的加热处理显著降低了菠菜中β-胡萝卜素的生物可给性(P<0.05)。
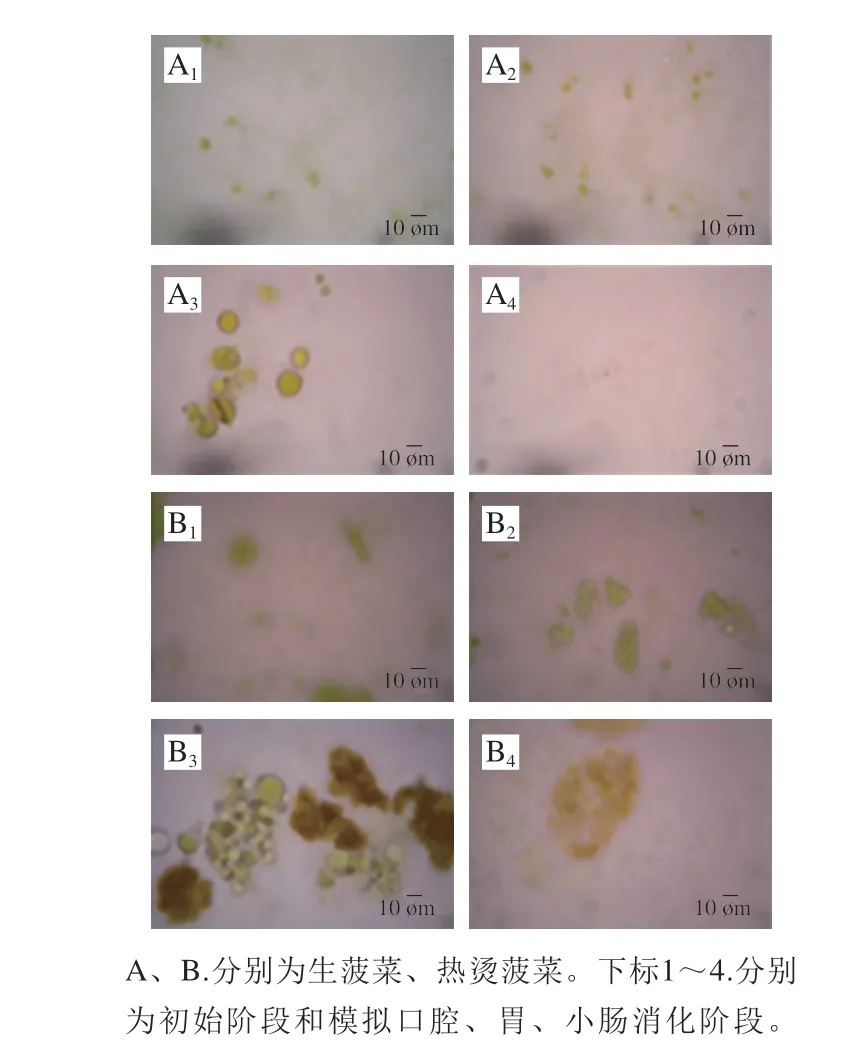
图 9 赋型剂乳液与生菠菜或热烫菠菜共同进行体外模拟消化过程中显微镜观察结果Fig. 9 Microscopic images of excipient emulsion co-digested with raw or blanched spinach after exposure to each stage of simulated GIT
此外,加工方式还影响着乳液/菠菜混合体系消化过程中的微观结构。从图9中可以看出,热烫菠菜/赋型剂乳液混合体系经模拟小肠消化后,菠菜组织中仍保留着大量色素物质,而生菠菜组织中的色素物质释放得更加完全。这一现象表明,β-胡萝卜素生物可给性的差异可能是由于在机械处理和胃肠道消化过程中,生菠菜的组织细胞更容易发生破裂,有利于类胡萝卜素的释放;而热烫后的菠菜的组织细胞更倾向于完整地分离,使得类胡萝卜素仍较多被包封在组织细胞中,限制了其进入混合胶束的能力。本研究结果与Tydeman等[18]的结果一致。此外,在相同的机械处理条件下,生菠菜和热烫菠菜的组织破碎程度可能不同[36],从而影响了类胡萝卜素从植物组织向混合胶束的转移,在一定程度上造成其生物可给性的差异。
3 结 论
研究结果表明,随着赋型剂乳液粒径的减小,菠菜中β-胡萝卜素的生物可给性逐渐升高。这与乳液初始粒径影响菠菜组织中类胡萝卜素物质的释放、油脂的消化速率和最终消化程度以及混合胶束的形成有关。此外,菠菜的加工方式也显著影响着β-胡萝卜素的生物可给性,热烫菠菜的生物可给性显著低于生菠菜(P<0.05),这可能是由于经热烫处理的菠菜组织破碎程度和消化程度均低于生菠菜,不利于类胡萝卜素的释放。这提示可针对性地设计与生果蔬共同食用的赋型剂乳液(如沙拉酱)或与热加工的果蔬共同食用的赋型剂乳液(如酱汁),以便能更大程度地提高活性成分的生物利用率。

