热处理对酶改性蛋黄液乳化性的影响及拉曼光谱分析
徐 楠,赵 英,迟玉杰*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
液态蛋是指禽蛋打蛋去壳,将蛋液经过搅打、杀菌及包装等处理后冷藏制成的代替鲜蛋消费的产品。可分为蛋白液、蛋黄液和全蛋液3 类。液态蛋产品不仅克服了鲜蛋易碎、易污染、难运输和难贮藏等缺点,而且省去了打蛋、分蛋及处理蛋壳等操作,因此在工业生产及家庭生活中受到了广泛欢迎[1]。液态蛋生产的关键技术之一是杀菌技术。由于禽蛋中的蛋白质热凝固温度一般在60 ℃左右[2],经过较高温度或较长时间热处理,会导致蛋白质变性,从而引起其功能性质的下降[3-5]。各国采用的蛋黄液杀菌温度为60~65 ℃,其在4 ℃下的保存期只有20 d左右,极大地制约了蛋黄液的应用。因此,提高蛋黄液在热处理后的功能性质、开发新型蛋黄液产品十分必要。
酶改性是指利用生物酶制剂在温和的条件下催化蛋白质水解以达到修饰蛋白质的作用,是一种不减弱食品营养价值、同时能够获得更好功能性质的简便方法。蛋黄中大部分蛋白质为脂蛋白[6],因此可以利用蛋白酶和磷脂酶对其进行改性。Wang Guang等[7]利用两种食品级的内切蛋白酶来制取水解度分别为3%和6%的蛋黄蛋白水解物,水解后的蛋黄乳化能力和稳定性得到了较大程度的提高。Bao Zhijie等[8]利用碱性蛋白酶水解蛋黄蛋白质,发现水解度10%时蛋黄蛋白质乳化能力明显提高。刘剑秋等[9]研究发现使用复合风味蛋白酶部分水解全蛋蛋白可使其热凝固温度提高到75 ℃。王迎新等[10]发现经磷脂酶修饰后蛋黄粉的乳化性和热稳定性均有显著提高。
尽管国内外均开展了关于酶改性对蛋黄液功能性质影响的研究,但关于酶改性蛋黄液在热处理后乳化性质变化情况的研究相对较少。采用拉曼光谱对酶改性蛋黄液蛋白质构象变化与功能性质之间构效关系的研究也鲜有报道。本研究采用中性蛋白酶对蛋黄液进行酶改性,探究改性前和酶改性后蛋黄液在不同热处理条件(60、65、70 ℃均处理4 min)下蛋白结构和功能性质的变化,解析结构变化与功能性质的关系,以期为酶改性技术在液态蛋生产中的应用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 哈尔滨市香坊区忠君超市;大豆色拉油哈尔滨九三油脂有限责任公司;中性蛋白酶(酶活力9.8×104U/g) 上海源叶生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、氯化钠等均为国产分析纯;实验中所用的水均为超纯水。
1.2 仪器与设备
HH-4数显恒温水浴锅 常州国华电器有限公司;pH计梅特勒-托利多仪器(上海)有限公司;JJ-1精密增力电动搅拌器 上海浦东物理光学仪器厂;T18高速匀浆机 德国IKA公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;2000型激光粒度仪 英国马尔文公司;inVia显微拉曼光谱仪 英国雷尼绍公司。
1.3 方法
1.3.1 样品制备
蛋黄液制备的具体工艺流程[1]如下。
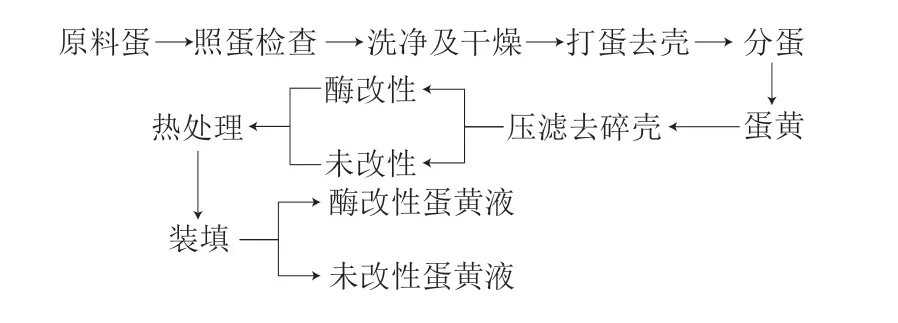
中性蛋白酶是一种内切酶,广泛应用于动植物蛋白的酶改性。其最适作用pH值为6.5~7.0,与蛋黄液的pH值基本一致;最适作用温度为45~55 ℃,略小于蛋黄中蛋白质的变性温度,能够保证蛋黄的酶改性在温和条件下高效进行,故采用中性蛋白酶进行蛋黄液的酶改性。酶改性条件为:中性蛋白酶质量分数0.05%、酶解时间45 min、反应温度47 ℃。热处理采用水浴法,温度分别为60、65 ℃及70 ℃,处理时间均为4 min。装填包装后的蛋黄液于4 ℃下贮存备用。
1.3.2 乳化活性和乳化稳定性的测定
参考Comas等[11]的方法并稍作改动。用0.5 mol/L的氯化钠溶液将蛋黄液稀释为蛋白质量浓度0.01 g/mL的溶液,取上述溶液20 mL,加10 mL大豆色拉油,室温下用高速匀浆机10 000 r/min均质1 min以形成乳化液,在不同时间从此乳状液底部取20 μL,用含1 mg/mL SDS溶液稀释300 倍体积,以相同质量浓度的SDS溶液作为参比液,在500 nm波长处测定吸光度。乳化活性指数(emulsifying activity index,EAI)、乳化稳定性指数(emulsion stability index,ESI)分别按式(1)、(2)计算。


式中:T=2.303,为ln 10的近似值;N为稀释倍数(300);ρ为乳化液形成前蛋白质水溶液中蛋白质量浓度/(g/mL);φ为乳化液中油相体积分数/%;A0为0 min时的吸光度;A30为30 min时的吸光度。
1.3.3 粒径大小及分布的测定
参考Campbell等[12]的方法,采用动态光散射技术,利用2000型激光粒度分析仪测定新鲜制备的乳状液的粒径大小及其分布,测定温度25 ℃。参数设置为:颗粒折射率1.520、颗粒吸收率0.001,分散剂为水,分散剂折射率1.330。实验采用D4,3(体积平均粒径)表征液滴粒径的大小[13]。Dν10、Dν50和Dν90分别表示占整个乳化体系10%、50%和90%颗粒的体积平均粒径。样品均质后立即测定,每个样品重复3 次。
1.3.4 拉曼光谱分析
参考Herrero等[14]的方法,将蛋黄液样品置于载玻片上进行拉曼光谱扫描,激发光波长为532 nm,激光功率为0.075 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10 次,3 次扫描进行累加,峰位误差小于3 cm-1。以苯丙氨酸(1 003±1)cm-1作为归一化因子[15],采用WiRE™ 2.0软件得到蛋黄液的拉曼光谱。图谱基线校正、谱峰归属查找采用OMINIC软件。图谱拟合采用Origin 8.6软件。采用Alix等[16]的方法分析各样品蛋白二级结构的相对含量。
1.3.5 乳化性模型的建立
应用Unscrambler多变量统计分析软件中的偏最小二乘法(partial least squares,PLS)及主成分回归方法建立校正模型,并采用完全交互验证方式得到验证模型的各项参数。
1.4 数据统计与分析
所得数据均为3 次重复的平均值,利用SPSS 17.0软件分析数据,P<0.05为具有显著性差异。采用Origin Pro 8.6软件进行数据分析和图谱处理。
2 结果与分析
2.1 热处理对酶改性蛋黄液乳化性质的影响
EAI表征蛋白质吸附在油水界面的能力,反映了蛋白质形成并稳定乳状液的能力;ESI反映了乳化剂维持乳化体系稳定性的能力,因此EAI和ESI是衡量乳化体系乳化性能的重要指标[17-18]。
如图1所示,与25 ℃相比,随着热处理温度的升高,两组蛋黄液的EAI均呈现下降的趋势,60 ℃、4 min热处理不会引起蛋黄液EAI的显著下降。当热处理温度超过60 ℃后,蛋黄液的EAI显著下降(P<0.05)。在经过同等强度的热处理后,酶改性蛋黄液的EAI均显著高于未改性蛋黄液(P<0.05)。这与Guilmineau等[19]的研究结果基本一致。热处理会导致蛋白质结构的改变,变性程度取决于热处理的强度。蛋白质变性后聚集,甚至可能形成凝胶[20]。
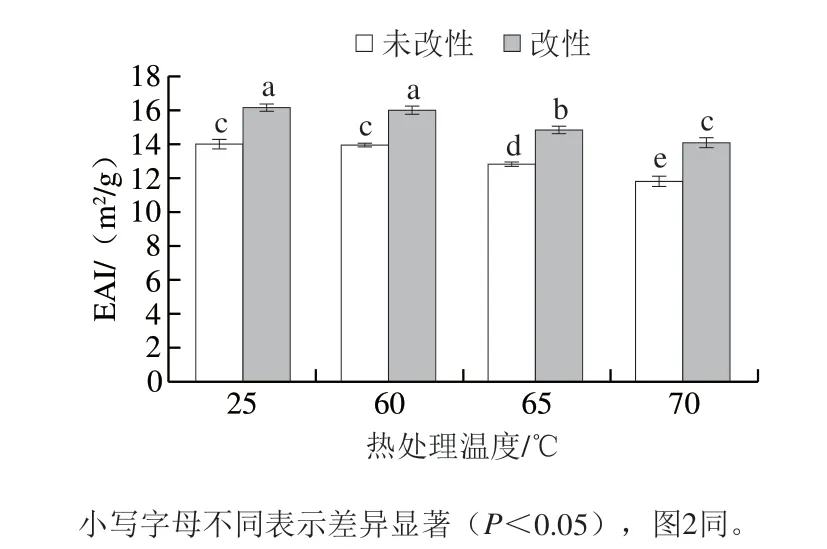
图 1 热处理对酶改性蛋黄液EAI的影响Fig. 1 Effect of heat treatment on ESI of enzymatically modified egg yolk liquid

图 2 热处理对酶改性蛋黄液ESI的影响Fig. 2 Effect of heat treatment on ESI of enzymatically modified egg yolk liquid
如图2所示,与25 ℃相比,随着热处理温度的升高,两组蛋黄液的ESI均呈现上升的趋势。60 ℃、4 min热处理会引起蛋黄液ESI的显著升高;处理温度超过65 ℃后,热处理对蛋黄液ESI的影响不显著,ESI趋于稳定。在经过同等温度的热处理后,酶改性蛋黄液的ESI均显著高于未改性蛋黄液(P<0.05)。
2.2 热处理对酶改性蛋黄液乳化体系粒径大小和分布的影响
乳化体系中液滴颗粒的粒径大小和分布反映了形成的乳化体系中乳化剂的乳化活力,会影响乳状液的物理稳定性和热稳定性。乳状液中液滴颗粒越小、分布越均一,则乳状液体系越趋于稳定[21]。因此,研究蛋黄液乳化体系的粒径大小及分布对于理解其乳化性质尤为重要。
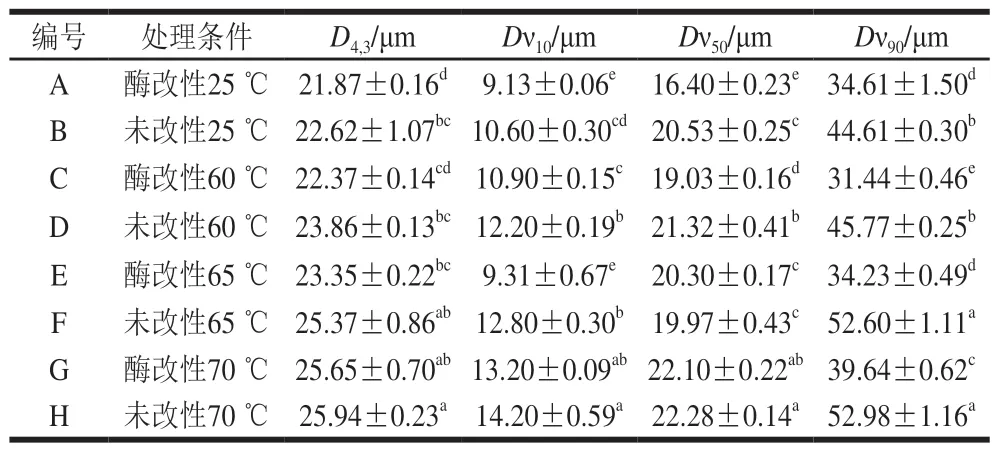
表 1 不同热处理条件下酶改性蛋黄液与未改性蛋黄液乳化体系的粒径大小Table 1 Mean droplet diameter of modified and unmodified egg yolk emulsion systems under different heat treatments
由表1可知,随着热处理温度的升高,乳化体系的平均粒径表现出增大的趋势,酶改性蛋黄液形成的乳化体系的平均粒径(Dν10、Dν50、Dν90)总体上小于未改性蛋黄液。25 ℃未改性蛋黄液的Dν10、Dν50、Dν90分别为10.60、20.53、44.61 μm,经过酶改性后,蛋黄液的Dν10、Dν50、Dν90分别下降至9.13、16.40、34.61 μm(P<0.05)。与25 ℃时相比,经65 ℃处理后,未改性蛋黄液Dν10、Dν50、Dν90分别上升至12.80、19.97、52.60 μm(P<0.05),而经相同热处理的酶改性蛋黄液Dν10、Dν90分别为9.31、34.23 μm,显著低于未改性蛋黄液(P<0.05)。乳化体系D4,3的变化趋势也呈现相同的结果。

图 3 不同热处理条件下酶改性蛋黄液与未改性蛋黄液乳化体系的粒径分布Fig. 3 Particle size distributions of modified and unmodified egg yolk emulsion systems under different heat treatments
如图3所示,蛋黄液乳化体系体积分布与粒径大小的变化趋势一致。随着热处理温度的升高,粒径峰逐渐正向移动,表现为平均粒径逐渐增大。改性后蛋黄液所形成的乳化体系粒径更加接近正态分布,呈现单一峰。而未改性蛋黄液乳化体系粒径分布更加分散,呈现双峰,大粒径颗粒所占比例更大。Hosseini等[22]研究发现乳状液液滴的粒径越小,其乳化剂EAI越大,这与本研究结果一致。乳化体系中乳化剂的EAI与粒径大小及分布呈现负相关。而随着热处理温度的上升,乳化体系ESI升高,粒径逐渐增大。这可能是由于加热导致了蛋白质的热聚集,所以乳化后粒径有所增加。
2.3 热处理对酶改性蛋黄液拉曼光谱的影响
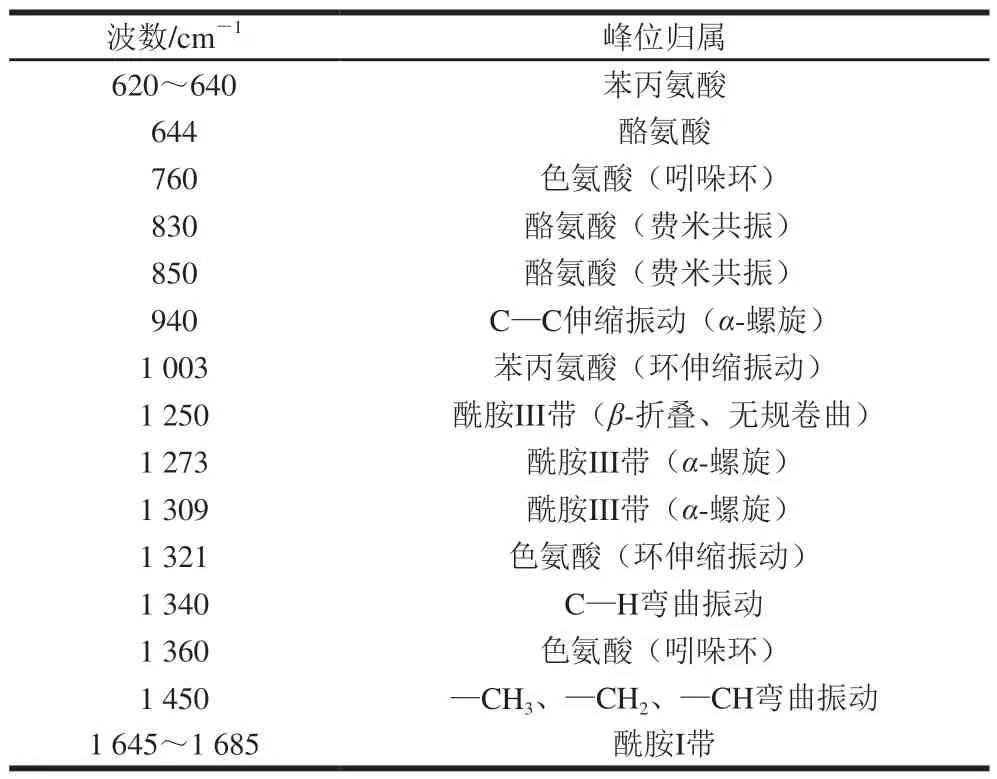
表 2 蛋黄液中蛋白质的拉曼光谱特征峰和峰位归属[23-25]Table 2 Assignment of Raman bands of proteins in egg yolk liquid[23-25]
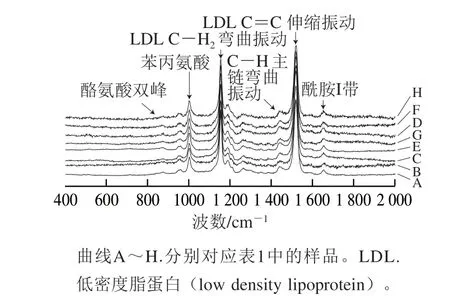
图 4 不同热处理条件的酶改性蛋黄液与未改性蛋黄液拉曼光谱Fig. 4 Raman spectra of proteins in modified and unmodified egg yolk liquid under different heat treatments
各组蛋黄液蛋白质的拉曼光谱特征峰和峰位归属见表2,根据表中峰位归属与频率之间的对应关系在图4中标注出各样品相应的拉曼谱带及变化。拉曼光谱中拉曼位移和相对强度可以反映酶改性蛋黄液中蛋白质在热处理前后所处环境和构象变化等信息。由于苯丙氨酸结构相对稳定,在1 003 cm-1处的特征峰不易受到外界环境变化的影响,故将其作为归一化因子对各样品的拉曼图谱进行归一化处理。由图4可知,谱线发生不同程度的位移,说明改性后热处理蛋黄液中蛋白质的化学键数目发生变化。各拉曼光谱的峰频率和强度也发生了变化,反映出蛋白质空间构象的变化。
2.3.1 酰胺I带构象变化
拉曼光谱中的酰胺I带(1 600~1 700 cm-1)对于研究蛋白质二级结构最有价值。位于1 665 cm-1左右的强特征峰主要来源于C=O双键的伸缩振动和N—H键的弯曲振动,大量研究表明,酰胺I带可以准确反映出蛋白质主链结构的变化,同时,酰胺I带也可用于蛋白质二级结构相对含量的定量分析[15,26]。
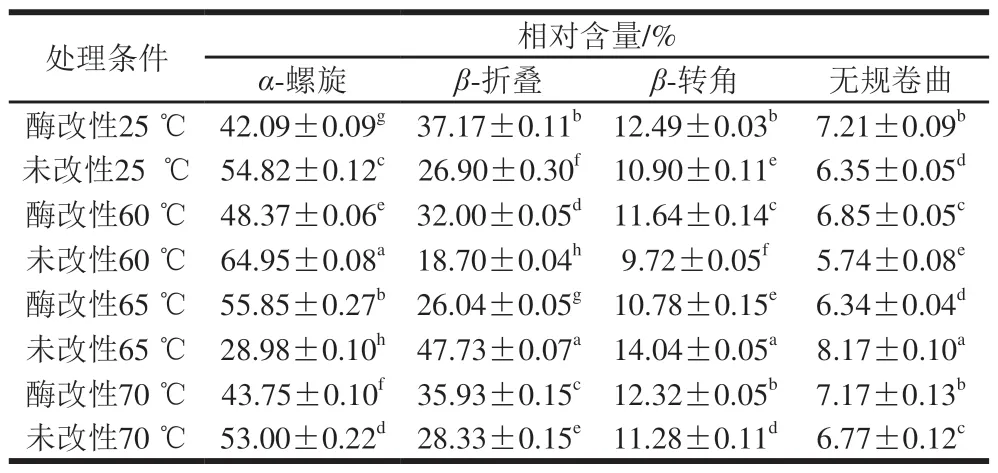
表 3 不同热处理条件下酶改性蛋黄液与未改性蛋黄液中蛋白质二级结构相对含量Table 3 Relative contents of secondary structures of proteins in modified and unmodified egg yolk liquid under different heat treatments
由表3可知,蛋黄液中蛋白质二级结构组成为α-螺旋54.82%、β-折叠26.90%、β-转角10.90%、无规卷曲6.35%。这与吕雪娟等[27]的研究结果基本一致。蛋黄液中的蛋白质二级结构以α构象为主,表明蛋黄液中蛋白质分子内部氢键相互作用较强。从表3中还可以看出,β-折叠相对含量减少时α-螺旋相对含量增加,即在加热过程中β-折叠转化为α-螺旋结构。在加热过程中,未改性蛋黄液蛋白质二级结构中β-折叠、β-转角及无规卷曲结构相对含量先减小后增大,超过65 ℃后又显著下降;而α-螺旋结构相对含量则是先增大后减小,超过65 ℃后显著上升。酶改性后蛋黄液α-螺旋及β-转角结构在65 ℃条件下相对含量分别为最高和最低。蛋黄蛋白质的平均变性温度为65 ℃,此时蛋黄液中蛋白质的二级结构变化最为明显,酶改性蛋黄液α-螺旋结构相对含量显著高于未改性蛋黄液,无规卷曲结构相对含量明显低于未改性蛋黄液。这说明酶改性改变了蛋白质内的氢键作用,蛋白质有序性增加。
2.3.2 基团微环境变化
2.3.2.1 色氨酸残基的变化
色氨酸会产生多个拉曼光谱谱带,对于研究蛋白质微环境的极性及氢键变化有着重要价值。在759 cm-1左右的谱带是由吲哚环振动引起的,其对色氨酸残基微环境的极性十分敏感,处于“包埋”状态的色氨酸残基较“暴露”状态下的拉曼谱带强度更高[28]。
由表4可知,经酶改性后蛋黄液的色氨酸谱带强度上升,表明色氨酸残基微环境转由“包埋”状态微环境转为“暴露”状态,蛋白质结构有所展开。随着热处理温度升高,蛋黄液的色氨酸谱带强度均下降,说明热处理不利于色氨酸残基“暴露”在极性微环境中。在相同热处理温度下酶改性蛋黄液色氨酸谱带强度均高于未改性蛋黄液,说明酶改性技术有助于蛋黄蛋白质在热处理过程中保持其色氨酸残基所处的微环境,从而提高或保持其功能性质。
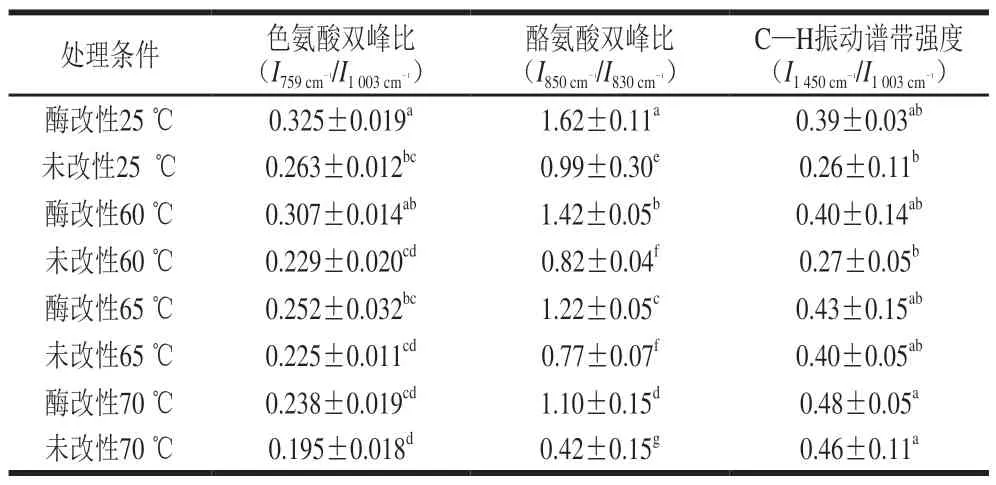
表 4 不同热处理条件下酶改性蛋黄液与未改性蛋黄液中色氨酸、酪氨酸双峰比和C —H振动谱带强度Table 4 Normalized intensities of tryptophan band, tyrosyl doublet,and C-H band of proteins in modified and unmodified egg yolk liquid under different heat treatments
2.3.2.2 酪氨酸残基的变化
酪氨酸对羟苯基环的呼吸振动和环平面外弯曲振动倍频之间的费米共振引起的850 cm-1和830 cm-1处的双峰是构象灵敏的谱线,随侧链微环境变化而改变。当酪氨酸双峰比(I850cm-1/I830cm-1)不低于1时说明酪氨酸残基处于“暴露”状态,而酪氨酸双峰比小于1时说明酪氨酸残基处于“包埋”状态[29]。
由表4可知,未改性前蛋黄液酪氨酸双峰比为0.99,经酶改性后蛋黄液的酪氨酸双峰比为1.62,表明酪氨酸残基微环境转由“包埋”状态转为“暴露”状态。经过热处理后,蛋黄液的酪氨酸双峰比均有所下降,说明热处理不利于极性微环境中酪氨酸残基的“暴露”。在相同热处理温度下酶改性蛋黄液酪氨酸双峰比均高于未改性蛋黄液,且酶改性蛋黄液中的酪氨酸残基始终处于“暴露”状态。
2.3.2.3 脂肪族C—H键弯曲振动变化
在1 450 cm-1附近可以观察到—CH3、—CH2的弯曲振动。由表4可知,经酶改性后蛋黄液的C—H振动谱带强度显著上升,表明更多疏水基团暴露到极性微环境中[30]。疏水作用的改变会进一步影响蛋白质结构[31]。随着热处理温度的升高,蛋黄液的C—H振动谱带强度显著上升,说明热处理有利于脂肪族疏水基团的“暴露”。在相同热处理温度下,酶改性蛋黄液C—H振动谱带强度均高于未改性蛋黄液,说明酶改性技术可以减缓热处理过程中因蛋白聚集导致的疏水基团包埋并向微极性环境的转变。
综上所述,酶改性有利于色氨酸残基、酪氨酸残基及脂肪族疏水基团“暴露”到极性微环境中,同时减缓热处理过程中因蛋白聚集导致的疏水基团包埋并向微极性环境的转变。Kato等[17]研究发现蛋黄蛋白质的EAI和ESI与表面疏水性线性相关,这与本研究结果一致。
2.3.3 基于拉曼光谱的乳化性质模型
选取经热处理的蛋黄液样品共8 组(酶改性4 组、未改性4 组),每个样品分别在同一基底的2 个不同位置取点进行拉曼光谱测试,将得到16 组图谱数据作为样本集,用于PLS模型的建立。蛋黄液EAI及ESI的PLS模型如图5所示。
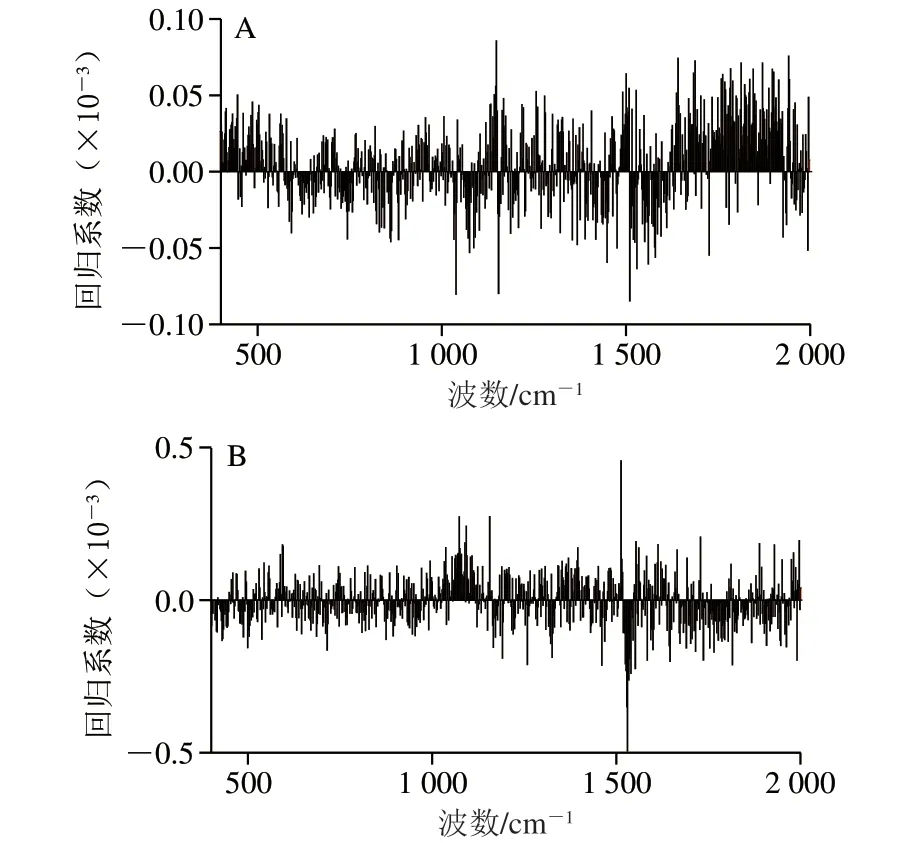
图 5 蛋黄液EAI(A)及ESI(B)的PLS模型Fig. 5 PLS models for EAI (A) and ESI (B) in egg yolk liquid
由图5可以看出,在EAI的PLS模型中,1 155、1 519、1 652、1 700~1 900 cm-1附近的拉曼峰在模型中占较大的比例;在ESI的PLS模型中,1 065~1 120、1519 cm-1附近的拉曼峰在模型中占较大的比例。1 519 cm-1及1 155 cm-1附近的拉曼峰为蛋黄中LDL的特征峰,分属于烷基链C=C伸缩振动及—CH2不对称弯曲振动。1 700~1 900 cm-1附近的拉曼峰主要包含了酰胺I带及C=O伸缩振动带。由图6可知,该模型具有较好的预测能力,蛋黄液EAI的PLS模型R2=0.992,均方根误差为0.120;蛋黄液EAI的PLS模型R2=0.978,均方根误差为0.334。通过对乳化性质预测模型的分析可知,蛋黄液中蛋白质二级结构及构象变化特别是LDL的构象变化对蛋黄液乳化性质影响最大。

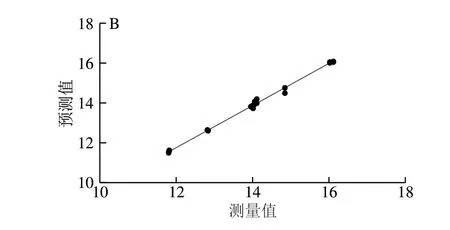
图 6 蛋黄液EAI(A)及ESI(B)的PLS模型回归验证Fig. 6 Regression validation of PLS models for EAI (A) and ESI (B)
3 结 论
本实验主要研究了不同热处理条件对酶改性蛋黄液乳化性质的影响,利用拉曼光谱分析蛋黄液中蛋白质的构象变化。结果表明,随着热处理温度的升高,酶改性蛋黄液的EAI呈现下降趋势,所形成的乳化体系粒径表现出增大的趋势。经过同等温度的热处理后,酶改性蛋黄液的EAI及ESI均显著高于未改性蛋黄液,所形成的乳化体系粒径显著小于未改性蛋黄液且更加均一。拉曼光谱分析结果显示,经热处理后,酶改性蛋黄液中蛋白质的α-螺旋结构相对含量显著高于未改性蛋黄液,无规卷曲结构相对含量显著低于未改性蛋黄液,色氨酸残基、酪氨酸残基及脂肪族疏水基团充分暴露。通过对拉曼光谱乳化性质预测模型的分析表明,蛋黄液中蛋白质二级结构及构象变化特别是LDL的构象变化对蛋黄液乳化性质影响最大,通过酶改性技术可以促使蛋黄液中蛋白质的二级结构及构象向着有利于提高乳化性质的方向转变。在后续研究中,应深入研究蛋白质的二级结构及构象变化影响蛋黄液功能性质的机理,为开发具有高乳化性的蛋黄液产品提供理论指导。

