一株虹鳟源乌尔新不动杆菌的分离鉴定与其感染的病理损伤
吴春艳,任思宇,汪开毓,蒲华靖
( 1.重庆三峡职业学院,重庆 万州 404155; 2.四川农业大学动物医学院,四川 成都 611130; 3.重庆市开州区水产技术推广站,重庆 开州 405400 )
不动杆菌(Acinetobacter)是一类短棒状的革兰氏阴性短杆菌,属奈瑟氏菌科,广泛分布于自然环境中[1]。此前,该菌通常被认为是一类低毒力的条件性致病菌,主要引起人类的皮肤组织感染与尿路感染;近年来,人们发现它们具有多重药物抗药性和强烈的宿主抵抗力,常在医院内,尤其是在重症监护病房中导致获得性肺炎、脑膜炎及败血症的发生,成为了医疗过程中难以解决的难题[2]。目前,在医疗领域不动杆菌的研究集中在毒力因子与耐药性机理上;在水生动物中,人们重在关注该菌感染后的临床症状与治疗时的药物选择,如王世震等[3]进行了短须裂腹鱼(Schizothoraxwangchiachii)感染不动杆菌后的诊断与防治研究,毛芝娟等[4]进行了匙吻鲟(Polyodomspathula)不动杆菌感染的耐药性分析,陆文浩等[5]进行了银鲫(Carassiusauratusgibelio)不动杆菌感染的分离鉴定与药物敏感性分析,丁利等[6]进行了乌龟(Mauremysnigricans)不动杆菌感染的分离鉴定与药敏分析。而对养殖的虹鳟(Oncorhynchusmykiss)因不动杆菌感染发病的案例却鲜有报道。
近几年,虹鳟已成为我国冷水鱼养殖的重要种类,尤其在冷水资源丰富的西南地区,该鱼的养殖发展迅速。在重庆,虹鳟的养殖集中在渝东北及渝东南片区,尤其以彭水、石柱及开县、城口的养殖最成规模,养殖模式为集约化的流水养殖。因该鱼对水温与水质环境要求苛刻,养殖中疾病频发,给从业者造成了严重的困扰[7]。笔者在进行重庆地区名特优鱼类疾病调查的过程中发现,开州区谭家镇的泰旭农业有限公司虹鳟养殖基地,于2016—2018年期间发生持续性的虹鳟死亡,临床表现为,食欲下降,离群独游,鳃有大量的黏液及附着物,鳍条蛀蚀脱落,尾鳍基部充血、出血,并伴有严重的肠道炎症。笔者对此次发病进行了病原的分离,并对病原菌进行了生理生化鉴定,16S rRNA及rpoB基因的序列测定与系统发育分析,及耐药性的观察与组织病理损伤的研究,以助于探明病因及病程发展规律,为防治虹鳟不动杆菌病积累基础资料。
1 材料与方法
1.1 材料
病鱼取自重庆市开州区谭家镇泰旭农业冷水鱼养殖基地,体质量为0.4~2.1 kg;健康鱼购自重庆市万州区渔沣生态渔业有限公司,体质量为80~120 g。药敏纸片购自杭州天和微生物试剂有限公司;绵羊血采自重庆三峡职业学院竹园农场经检疫合格的健康绵羊;细菌生化微量鉴定管购自杭州微生物试剂有限公司。
1.2 病原菌分离纯化
无菌条件下,用接种环挑取发病虹鳟的肝、肾与溃烂处的组织,划线接种于LB平板上,20 ℃恒温培养24 h后,挑取单一的优势菌落进行纯化培养,获得纯化菌株K180411。
1.3 回归感染试验
选取暂养15 d后,健康无病症的虹鳟进行浸泡感染,试验分为正常组与处理组(处理组刮下鱼体尾柄处的部分鳞片)。正常组100尾,共设4个小组(Z1、Z2、Z3与对照组),除对照组不设平行外,每个小组为30尾,分成3个平行组。处理组与正常组的设置一致,编号为C1、C2、C3与对照组。处理组中C1、C2、C3试验组菌液密度依次为8×106、4×106、1×106cfu/mL,正常组中Z1、Z2、Z3试验组菌液密度与处理组一致,也依次为8×106、4×106、1×106cfu/mL,对照组均为曝气后的自来水。养殖水体控制为温度20 ℃,pH 7.0~7.5,溶解氧>5 mg/L。试验过程中禁止投喂饲料,观察并记录虹鳟的健康状况,对发病及死亡个体进行细菌分离鉴定。
1.4 病原菌的生理生化特性鉴定和基因序列测定及系统发育分析
参照《伯杰氏细菌鉴定手册》与文献[8],对菌株K180411进行生化鉴定。将菌株K180411接种于用绵羊血细胞制作的血平板上,观察菌株的溶血特性。用LB液体培养基冲洗收集纯化的菌株K180411,提交至生工生物工程(上海)股份有限公司进行PCR扩增和16S rRNA与rpoB测定,序列结果在GenBank中进行Blast比对分析,并采用MEGA 7.0进行系统发育树的构建与分析。16S rRNA、rpoB基因的扩增引物分别为5′-AGAGTTT GATCCTGGCTCAG-3′/3′-TACGGCTACCTTG TTACGAC-5′[9]、5′-CCTTCATGACCTGGAAYG GNTA-3′/3′-TCCAGGATCTGNCCNACRTTC AT-5[10]。
1.5 自然发病鱼类临床症状与病理损伤研究
取发病鱼类鳃丝、溃疡组织、及体表黏液附着物进行压片观察,并采集自然发病虹鳟的肝、肠、脾与鳃等组织,固定于4%的中性福尔马林溶液中,采用苏木精—伊红染色法进行组织病理学研究。
1.6 药敏试验
采用比浊法将菌株K180411制成密度为1.0×107cfu/mL的菌液,涂布接种于LB平板上,用灭菌后的镊子将药敏纸片粘贴于平板表面,20 ℃恒温培养36 h,测量平板上的抑菌圈,判断该细菌的药物敏感性。
2 结果与分析
2.1 病原菌分离与回归感染
从自然发病虹鳟的肝、肾及体表溃烂处均分离到了一株优势菌株,编号为K180411。20 ℃培养24 h后,可见菌落在LB平板上形成直径约为1 mm的半透明菌落;镜下观察,菌体呈双球状,革兰氏染色阴性,细菌大小为(0.9~1.6) μm×(1.3~2.2) μm。
回归感染中,C1处理组在第10 d开始发病,C2、C3处理组分别在13、17 d表现出症状,对照组未出现变化,感染及死亡情况见表1。病检结果显示,回归感染发病鱼类症状与自然发病鱼类一致。在回归感染的虹鳟肝与体表溃烂处分离到与菌株K180411理化性质一致的菌株,表明该菌对虹鳟具有致病性。Z3正常组在第9 d有1尾鱼表现出症状,其余各组均未出现病变,可能是在试验鱼转运、处理过程中因操作的原因导致损伤而引起的。
2.2 病原菌生化特性鉴定系统发育分析
将菌株K180411接种于5%的脱纤维绵羊血平板,24 h后菌落周围形成典型的β溶血环(图1)。生化特性检测显示,菌株枸橼酸盐反应阳性,无法水解七叶苷,不能利用麦芽糖、葡萄糖、精氨酸,硝酸盐还原反应为阴性等。除溶血特性外,其余指标与Laurent等[8]报道的的乌尔新不动杆菌(A.ursingii)一致(表2)。
图1 菌株K180411的溶血特性观察
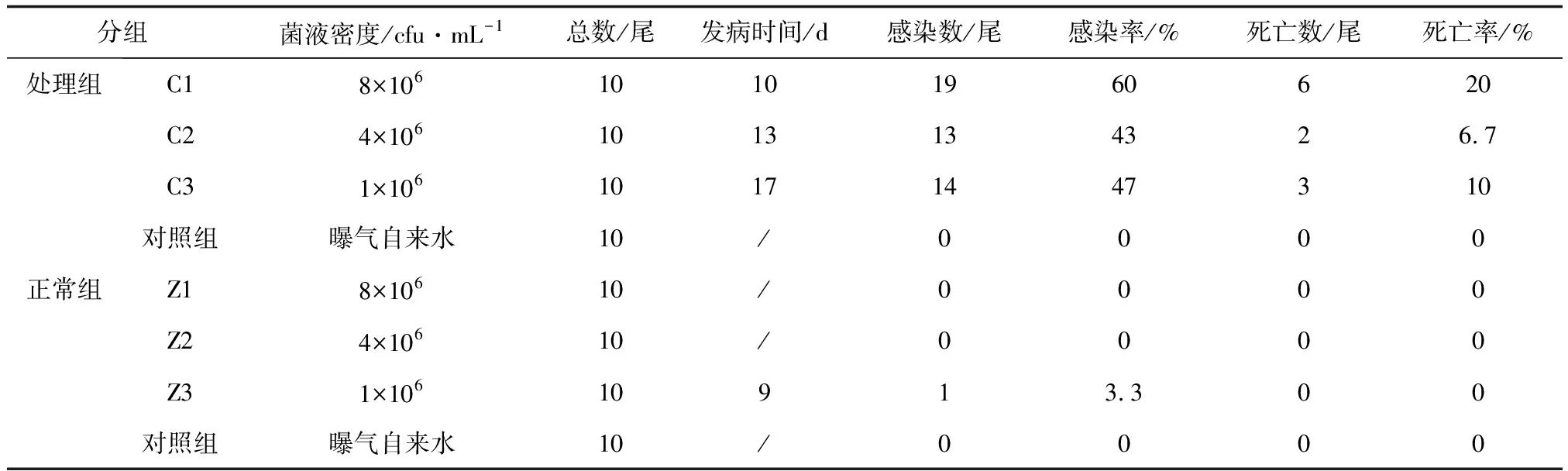
表1 K180411回归感染试验结果

表2 K180411表型特征与已报道的乌尔新不动杆菌的比较
16S rRNA与rpoB基因扩增,分别得到1468 bp与921 bp的PCR产物(图2),将生工生物工程(上海)股份有限公司测序的结果在GenBank中进行Blast比对分析,用Mega 7.0进行系统发育树的构建。16S rRNA结果显示,菌株K180411与新生儿重症病房中分离的不动杆菌属未命名菌株NR116070同源关系最近,与已命名的乌尔新不动杆菌MH113156亲缘关系最近(图3)。rpoB的结果显示菌株K180411与乌尔新不动杆菌KJ789099的亲缘关系最近(图4)。据此,综合生化特性鉴定、16S rRNA及rpoB基因的系统发育分析结果,鉴定此次发病病原菌为乌尔新不动杆菌。
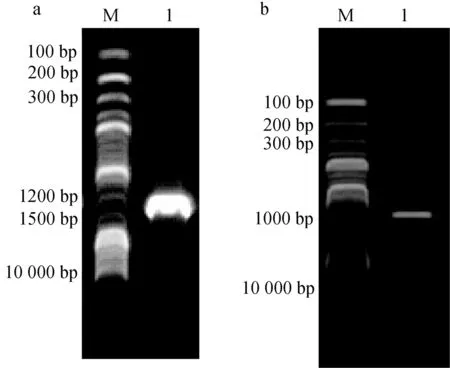
图2 菌株K180411的16S rRNA与rpoB基因PCR扩增a.16S RNA; b.ropB基因; M.Marker
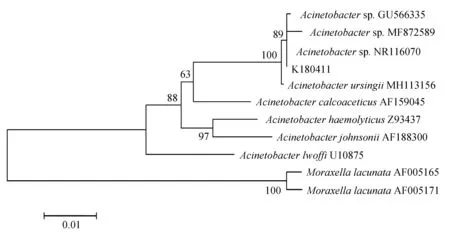
图3 菌株K180411的16S rRNA序列系统发育树
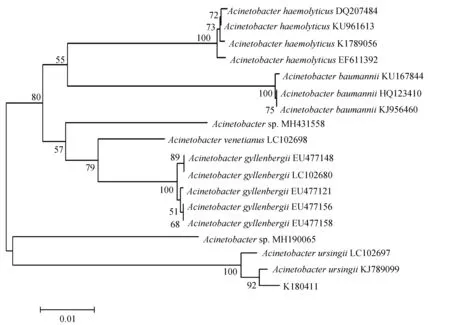
图4 菌株K180411的rpoB基因系统发育树
2.3 自然发病虹鳟的病理学检查与病理损伤研究
发病虹鳟精神沉郁,游动迟缓,漂浮于水面。体表出现大量的褪色斑(图5a),胸鳍基部及尾鳍基部肌肉出血明显,尾鳍腐烂严重,肉眼可见骨条(图5b);脾发黑肿大(图5c);肠道严重充血,肠壁组织炎症明显,呈半透明状(图5d)。显微镜下检查自然发病鱼类的鳃丝、黏液及溃疡灶组织,未见寄生虫和真菌。组织学观察发现鳃组织损伤明显,鳃小片上皮细胞肿胀脱落,甚至出现鳃小片断裂,暴露出鳃丝软骨(图5e);肠腔中可见坏死脱落的肠道组织,黏膜层结构大面积缺失,仅局部可见残余的肠绒毛,黏膜下层水肿、裸露,组织间隙增宽,结缔组织变性红染呈均质无结构状(图5f);肝细胞脂肪变性严重,局灶性坏死明显(图5g);脾窦内充满红细胞(图5h)。
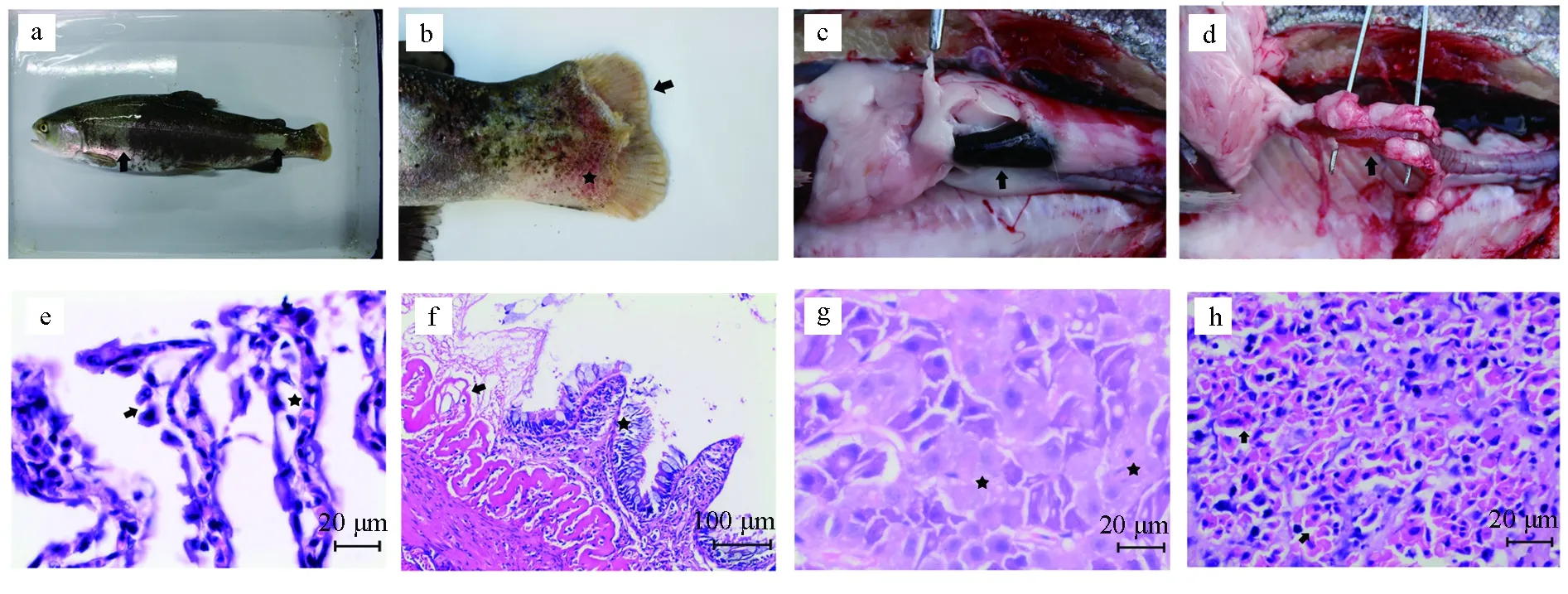
图5 自然发病虹鳟病理学检查与组织学研究a.病鱼体表出现褪色斑(箭头);b.尾鳍蛀蚀,尾柄处糜烂(箭头),基部充血(星标);c.脾发黑肿大(箭头);d.肠炎明显,肠组织充血,变薄呈半透明状(箭头);e.鳃小片上皮细胞肿胀脱落(箭头),组织间隙增宽(星标);f.柱状上皮细胞肿胀脱落(星标),肠绒毛断裂、黏膜下层裸露(箭头);g.肝细胞局灶性坏死(星标);h.脾窦充血,脾组织水肿(箭头).
2.4 药敏试验
药物敏感性试验结果表明(表3),乌尔新不动杆菌K180411对环丙沙星、头孢噻肟、左氧氟沙星、恩诺沙星及卡那霉素敏感,对磺胺异噁唑、链霉素、青霉素、阿莫西林、氨苄西林、氟苯尼考、多西环素耐药。
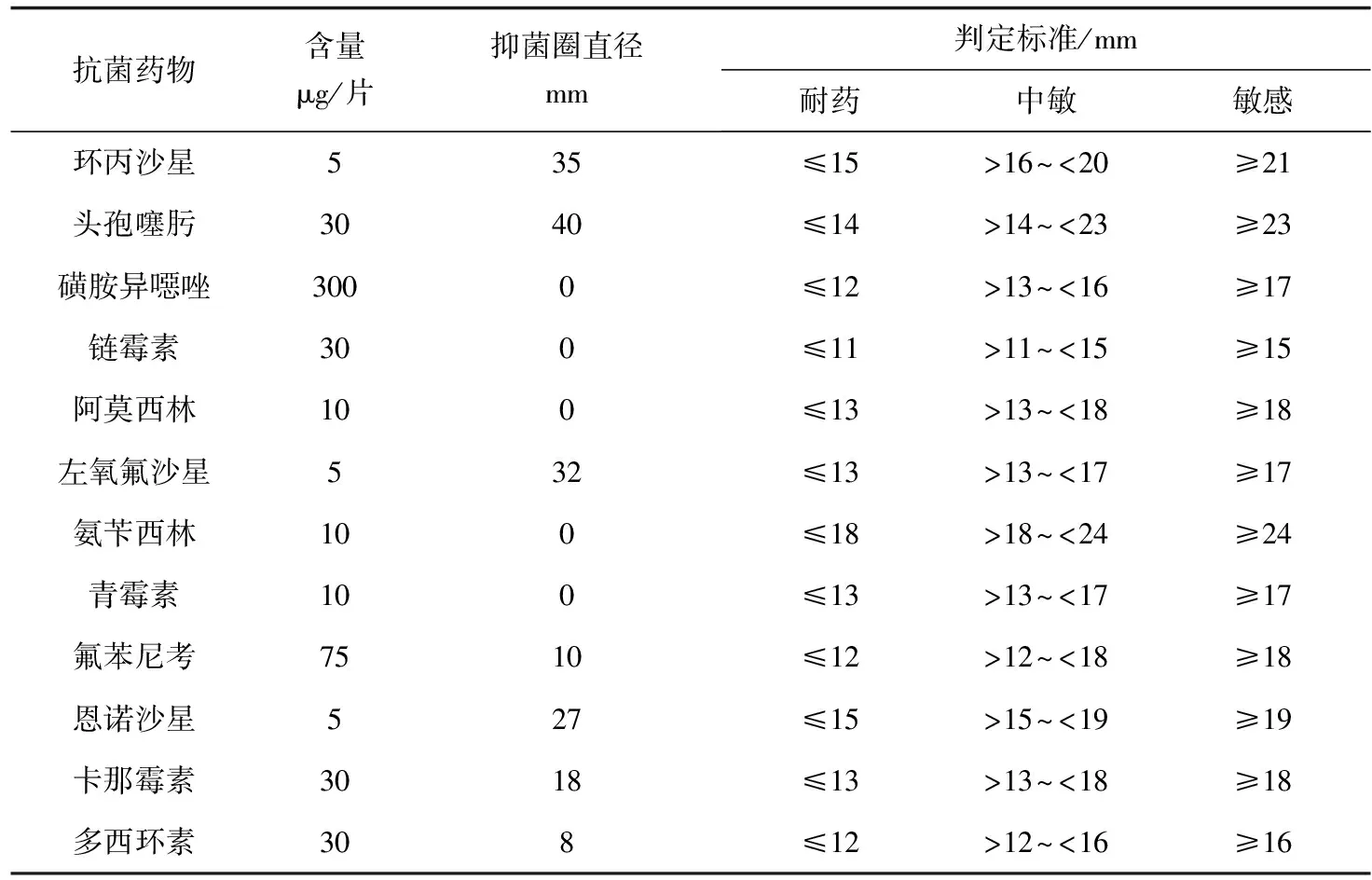
表3 乌尔新不动杆菌K180411药物敏感性试验结果
3 讨 论
不动杆菌是一大类的细菌种属,被报道的已超过50种,且种间的生化特性差异巨大[11],近几年在水产上研究与报道的均为鲍曼不动杆菌引起的疾病,而一些小众的不动杆菌感染却未有报道。目前人们常使用Vitek 2 system、API与Phoenix等方法通过表型的差别以进行不动杆菌种间的鉴别,但效果大多不能令人满意[12],甚至出现不动杆菌与产碱杆菌(Alcaligenesfaecalis)之间的混淆[1,13],因此分子手段的鉴别至关重要。16S rRNA的比对分析是目前分类鉴定常用的依据之一, Chiu等[1,14]的研究证明,16S rRNA的比对分析在属的层面上鉴定不动杆菌具有可靠的正确率,但由于过于保守而无法进行准确的种间鉴别[15],因此rpoB、gyrB与recA基因常被用作种间的鉴别,尤其是rpoB基因,因其高度的可变性,被学界推荐为不动杆菌种间鉴别最值得参考的基因[10,16-18]。本研究中,16S rRNA的系统发育分析显示,菌株K180411与未命名的不动杆菌NR116070的同缘关系最近。尽管菌株NR116070未被命名,但Alexandr Nemec等[19]认为,菌株NR116070应该被认定为乌尔新不动杆菌。rpoB基因的分析也表明,菌株K180411与已报道的乌尔新不动杆菌在一个谱系。因此,综合生化特性鉴定、16S rRNA及rpoB基因的系统发育分析结果,鉴定此次发病病原菌为一株乌尔新不动杆菌。根据资料显示,本研究为国内外首次对乌尔新不动杆菌引起水产动物感染发病的报道。另外,此次研究发现乌尔新不动杆菌K180411与文献[19]报道的乌尔新不动杆菌在溶血特性上有差别,说明在乌尔新不动杆菌种内也存在着理化性质的差异,这与Alexandr Nemec等[19]的研究结果一致。
研究表明,不动杆菌是健康三角帆蚌(Hyriopsiscumingii)与银鲫肠道中常驻的优势菌群[20],Omoloma等[21]也证实,在健康虹鳟肠道中不动杆菌是常驻菌之一。这说明当水生动物处于健康状态时,大多数不动杆菌不具致病性。其他领域的研究也发现,该菌的感染主要继发于外伤、慢性疾病或免疫系统受损之后[22]。回归试验的结果也表明,乌尔新不动杆菌K180411可在鱼体损伤之后引起发病,说明对水产养殖动物而言,体表损伤是该菌感染的一个重要途径,这可能与不动杆菌在外膜蛋白A等毒力因子的帮助下形成生物膜,增强了病菌的黏附力有关[23-25]。组织学研究发现,发病虹鳟肠道上皮组织大面积坏死脱落,鳃上皮组织严重损伤,并伴有肝组织弥漫性肿胀坏死,这与斑点叉尾(Ictaluruspunctatus)[26]感染不动杆菌后肝脏受到严重损伤的结果相符。但遗憾的是,在已报道的不动杆菌引起水产动物疾病的资料中,均只进行了临床症状的描述,而未作组织病理学的研究[3-4,27];因此,该病的发病机制与病理损伤过程尚需进一步的探索。
近几年,世界卫生组织纠正了以前对不动杆菌低毒力、低危害的认知,而将其认定为最危险的致病菌之一[28],因其具有复杂的耐药机制,如青霉素结合蛋白、泵出系统、氨基糖苷类修饰酶系统及膜通透性改变等,使之对大多数抗生素具有天然的抗性[29],且对很多敏感的药物也能够迅速的产生耐药性[30],导致治疗非常困难。本次药敏试验结果显示,恩诺沙星等药品对乌尔新不动杆菌K180411有效,但临床治疗期间,恩诺沙星的治疗效果并不理想,这可能与其复杂的耐药机制有关系。蔡香菊等[31]研究表明,黄芩、黄莲与五倍子等中草药及复方制剂对不动杆菌有较好的杀菌作用,或许中草药将会成为防治不动杆菌疾病的重要途径。

