青海省部分地区马铃薯Y病毒cp基因序列分析
程 亮
(1.青海省农林科学院 植物保护研究所,青海省农业有害生物综合治理重点实验室,青海 西宁 810016; 2.青海大学,省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
马铃薯在保障我国粮食安全,促进农业增效、农民增收、振兴农业经济方面具有重要意义[1]。青海省位于黄土高原和青藏高原交汇地带,生态类型复杂,海拔较高,气候冷凉,秋季雨多,作物生长周期长,日照充足,昼夜温差大,土壤疏松富含钾,无污染,有着适宜马铃薯生长的得天独厚的气候资源[2]。在马铃薯生长过程中,常受到多种病害的侵扰[3-4],其中,马铃薯Y病毒(Potato virus Y,PVY)是目前青海省感染马铃薯并造成最严重经济损失的病毒之一[5]。PVY是马铃薯Y病毒属(Potyvirus)的代表成员[6-7],其寄主范围十分广泛,自然条件下超过9个科包括茄科在内的14个属[8],能够引起马铃薯花叶、黄化、矮缩等病症,导致产量和品质下降。
马铃薯Y病毒的基因组全长约9.7 kb,是一种正义单链RNA病毒[9]。作为RNA病毒,PVY具有明显的株系分化现象,PVY株系原本有PVYO株系、PVYN株系和PVYC株系3种,又产生了PVYNTN株系[10-11]、PVYNW株系[12-13]、PVYN∶O株系[14]、PVYNA-NTN株系[15]、PVYZ株系[16]等新株系。关于对PVY新分离物株系检测,目前研究人员一般通过个别基因(和/或其编码产物)[17]或全基因组序列[18]的同源度比对结果来确定其株系类别,或通过血清型[19]、基因组重组与否[20]、马铃薯块茎坏死环斑病效应[21]、过敏反应互作基因[22]这些标准来确定其株系类别。鉴于PVY株系群体的复杂性,而上述PVY株系分类方法都无法完全区分所有PVY株系类别,存在这样或那样的缺陷[23]。近年来,随着测序技术的成熟,通过基因组差异区段的短序列测序来鉴定PVY株系是目前最接近基序测序分类法的思路,其中一个差异区段位于外壳蛋白产物中,外壳蛋白(coat protein,cp)是PVY10个重要的结构蛋白之一[24-25],由801个核苷酸组成,编码267个氨基酸。通过焦磷酸测序法进行短序列测序,从马铃薯病株上鉴定了一些PVY株系[26-27]。因此,cp基因序列分析在一定程度上对阐明PVY分类具有一定的参考作用。目前已报道的PVY在自然条件下极易发生基因重组或突变而产生具有不同致病力的新株系,而青海省的PVY株系的组成是什么,是否已经产生了新的株系,尚未见到系统的研究报道,因此,研究青海马铃薯Y病毒的株系类别有助于了解该病毒的变异类型和流行区域的形成。本研究以青海地区流行的马铃薯Y病毒的cp基因进行测序分析,研究其分子变异,有助于掌握该病毒的类型和分布,为制定PVY的综合防控策略提供理论依据。
1 材料与方法
1.1 材料
2016年5月—8月,在马铃薯生长期对青海省的马铃薯主产区进行田间调查,调查方法为随机取样,采集带有皱缩、重度花叶、黄化等明显症状的马铃薯叶片,新鲜样本置于密封袋中,保存于-80 ℃超低温冰箱。调查县区包括乐都、民和、互助、湟中、湟源、平安、大通和西宁(表1)。
1.2 试剂
Trizol、DEPC、TransScript First-Strand cDNA购于Sigma公司;DNA Marker、Gel Purification Kit购于天根生化科技(北京)有限公司;EcoRⅠ限制性内切酶购于Promega公司;RNase抑制剂、T4 DNA连接酶、琼脂糖凝胶回收试剂盒、pGM-T easy PCR产物克隆试剂盒、质粒小提试剂盒购于北京天为时代科技有限公司;引物由生工生物工程(上海)股份有限公司合成;其他化学试剂均为分析纯。
1.3 引物设计与合成
PVY的cp基因在不同的PVY株系中具有高度保守性,因此根据GenBank已公布的PVY常见株系cp基因的序列保守区,用DNAMAN软件进行引物设计,上游引物YCP1:5′-AACATAGGCTTGAGGCGA-3′;下游引物YCP2:5′-ATGACGAAATCACCCTGC-3′。引物由生工生物工程(上海)股份有限公司合成。
1.4 马铃薯总RNA的提取
按照Trizol(Invitrogen)试剂盒提取样品总RNA。提取试验的所有离心操作均在4 ℃下完成,用微量核酸测定仪(NanoDrop One)测定RNA浓度及纯度,用电泳法检测RNA完整性,然后-70 ℃超低温冰箱保存。
1.5 RT-PCR扩增PVY cp基因
1.5.1 cDNA第一链的合成
以感染PVY的马铃薯叶片总RNA为模板,逆转录反应体系为20 μL,取植物总RNA提取液3 μL(0.4 μg·样品-1),72 ℃变性后立即置于冰上,加入下述反应混合液:M-MLV RT-Buffer 4 μL,10 mmol·L-1dNTPs 4 μL,40 U·μL-1RNasin 1 μL,10 pmol·μL-1PVY下游引物1 μL,200 U·μL-1M-MLV反转录酶0.5 μL,DEPC处理水6.5 μL,混合后42 ℃保存1 h,95 ℃处理5 min。
表1 样品来源
Table1Sources of samples
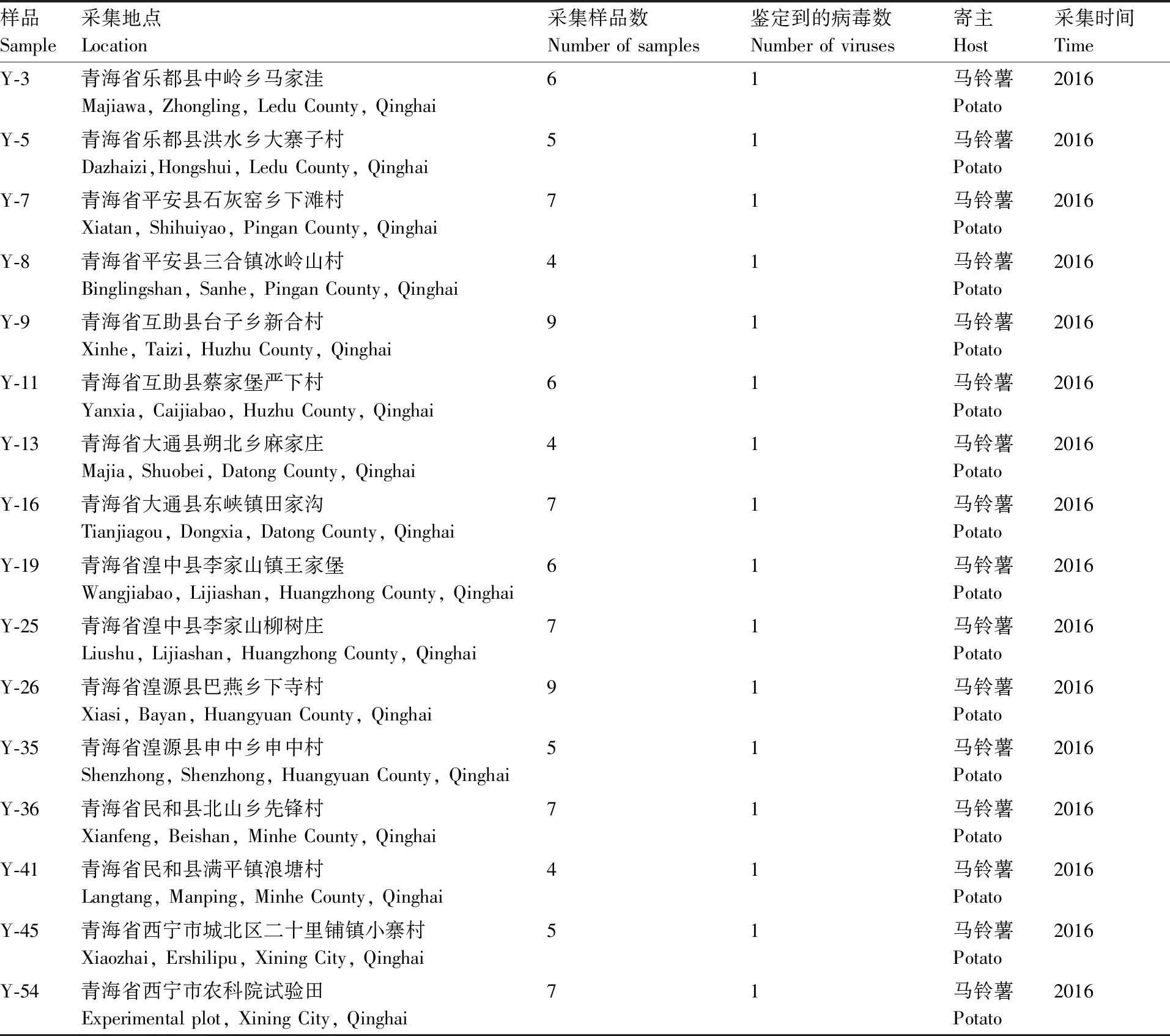
样品Sample采集地点Location采集样品数Number of samples 鉴定到的病毒数Number of viruses 寄主Host采集时间TimeY-3青海省乐都县中岭乡马家洼Majiawa, Zhongling, Ledu County, Qinghai61马铃薯Potato2016Y-5青海省乐都县洪水乡大寨子村Dazhaizi,Hongshui, Ledu County, Qinghai51马铃薯Potato2016Y-7青海省平安县石灰窑乡下滩村Xiatan, Shihuiyao, Pingan County, Qinghai71马铃薯Potato2016Y-8青海省平安县三合镇冰岭山村Binglingshan, Sanhe, Pingan County, Qinghai41马铃薯Potato2016Y-9青海省互助县台子乡新合村Xinhe, Taizi, Huzhu County, Qinghai91马铃薯Potato2016Y-11青海省互助县蔡家堡严下村Yanxia, Caijiabao, Huzhu County, Qinghai61马铃薯Potato2016Y-13青海省大通县朔北乡麻家庄Majia, Shuobei, Datong County, Qinghai41马铃薯Potato2016Y-16青海省大通县东峡镇田家沟Tianjiagou, Dongxia, Datong County, Qinghai71马铃薯Potato2016Y-19青海省湟中县李家山镇王家堡Wangjiabao, Lijiashan, Huangzhong County, Qinghai61马铃薯Potato2016Y-25青海省湟中县李家山柳树庄Liushu, Lijiashan, Huangzhong County, Qinghai71马铃薯Potato2016Y-26青海省湟源县巴燕乡下寺村Xiasi, Bayan, Huangyuan County, Qinghai91马铃薯Potato2016Y-35青海省湟源县申中乡申中村Shenzhong, Shenzhong, Huangyuan County, Qinghai51马铃薯Potato2016Y-36青海省民和县北山乡先锋村Xianfeng, Beishan, Minhe County, Qinghai71马铃薯Potato2016Y-41青海省民和县满平镇浪塘村Langtang, Manping, Minhe County, Qinghai41马铃薯Potato2016Y-45青海省西宁市城北区二十里铺镇小寨村Xiaozhai, Ershilipu, Xining City, Qinghai51马铃薯Potato2016Y-54青海省西宁市农科院试验田Experimental plot, Xining City, Qinghai71马铃薯Potato2016
1.5.2 RNA质量和马铃薯PVY病毒的RT-PCR检测
PCR反应扩增总体系为50 μL∶cDNA模板3 μL,10×PCR Buffer(Mg2+free)5 μL,10 mmol·L-1dNTPs 3 μL,25 mmol·μL-1MgCl22 μL,10 pmol·μL-1上下游引物各1 μL,Taq DNA聚合酶0.5 μL,ddH2O 34.5 μL。反应条件:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 5 min,4 ℃存放。
PCR产物用1%琼脂糖凝胶电泳进行检测。PCR产物纯化后克隆至pGM-T载体上,并转化至DH5α感受态细胞中。经菌落PCR鉴定获得阳性重组质粒,随机选择阳性克隆委托生工生物工程(上海)股份有限公司测序,并通过测序峰图及序列比对分析排除由PCR扩增引起的突变。
1.6 序列分析与同源性比对
获得的序列利用SDT及DNAMAN 8.0软件进行序列比对,获得序列一致率。从GenBank中选取已知株系的PVYcp基因序列作为参考,利用MEGA 6.0软件中的最大似然法(maximum likelihood,ML)对分离获得的分离物构建系统进化树,并分组。同时,利用重组分析软件RDP4.0进行重组分析。
2 结果与分析
2.1 cp基因的扩增与克隆
将表现花叶、皱缩、黄化等症状的叶片进行病毒总RNA的提取、扩增,1%的琼脂糖凝胶电泳结果显示,样品得到了特异PCR条带,阴性对照无扩增片段(图1)。测序结果表明,该条带大小为1 157 bp,与PVY的cp全序列预期结果一致,表明克隆的条带为马铃薯Y病毒(PVY)基因。该基因序列包括NIb部分核苷酸序列(1~281 bp)、cp基因核苷酸序列(282~1 082 bp)和3′-UTR苷酸(1 083~1 157 bp)。该目的基因的开放阅读框有801个核苷酸,编码一个由267个氨基酸组成的PVY外壳蛋白。
2.2 cp基因序列一致率分析
PVY病毒cp基因的PCR扩增产物经测序后,使用SDT和DANMAN软件将获得的16个PVY的cp基因序列和推导的氨基酸序列进行两两比对。结果表明,16个分离物的核苷酸一致率为98.0%~100%,氨基酸一致率为94.8%~100%。其中,Y5和Y36,以及Y8、Y19、Y25之间核苷酸和氨基酸一致率最高,均为100%。Y13与Y3、Y9、Y45、Y54核苷酸和氨基酸一致率最低,分别为98.0%和94.8%(图2)。16个分离物的核苷酸一致性很高,801个核苷酸中共有19个突变位点,其中Y-7、Y-11、Y-13、Y-16和Y-41分离物中,在第173处,碱基C变成了A,表示为g.173 C>A,依次类推,g.577 A>G、g.792 T>C。Y-25、Y-45、Y-54和Y-19分离物中g.105 T>C。从采集样品的区域来看,发生碱基突变的Y-7、Y-11、Y-13 、Y-16和Y-41的采集地分别是平安县石灰窑乡下滩村、互助县蔡家堡严下村、大通县朔北乡麻家庄、大通县东峡镇田家沟和民和县满平镇浪塘村。这说明青海省的PVY的分布有遗传因素的影响,来自于地域的自然环境的影响很小,没有规律可循。
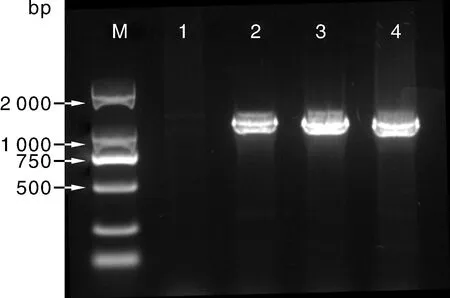
M,2 000 bp DNA marker;1,阴性对照;2~4,马铃薯分离物。M, 2 000 bp DNA marker; 1, Negative control; 2-4, Samples from potato.图1 PVY马铃薯分离物cp基因RT-PCR检测结果Fig.1 RT-PCR products of PVY cp gene amplified from potato leaf total RNA
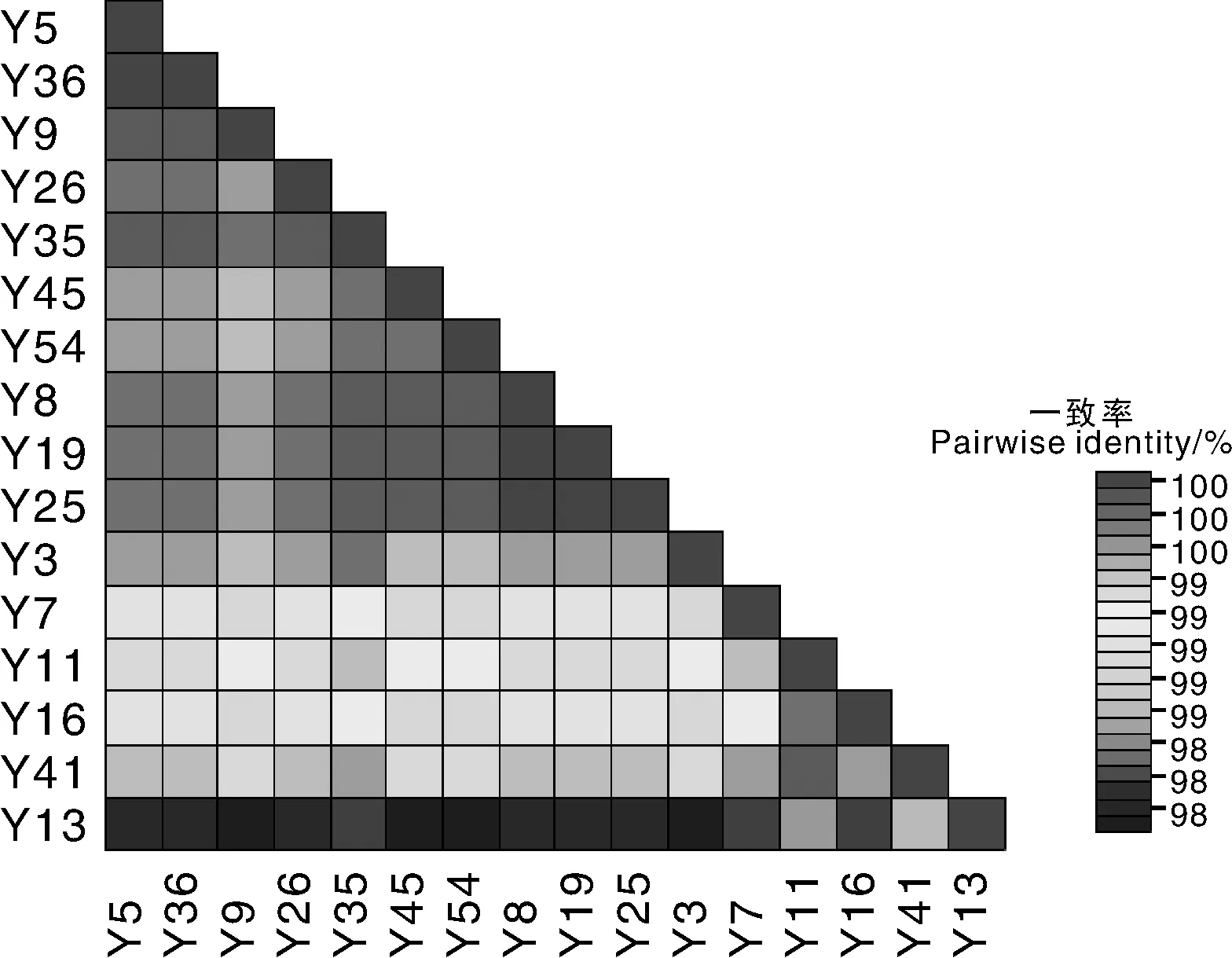
图2 十六个分离物核苷酸一致率分析Fig.2 Nucleotide sequence identity matrix generated from coat protein gene of 16 isolates
16个分离物的氨基酸相对比较保守,267个氨基酸共有9个突变位点,分别为第70位的酪氨酸Y突变为谷氨酸E,表示为Y70E,依次类推,S83N、R88K、T130K、G176E、V200I、N210D、S343Y和A357V,所有的核苷酸变异都是替换,不存在碱基插入/缺失现象。
2.3 cp基因的重组分析

图3 青海分离物cp基因潜在的重组事件Fig.3 Potential recombination events in cp gene of Qinghai isolate of PVY
通过RDP4.0软件的重组分析,结果发现,本研究获得的16个分离物中没有发现重组位点。但来自波兰的分离物AJ890343检测到2个重组位点,分别位于cp基因的594和792处(图3),该重组体亲本一个来源于本实验分离的Y13(作为主要亲本),另一个来源于GenBank中的加拿大Mb112(AY745491)分离物(作为次亲本)。RDP4软件中RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan这6种算法的平均P值分别为1.048×10-5、3.164×10-4、2.820×10-4、1.247×10-3、8.556×10-5和4.796×10-5。
2.4 cp基因的系统发育分析
将比对后的序列,使用ML法建立的系统发育树(图4),将GenBank中已知PVY分离物cp序列27个(表2)与本次实验中测定的PVY青海分离物16个cp序列一同构建进化树。分析结果表明,在系统进化树中,所有的序列可分为4个大的株系群,分别为PVYN-Wi株系群、PVYO株系群、PVYC株系群和PVYN株系群,其中,PVYN-Wi株系群中包含了来自于我省所测定样品的11个样品,分别是Y-19、Y-25、Y-8、Y-54、Y-45、Y-36、Y-35、Y-26、Y-9、Y-5和Y-3,占所测样品的68.7%。这11个PVY马铃薯分离物的cp与来自欧洲波兰的08-rol菌株(登录号:JF804783)和斯洛伐克的SL16菌株(登录号:KX713170 )PVYN-Wi株系遗传较近(表2)。另外的Y-7、Y-11、Y-16、Y-41和Y-13共5个分离物的cp属于PVYO株系群,其中前4个分离物与GQ20083相对较近,而Y-13与U05509相对较近,5个分离物占所测样品的31.3%,Y-7、Y-11、Y-16、Y-41这4个分离物虽然具有PVYO株系的分子特征,但在系统进化树中,它们与来自美洲的4个PVYO株系分离物也具有一定的距离,说明来自中国的PVYO株系具有明显的地域分子特征。而PVYC株系和PVYN株系群的样品则没有发现。青海省内不同县域的分离物地域间差异微小,同源性很高,说明PVY的种群基因较稳定。

图4 试验样品与各地样品的cp序列构建进化树Fig.4 Phylogenetic tree of cp sequences from the test samples and others
表2 各地的不同来源PVYcp基因序列
Table2PVYcpgene sequences from different sources around world
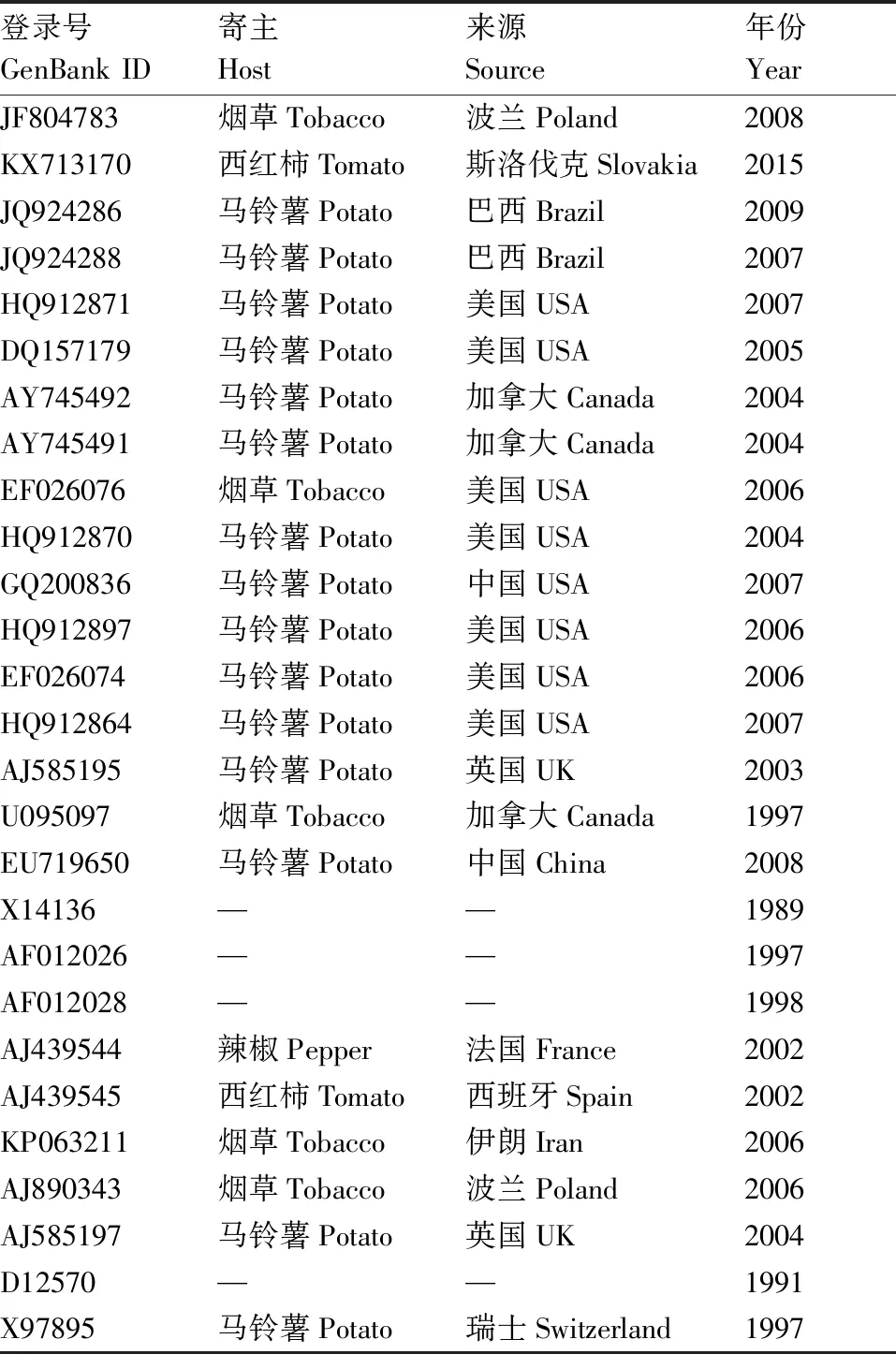
登录号GenBank ID寄主Host来源Source年份YearJF804783烟草Tobacco波兰Poland2008KX713170西红柿Tomato斯洛伐克Slovakia2015JQ924286马铃薯Potato巴西Brazil2009JQ924288马铃薯Potato巴西Brazil2007HQ912871马铃薯Potato美国USA2007DQ157179马铃薯Potato美国USA2005AY745492马铃薯Potato加拿大Canada2004AY745491马铃薯Potato加拿大Canada2004EF026076烟草Tobacco美国USA2006HQ912870马铃薯Potato美国USA2004GQ200836马铃薯Potato中国USA2007HQ912897马铃薯Potato美国USA2006EF026074马铃薯Potato美国USA2006HQ912864马铃薯Potato美国USA2007AJ585195马铃薯Potato英国UK2003U095097烟草Tobacco加拿大Canada1997EU719650马铃薯Potato中国China2008X14136——1989AF012026——1997AF012028——1998AJ439544辣椒Pepper法国France2002AJ439545西红柿Tomato西班牙Spain2002KP063211烟草Tobacco伊朗Iran2006AJ890343烟草Tobacco波兰Poland2006AJ585197马铃薯Potato英国UK2004D12570——1991X97895马铃薯Potato瑞士Switzerland1997
3 讨论
目前,马铃薯Y病毒是造成马铃薯减产和品质下降的主要病害之一,各地发生普遍且不同的地区生产条件和自然环境不同,导致植物的症状也有差别,从而对生产造成了严重的危害[3,28]。国内外学者利用植物病毒的保守区域对植物病毒进行株系鉴定等大量的研究,生产上采用血清学方法和单克隆抗体对马铃薯Y病毒株系进行检测的方法容易造成漏检,无法对株系进行准确鉴定[29-30],会对下一步工作造成影响。
以PCR为主要手段的分子检测能从核苷酸水平准确检测其基因型,这对快速掌握和防控PVY流行趋势具有一定的指导意义[26]。本研究设计的引物为扩增PVYcp基因全长序列,其能提供更多的分型位点,在一定程度上弥补血清学检测的不足。本试验对青海各地区的受PVY侵染的cp基因序列样品进行了RT-PCR扩增和测序。试验目的是检测青海省的马铃薯Y病毒是否存在有cp基因序列测序出现重组或突变的个体及群体,并通过与世界其他地区PVY的cp基因进行比对分析,进而对青海PVY种群的现状进行分子生物学评价。结果表明,本次扩增的样品的cp基因全长801 bp。利用SDT和DNAMAN软件对16个分离物的cp基因序列进行分析,发现cp核苷酸和氨基酸序列一致率较高,分别达到98%和94.8%以上,基因保守性高,这与大多数研究的结果相同[27]。
通过MAGA6.0对实验样品cp序列与GenBank中已知来自于国内外26个PVYcp基因序列进行进化分析发现,16个分离物中的基因区段有11个与PVYN-Wi株系较近,说明该基因在病毒的生存和繁殖中起着十分重要的作用。前人研究表明,在PVY全基因组上,PVYN∶O、PVYN-Wi株系和PVYO株系序列高度相似,只是在P1和HC-Pro重组了PVYN株系的序列[30],因此,图4中PVYN∶O和PVYN-Wi二者优先相聚成簇。虽然PVYcp基因高度保守,但不同地区分离物也存在一定的分子变异,16个 PVY 分离物共发现有26个碱基多态性位点发生突变。这些突变体都是通过核苷酸碱基置换形成的,没有出现序列插入或缺失现象,说明点突变在PVY进化中起着重要的作用。目前青海省的马铃薯田间PVY已经发生基因变异现象。
青海地区11个PVY马铃薯分离物与PVYN-Wi株系的亲缘关系最近,故而推断这11个分离物可能归属于PVYN-Wi株系,说明青海省的PVY群体可能以PVYN-Wi株系为主,高芳銮等[30]通过对福建省17个PVY分离物的检测鉴定,表明PVY在马铃薯主要种植区普遍发生的多为重组株系。这和笔者的观点相似。但由于PVY株系分化严重,重组频繁,单独使用cp基因序列为分子标记进行系统发育分析,可能无法对PVY全部株系种类进行准确鉴定,应该开展多基因联合方法鉴定。笔者联合P1和cp基因,以及多重PCR等多种方法进一步验证后,得到了与本文基本一致的系统发育分析结果(未发表数据)。16个样品PVY分离物多为PVYN-Wi株系,重组株系被认为可能比非重组株系具有更强的致病力[31],并已在世界各马铃薯种植区越来越流行,因此,生产上需要密切关注这些重组株系的发展动态。5个来自青海的PVY的cp与来自中国GQ200836(O)同属于有发生重组的PVYO株系。虽然青海省大部分PVY有可能是随着国外品种资源的引进进入,同时PVY也随着国内不同区域间的资源交流和种薯调运发生了重组,但仍然有约30%的株系没有发生重组变异,这些没有变异的株系以PVYO株系为主。在本实验中未发现PVYC株系、PVYN株系、PVYE株系和PVYNTN株系。但由于可供分析的分离物样品数量有限,不排除有PVY的其他株系的存在。或者通过种薯的区域间的相互调运,不排除未来其他重组株系的发生。因此,青海马铃薯PVY重组株系的发展趋势值得关注。

