太湖沉水植物附生藻类群落对水盾草入侵能力的影响
朱 宏,周婷婷,李 欣,阮宏华,谢 冬,*
(1.南京林业大学 南方现代林业协同创新中心,江苏 南京 210037; 2.苏州市湿地保护管理站,江苏 苏州 215000)
外来沉水植物的生物入侵已成为淡水湖泊生态系统日益严重的生态问题。外来沉水植物的入侵不仅会降低生境中乡土植物的存活率和多样性,影响种群分布,还会导致湖泊生态系统的生态功能退化[1]。水盾草(CabombacarolinianaA. Gray)是原生于北美和南美的多年生沉水植物,在澳大利亚、加拿大、欧洲和东亚等多个国家和地区入侵、泛滥[2-4]。自20世纪90年代以来,水盾草在我国江苏太湖流域、浙江杭嘉湖平原、宁绍平原等东部地区水体严重泛滥,并威胁当地湖泊生态系统的生态安全。根据报道,水盾草种群在太湖东部水体中呈季节性动态变化,即秋冬季易发展成为优势种;此时水体中其他沉水植物已逐渐死亡,有利于水盾草入侵形成单一群落[5]。根据“生物抵抗力假说”,当乡土物种占据更多生态位时,外来物种入侵群落的可能性减小[6]。在淡水生态系统中也发现,在乡土植物密度较高和生长速度较快的情况下,能够消耗更多资源并使生态系统可入侵性降低[7]。由于外来种入侵必须克服局部生物抵抗力,乡土群落内物种可通过直接竞争、捕食或病菌感染等作用抵御外来种,降低其入侵性[8]。
种间竞争是生物抵抗力的重要组成部分,有研究发现,乡土水生植物通过竞争阻碍外来水生植物的入侵[9]。在浅水湖泊生态系统中,附生群落与沉水植物对光照和营养的竞争也十分激烈,附生群落中的藻类通过遮荫等途径阻碍沉水植物的生长造成其生物量下降,甚至群落的消亡[10]。沉水植物附着的附生群落往往有结构和物种组成上的差异[11-12]。当外来种沉水植物进入新生境时,不可避免地会与生境中的藻类接触,从而产生新的附生群落;这种新的附生群落可能由原来附着于乡土沉水植物的藻类组成,也可能是由新的藻类种类组成。而新附生的藻类群落能否抵抗外来入侵沉水植物的生长,相较于乡土沉水植物表面附生的藻类群落其抵抗效果如何?对于这些问题的研究,对深入了解附生藻类群落与入侵沉水植物之间的相互作用及其作用机理具有重要意义,同时可为治理入侵沉水植物提供理论支撑。
1 材料与方法
1.1 材料
本试验所使用的水生植物材料于2017年11月采自江苏苏州太湖湖滨国家湿地公园附近水陆交错带(31°13′6.88″N,120°25′57.84″E)。采集后当天带回国家林业和草原局江苏太湖湿地生态系统国家定位观测研究站实验室(31°01′37.46″N,120°17′47.79″E)进行下一步处理。选取40条无侧芽不定根的水盾草断枝作为试验材料,将其切至15 cm长[鲜质量(2.52 ± 0.69) g],清除附着的附生藻类群落后放置于装有20 L蒸馏水的水缸中直至试验开始。附生藻类群落材料取自同一样地内的水盾草和穗状狐尾藻(MyriophyllumspicatumL.,同为优势种,但穗状狐尾藻处于生长末期)表面。将2种沉水植物去掉残片后分别用软毛刷在蒸馏水中刷洗以收集附生藻类试验样品。收集好的附生藻类样品经筛(500 μm)过滤除去底栖动物和杂质后,分别储存在装有1 L蒸馏水的烧杯中(15 ℃,自然光)。为设置不同附生藻类处理,收集的2种附生藻类分别被稀释至相近藻类密度(水盾草附生藻类群落75.36 μg·L-1,穗状狐尾藻附生藻类群落69.42 μg·L-1,藻群密度以叶绿素a含量计),并按体积比1∶1混合后得到混合附生藻类群落(叶绿素a含量71.23 μg·L-1)。
1.2 方法
试验开始前,将透析袋(MD77,相对分子质量12 000~14 000,Leibusi,USA)裁剪成长25 cm,约300 mL的片段,煮沸并冲洗1 h后静置在蒸馏水中,用于培养断枝与附生藻液。由于透析袋的孔径只允许营养盐透过,可有效防止培养的藻类与植物断枝外溢[13]。
在每个透析袋中放置1根水盾草断枝,并加入250 mL藻液后封口。将密封好的透析袋放置于塑料盒(长×宽×高为0.4 m× 0.25 m × 0.2 m)中,加入15 L模拟太湖水体营养状况的营养液(含140 μg·L-1的磷酸氢二钠和270 μg·L-1的硝酸钠)。随后放置于恒温光照培养箱中培养。本试验共设置4个处理:处理1为对照组,水盾草断枝加入蒸馏水;处理2为入侵沉水植物附生藻类群落,即水盾草断枝加入从水盾草获取的附生藻类溶液;处理3为乡土沉水植物附生藻类群落,即为水盾草断枝加入从穗状狐尾藻获取的附生藻类溶液;处理4为混合附生藻类群落,为水盾草断枝加入混合附生藻类溶液。每个处理均设置10个重复。试验持续时间为4周(2017年11月20日至2017年12月18日),试验过程中恒温光照培养箱设置为温度15 ℃,光照强度4 000 lx(光/暗比为12 h/12 h)。试验期间,每天添加蒸馏水以保持盒中水量,并在第3周(12月4日)更换营养液以保持水体营养状况与初始时近似。
试验结束后,将水盾草断枝用软毛刷在50 mL蒸馏水中清洗,收集附生藻类群落。随后断枝被分为主干、侧枝和根3部分,分别称量其鲜质量,然后放入烘箱60 ℃烘干72 h 后再次称量。计算断枝的生物量相对生长速率(RGR)和长度相对生长速率。公式如下:
生物量相对生长速率=[ln(最终干质量)-ln (初始干质量]/试验周期;
长度相对生长速率=[ln(最终长度)-ln (初始长度)]/试验周期。
记录每个断枝的侧枝数量、侧枝总长度和不定根数量、不定根总长度作为衡量水盾草再生和定殖能力的指标。再依据《中国淡水藻类》的方法进行附生藻类的种类鉴定和计数(血球计数法)。并依据附生藻数量和水盾草断枝鲜质量比计算每个断枝的附生藻群落密度(105g-1)。
1.3 数据处理
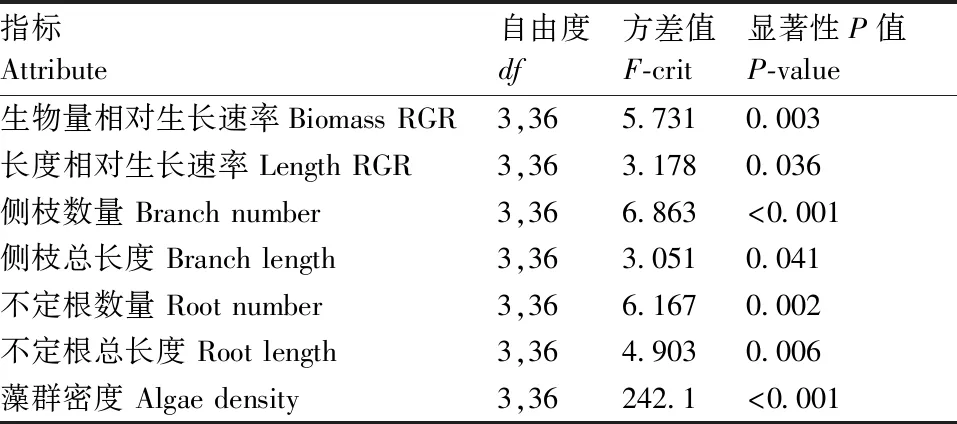
利用Statistica 13.3统计软件进行试验数据的分析,用Excel for Office 365作图。所有的藻类(藻群密度、组成比例)与植物指标(相对生长速率、侧枝数量、总长和不定根数量及其总长)均使用单因素方差分析(one-way ANOVA),各处理间差异采用Tukey’s post hoc 统计检验,α=0.05。试验数据均为平均值±标准误。
2 结果与分析
2.1 水盾草附生藻类群落组成、组成比例与密度
通过对水盾草附生群落的细胞计数和种类鉴定,在显微镜下共观察到36属藻类,具体种类组成、各门比例和优势种属如表1和表2所示。处理3的附生藻类有29属(蓝藻门7属、硅藻门10属、绿藻门9属、隐藻门2属和裸藻门1属),其中,部分优势种属如平裂藻属在处理1、2和4组中并未出现。处理2组附生藻类有31属(蓝藻门5属、硅藻门10属、绿藻门13属、隐藻门2属和裸藻门1属),部分优势种属如盘星藻属在处理1和3组中并未出现。处理4组中附生藻类有26属(蓝藻门4属、硅藻门10属、绿藻门10属、隐藻门1属和裸藻门1属),部分优势种属如鱼腥藻属在处理1、2和3组中并未出现。不同附生群落处理对水盾草附生藻类各门比例均有显著影响。处理2组蓝藻门的比例(44.90%)显著高于处理3(31.43%),但硅藻门比例(28.40%)显著显低于处理3(41.94%)。各处理对附生藻类生物多样性并无显著影响。
不同附生藻类群落处理对水盾草的附生藻群落密度有显著影响(图1)。试验结束后,4个处理的附生藻群落密度均有显著差异,其中,处理2的附生藻群落密度最高(384.09×105g-1),处理4次之,对照组最低(27.58×105g-1)(图1)。
2.2 水盾草生物量相对生长速率和长度相对生长速率
不同附生藻类群落处理对水盾草生物量和长度相对生长速率有显著影响(表 3)。对照组和处理2中水盾草的相对生长速率无显著差异(图2-A),但仅有处理2组的生物量为正生长。
表1 不同附生藻群处理下水盾草附生藻类的组成比例

Table 1 Community composition proportion of epiphytic algae on C. caroliniana under different epiphytic algae treatments %
同列数据后无相同字母表示差异显著(P<0.05)。1,对照组;2,入侵沉水植物附生藻类群落;3,乡土沉水植物附生藻类群落;4,混合附生藻类群落。
Data marked without the same lowercase letter in each column indicated significant differences atP<0.05. 1, Control group; 2, Epiphytic algae from invasive species; 3, Epiphytic algae from native species; 4, Mixed epiphytic algae.
表2 不同附生藻类处理条件下水盾草附生藻类的群落组成
Table2Community composition of epiphytic algae onC.carolinianaunder different epiphytic algae treatments

门Phylum属Genus1234蓝藻门Cyanophyta颤藻属Oscillatoria sp.+++++席藻属Phormidium sp.-+++平裂藻属Merismopedia sp.--++-伪鱼腥藻属Pseudoanabaena sp.++++-鱼腥藻属Anabaena sp.---++微囊藻属Microcystis sp.+++++-色球藻属 Chroococcus sp.+++++泽丝藻属 Limnothrix sp.--+-硅藻门Bacillariophyta脆杆藻属 Fragilaria sp.-++-小环藻属 Cyclotella sp.++++针杆藻属Synedra sp.-+++直链藻属Melosira sp.++++++舟形藻属Navicula sp.++++++桥弯藻属 Cymbella sp.++++异极藻属 Gomphonema sp.-+++曲壳藻属 Achnanthes sp.-+++卵形藻属 Cocconeis sp.-+++等片藻属 Diatoma sp.-+-+双楔藻属 Didymosphenia sp.--++绿藻门 Chlorophyta鼓藻属 Cosmarium sp.+++++角星鼓藻属 Staurastrum sp.++++卵囊藻 Oocystis sp.++++盘星藻属Pediastrum sp.-++-+四角藻属 Tetraedrom sp.++++十字藻属 Crucigenia sp.--+-栅藻属 Scenedesmus sp.+++++小球藻属 Chlorella sp.-+--纤维藻属 Ankistrodesmus sp.+++++鞘藻属 Oedocladium sp.++++衣藻属 Chlamydomonas sp.-+--空星藻属 Coelastrum sp.-+--胶网藻属 Dictyosphaerium sp.-+++转板藻属 Mougeotia sp.-+-+裸藻门 Euglenophyta裸藻属 Euglena sp.++++隐藻门 Cryptophyta蓝隐藻属 Chroomonas sp.++++++隐藻属 Cryptomonas sp.-++-
“-”,未出现;“+”,出现;“++”,优势种。1,对照组;2,入侵沉水植物附生藻类群落;3,乡土沉水植物附生藻类群落;4,混合附生藻类群落。
“-”, Absent; “+”, Present; “++”, Dominant. 1, Control group; 2, Epiphytic algae from invasive species; 3, Epiphytic algae from native species; 4, Mixed epiphytic algae.
表3 水盾草生长及其附生藻密度影响单因素方差分析
Table3One-way ANOVA F andPvalue of epiphytic algae treatment for growth attributes and epiphytic algae density ofC.caroliniana
指标Attribute自由度df方差值F-crit显著性P值P-value生物量相对生长速率Biomass RGR3,365.7310.003长度相对生长速率 Length RGR3,363.1780.036侧枝数量 Branch number3,366.863<0.001侧枝总长度 Branch length3,363.0510.041不定根数量 Root number3,366.1670.002不定根总长度 Root length3,364.9030.006藻群密度 Algae density3,36242.1<0.001
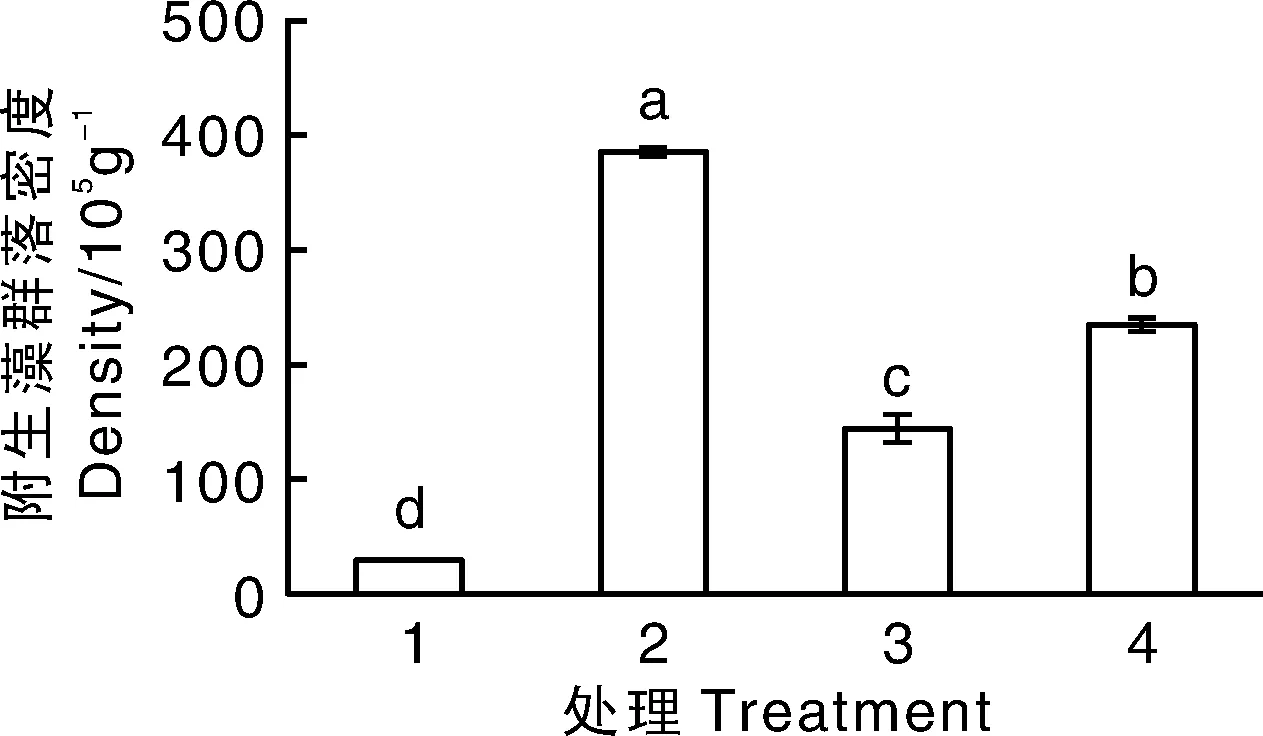
柱状图上无相同小写字母的表示处理间差异显著(P<0.05)。1,对照组;2,入侵沉水植物附生藻类群落;3,乡土沉水植物附生藻类群落;4,混合附生藻类群落。下同。Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The data are presented as the mean ± SE (n=10). 1, Control group; 2, Epiphytic algae from invasive species; 3, Epiphytic algae from native species; 4, Mixed epiphytic algae. The same as below.图1 不同附生群落处理对水盾草断枝附生群落密度的影响Fig.1 Effects of epiphytic algae treatment on epiphytic algae density of C. caroliniana fragments
处理2中生物量显著高于处理3(图2),长度相对生长速率与处理4组无显著差异(图2-B)。
2.3 水盾草定殖和再生能力
各处理中水盾草都有高再生速率,即萌发侧枝,为期4周的试验期间所有断枝的总再生率为82.5%。且不同附生藻类群落处理对水盾草的再生和拓殖能力均有显著影响(图3)。除侧枝总长度外,处理2组的侧枝数量、不定根数量和不定根总长度均显著高于其余3个处理组(图3)。水盾草的侧枝总长度在处理2组和处理3组中无显著差异,但处理2组明显高于对照组(处理1)和处理4组(图3-D)。
3 讨论
不同附生群落与水生植物间往往有特定的相互作用,该相互作用取决于附生群落的组成和宿主植物物种[15]。本研究中各处理附生群落中的藻类群落组成和比例呈现出差异,水盾草表面附生藻类群落以蓝藻门为主,且以颤藻属、伪鱼腥藻属、微囊藻属为优势种属,这与之前的研究相吻合[16]。乡土沉水植物表面的附生藻类群落以硅藻门为主,其中,直链藻属和舟形藻属为优势种属。本试验中乡土沉水植物附生藻类群落在短期内降低了入侵种沉水植物的生长速度和拓殖能力,表现出了生物抵抗作用;同时,混合附生群落在一定程度上也表现出对水盾草断枝生长的抑制作用。但附生藻类群落的结构组成随着季节和环境因素而变化,且在冬季随着乡土种穗状狐尾藻的消亡,附生藻类群落随之消亡,从而失去对入侵种的抵抗作用[17]。
不同附生藻类群落处理组的附生藻密度也不同。本试验中细胞总数较好地表征了附生群落中藻类的生长状况和密度。在浅水湖泊生态系统中,密集的附生藻类群落是阻碍沉水植物生长的首要因素,其遮荫作用是沉水植被减少的主要原因之一,同时也可能为外来沉水植物生物入侵提供了一定的契机[18]。以往研究中,附生藻类群落对沉水植物遮荫而导致的负面影响通常与附生藻类群落的密度呈负相关[10],但在该短期试验中并未呈现出此规律。本试验结果显示,尽管外来沉水植物附生藻类群落处理中水盾草表面的附生藻密度远高于其他3个处理,但水盾草断枝的生物量相对生长速率和拓殖能力并未受到高密度附生藻的抑制。水盾草在高密度附生藻类群落中有仍有较高的生长速度和拓殖能力,但在密度较低的乡土附生群落中呈现出相反趋势,表明外来沉水植物表面附生的藻类群落对水盾草无抑制作用。这可能是由于入侵植物在进入新的群落后,由于其逃逸了原来生境中的天敌,使得其能将较多的资源由防御分配到生长中所致[19]。更深层次的原因还需进一步研究验证。此外,沉水植物可以通过增加侧枝的萌发数量以响应光衰减胁迫,附生群落引起的遮荫也能引起类似响应[20]。当沉水植物尤其是入侵种面临各类型胁迫如牧食、营养和机械胁迫时,会通过增加补偿生长和再生能力以应对胁迫[21-22]。本试验中水盾草断枝也呈现出相似的响应机制来应对高密度的附生群落。
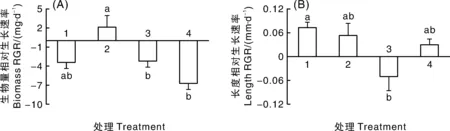
图2 不同附生群落处理对水盾草断枝相对生长速率的影响Fig.2 Effects of epiphytic algae treatment on relative growth rates of C. caroliniana fragments
萌生侧芽和不定根是断枝进入新生境后定植并建群的必要条件[23]。而断枝等无性繁殖体是水盾草传播和繁殖的主要途径[24]。漂浮的水盾草断枝可在1周内萌发侧枝,栽培于基质中的断枝可在48 h内生根并随后萌发出侧枝,且任何有节的断枝都可以发展成新的植物个体[25],这些特性增加了水盾草的入侵成功率。相较于接种入侵种表面附生群落的断枝,接种了本土沉水植物表面附生群落的水盾草萌发出的侧枝、不定根数量和不定根长度显著降低,且混合附生群落呈现出相似的趋势。在入侵沉水植物附生藻类群落处理中,水盾草断枝萌发出更多侧芽,不仅可以减轻附生藻类群落对其遮荫的负面影响,侧芽也是潜在的高传播能力的无性繁殖体,侧芽数量的增多进一步增加了水盾草在新生境定植和入侵的成功率[26-27]。相较于入侵沉水植物附生藻类群落处理,本土沉水植物表面附生藻类处理的水盾草断枝萌发的不定根数量、长度和侧枝数量分别降低了约53%、62%和44%,混合附生藻类群落处理的水盾草断枝萌发的不定根数量、长度和侧枝数量分别降低了约67%、75%和60%。表明本土沉水植物表面附生藻类群落则可以显著削弱水盾草的生长和拓殖能力,而且乡土附生藻类群落无论是单独还是与入侵种附生藻类群落共同存在,均可在一定程度上抵御水盾草的入侵。
近年来,对沉水植物入侵机理的研究逐渐增多,而附生群落和沉水植物的相互作用也被认为可能是影响乡土种与入侵种沉水植物竞争的关键因素[28]。本文比较了冬季太湖流域入侵种沉水植物水盾草断枝在不同附生藻类群落处理中的附生藻群密度、群落组成和生长拓殖能力。发现水盾草对不同附生群落的响应有差异,且其相对生长速率和拓殖能力对乡土种所附着的附生藻类群落有着消极响应,说明在乡土种表面附生的藻类群落中存在一些藻类起着抑制水盾草生长与拓殖的作用。当乡土种在冬季死亡时其附生藻类随之消亡[5],丧失了对水盾草入侵的抵抗作用。水盾草断枝对自身附生藻类群落的积极响应促进了其拓殖,为其在冬季乡土沉水植物消亡后的入侵提供了有利条件。本文在一定程度上解释了水盾草在秋冬季节容易发展成为单一群落的影响因素,对该物种的防控有指导作用。

