高表达hoxb4转基因斑马鱼胚胎定向造血阶段cdh5-mRNA的表达
吴西军, 姚冬静, 刘庆, 杨小燕, 王念雪, 王一慧, 舒莉萍, 何志旭**
(1.贵州医科大学 组织工程与干细胞实验中心, 贵州 贵阳 550004; 2.贵州医科大学 免疫学教研室, 贵州 贵阳 550004; 3.河北省人民医院 儿科, 河北 石家庄 050057; 4.贵州医科大学附院 呼吸与危重症医学科, 贵州 贵阳 550004; 5.贵州医科大学附院 儿童血液肿瘤科, 贵州 贵阳 550004)
造血干细胞移植 (hematopoietic stem cell transplantation,HSCT)是一些难治性疾病、特别是血液系统恶性疾病的首选治疗方法,由于HSCT治疗需要相当数量的细胞,因此研究造血干细胞 (hematopoietic stem cell,HSC) 的自我更新、增殖、分化的机制,以解决HSC来源不足的问题显得尤为重要。斑马鱼的造血过程和哺乳动物一样高度保守,可分为原始造血和定向造血,随着胚胎的发育,原始造血进入以主动脉-性腺-中肾(aorta-gonad-mesonephros,AGM)区和前肾为标志的定向造血,最早的定向HSC在此出现[1-3]。在体外高表达hoxb4可以增强胚胎干细胞(embryonic stem cell,ESC)的造血潜能,并且能促进ESC向粒系、单核、巨核系集落生成细胞和红系集落分化[4]。有研究显示,骨髓细胞在导入hoxb4基因后,HSC扩增能力大大增强,与对照组比较可以达50倍以上,并且这种扩增不伴随外周血细胞形态和比例的改变及功能的异常[5-6]。本课题组前期建立了在原始造血阶段可以时空和组织特异性高表达的、稳定的、可示踪的hoxb4转基因斑马鱼系,且斑马鱼胚胎尾部动静脉血管网处可见血流缓慢,甚至瘀滞成团的现象[7-9],基于这些前期研究结果,考虑作为血管内皮黏附分子的cdh5可能参与了hoxb4引起的HSC的增殖过程,故本研究以hoxb4基因高表达的转基因斑马鱼为模型,研究hoxb4基因高表达时cdh5基因在定向造血阶段表达的时空变化,现将结果报道如下。
1 材料与方法
1.1 主要材料
1.1.1实验动物 实验动物包括野生型(wild type,WT)斑马鱼系(shanghai),增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)转基因斑马鱼系(TG∶zLmo2-LDeL-EGFP),hoxb4转基因斑马鱼系(TG∶zLmo2-LDeL-hoxb4-EGFP)和转基因工具鱼斑马鱼系(TG:zLmo2-Cre)。转基因斑马鱼品系由lmo2启动子驱动,可特异性识别,条件性进行剪切,使hoxb4-EGFP或者EGFP得以表达,WT及转基因品系斑马鱼均由细胞工程生物医药技术国家地方联合工程实验室繁育[7]。饲养方法:28 ℃循环系统饲养,每天光照与黑暗各半, 雌雄比1 ∶2交配,收集受精卵于28 ℃胚胎孵化液中,每天半换液,5~7 d后开始喂食草履虫。
1.1.2主要试剂与仪器pCS2+-cdh5重组质粒由细胞工程生物医药技术国家地方联合工程实验室构建并鉴定,限制性内切酶购自加拿大Fermentas公司,地高辛RNA标记及检测试剂盒和NucAwayTM SPin Columns购自美国Ambion公司,质粒小抽试剂盒购自美国Axygen公司,DNA凝胶回收试剂盒购自上海申能生物公司,5-溴-4-氯-3-吲哚基-磷酸盐/硝基四氮唑蓝碱性磷酸酯酶显色试剂盒购自美国VECTOR Lab 公司,体视显微镜及正置显微镜购自日本尼康公司。
1.2 方法
1.2.1制备cdh5反义mRNA探针 用限制性内切酶EcoRⅠ将pCS2+-cdh5重组质粒线性化,琼脂糖凝胶电泳鉴定并割胶回收;以线性化的质粒为模板,加入地高辛标记的寡核苷酸,T7 RNA聚合酶进行体外转录;转录产物经NucAwayTM Spin Columns纯化吸附柱回收后,得到cdh5基因反义mRNA探针,探针经2%琼脂糖凝胶电泳进行定性分析,分装后-70 ℃保存。
1.2.2斑马鱼定向造血阶段胚胎全胚胎原位杂交和测定 实验分为WT对照组、EGFP对照组、高表达hoxb4实验组,各组收集发育至32、36、40、44、48 hpf(hours post-fertilization)斑马鱼胚胎各30枚;4%多聚甲醛固定,4 ℃轻摇过夜,经脱水、再水化、蛋白酶K处理及胚胎再固定处理;68 ℃预杂交15 min,加入地高辛标记的cdh5反义mRNA探针,杂交炉中过夜;去除探针洗涤3次,30 min/次;封闭非特异性位点,加抗地高辛抗体,4 ℃轻摇过夜;加入NBT/BCIP染液染色,4%多聚甲醛固定,4 ℃保存过夜,体视显微镜拍照。选用同批次同光源强度下摄像的10个胚胎的图像,应用软件Leica Qwin Plus测量灰度值。
1.3 统计学分析

2 结果
2.1 cdh5基因32 hpf原位杂交检测
3组杂交胚胎均可观察到cdh5-mRNA在造血组织AGM区、尾部血岛(posterior blood island,PBI)有明显的表达信号,见图1A;在AGM区,hoxb4实验组cdh5-mRNA的表达较EGFP对照组增加,差异有统计学意义(P<0.05),但EGFP对照组与WT对照组差异无统计学意义(P>0.05),见图1B;在PBI区,hoxb4实验组cdh5-mRNA的表达较EGFP对照组增加,差异有统计学意义(P<0.05),但EGFP对照组与WT对照组差异无统计学意义(P>0.05),见图1C。

注:A为cdh5-mRNA全胚胎原位杂交结果(32 hpf,蓝色箭头表示AGM区,绿色箭头表示PBI区),B为3组胚胎32 hpf-AGM区的灰度值比较,C为3组胚胎32 hpf-PBI区的灰度值比较;(1) 与WT对照组比较,P<0.05;(2)与EGFP对照组比较,P<0.05。图1 3组斑马鱼胚胎32 hpf 时cdh5-mRNA的表达Fig.1 The effect of hoxb4 overexpression on the expression of cdh5-mRNA in 32 hpf zebrafish embryos by whole mount in situ hybridization in three different types
2.2 cdh5基因36 hpf原位杂交检测
结果显示,3组胚胎均可见cdh5-mRNA在造血组织AGM区和PBI区均有较高表达,见图2A;在AGM区,hoxb4实验组cdh5-mRNA的表达分别较EGFP对照组和WT对照组增加,差异均有统计学意义(P<0.05),但EGFP对照组与WT对照组比较,差异无统计学意义(P>0.05),见图2B;在PBI区,hoxb4实验组cdh5-mRNA的表达分别较EGFP对照组和WT对照组增加,差异均有统计学意义(P<0.05),但EGFP对照组与WT对照组比较,差异无统计学意义(P>0.05),见图2C。

注:A为cdh5-mRNA全胚胎原位杂交结果(36 hpf,蓝色箭头表示AGM区,绿色箭头表示PBI区),B为3组胚胎36 hpf-AGM区的灰度值比较,C为3组胚胎36 hpf-PBI区的灰度值比较;(1) 与WT对照组比较,P<0.05;(2)与EGFP对照组比较,P<0.05。图2 3组斑马鱼胚胎36 hpf时cdh5-mRNA的表达Fig.2 The effect of hoxb4 overexpression on cdh5-mRNA expression in 36 hpf zebrafish embryos by whole mount in situ hybridization
2.3 cdh5基因40 hpf原位杂交检测
结果显示,3组胚胎均可见cdh5-mRNA在造血组织PBI区(绿色箭头指示)有表达,见图3A;hoxb4实验组cdh5-mRNA的表达分别较EGFP对照组及WT对照组增加,差异均有统计学意义(P<0.05);EGFP对照组与WT对照组之间的差异无统计学意义(P>0.05),见图3B。
2.4 cdh5基因44 hpf原位杂交检测
结果显示,3组胚胎均可见cdh5 mRNA在造血组织PBI区有表达,见图3A;hoxb4实验组cdh5-mRNA的表达分别较EGFP对照组及WT对照组增加,差异均有统计学意义(P<0.05),但EGFP对照组与WT对照组间差异无统计学意义(P>0.05),见图3C。
2.5 cdh5基因48 hpf原位杂交检测
3组胚胎杂交后图片清晰,cdh5-mRNA在造血组织中无表达,均仅在后脑及血管处有较低丰度的表达。见图4。
3 讨论
造血发育是一个复杂的动态过程,在大量的内源和外源信号精密调控下进行,如转录因子、生长因子和细胞周期调控因子均参与了这个调节过程,如:hox、scl、lmo2、runx1、gata1、rag1、flk1等[10-11]。早期造血干/祖细胞的增殖与分化调控中hox家族最受关注,其中hoxb4作为第一个确认的正向调节因子,尤其受学者们关注。hoxb4在HSC自我更新的起始过程中起着非常重要的作用,但到目前为止,hoxb4影响HSC的作用机制仍不十分清楚[12-13]。cdh5分子在造血起始阶段的成血血管干细胞上有表达,对造血发育起重要作用[10]。有研究表明删除cdh5基因后小鼠胚胎停止在第12.5天,cdh5+的早期造血细胞可以重建造血[14],可见cdh5参与哺乳动物早期阶段造血发育。
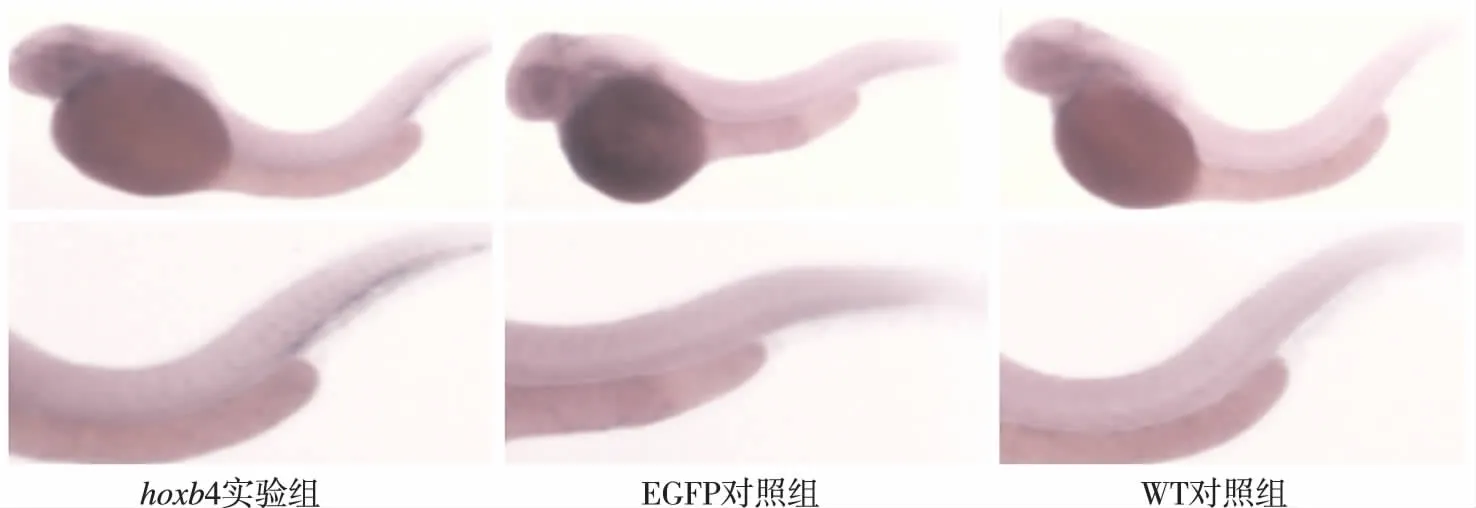
图4 3组48 hpf斑马鱼胚胎cdh5-mRNA的表达Fig.4 The effect of hoxb4 overexpression on the expression of cdh5-mRNA in 48 hpf zebrafish embryos by whole mount in situ hybridization in three different types
斑马鱼体积小、易于饲养,幼鱼期通体透明,造血系统发育调控、造血发育时空表达与哺乳动物一样都高度保守等特点,使其成为造血发育领域理想的模式生物[15-17]。斑马鱼的造血发育时程与哺乳动物类似,分为原始造血和定向造血;其造血时程和造血部位与哺乳动物造血时程和部位有较严格的对应关系,因此利用斑马鱼胚胎期通体透明,发育时程较哺乳动物快的特点,在体连续观察研究胚胎期造血发育变化情况,较体内受精、宫内发育的哺乳动物有较大的优势[18-19]。有研究表明斑马鱼胚胎定向造血起始于受精后的第30 h(30 hpf)[20-22],因此在斑马鱼胚胎受精后30 h以后选取相应时间节点进行定向造血发育研究是比较合适的阶段。
本研究用在造血组织EGFP标记的特异性高表达hoxb4的斑马鱼系为实验组,与EGFP对照组、WT对照组的定向造血阶段不同发育时相点的胚胎进行全胚胎原位杂交,选取发育时间节点为32、36、40、44、48 hpf。结果显示32、36 hpf时,hoxb4实验组造血组织AGM、PBI区cdh5-mRNA与EGFP对照组及WT对照组的阳性杂交信号有差异,且灰度值测定结果表明hoxb4实验组较EGFP对照组及WT型对照组增加,差异增有统计学意义(P<0.05),EGFP对照组与WT型对照组差异无统计学意义(P>0.05);40、44 hpf时,3组斑马鱼胚胎造血组织AGM、PBI区cdh5-mRNA的表达的阳性杂交信号有差异,PBI区域经灰度值测定结果表明hoxb4实验组较EGFP对照组及WT型对照组增加,差异增有统计学意义(P<0.05),EGFP对照组与WT对照组差异无统计学意义(P>0.05);48 hpf发育时相节点,3组斑马鱼胚胎cdh5-mRNA均仅在后脑与血管处有较低丰度的表达,造血部位没有观察到cdh5-mRNA的表达,这一结果提示在原始造血阶段高表达hoxb4的情况下,斑马鱼胚胎定向造血区域cdh5-mRNA表达增加,且高表达hoxb4的胚胎定向造血部位、cdh5表达区域与EGFP对照组及WT对照组胚胎一致,可能是原始造血阶段hoxb4的表达增加,影响了斑马鱼胚胎的原始造血,进而影响到定向造血早期阶段造血组织的发育和分化。因此,本研究考虑在斑马鱼胚胎造血发育调控过程中,cdh5基因可能是hoxb4基因的直接或间接靶基因,即hoxb4的高表达,促使cdh5基因表达量增加,以此促进细胞增殖,减少细胞凋亡,从而促进HSC的增殖与发育。
综上所述,本研究连续检测了转基因模式生物斑马鱼胚胎期定向造血阶段造血组织中cdh5-mRNA在不同造血区域的表达,使得实验结果具有时空连续性;确认了cdh5在斑马鱼造血发育调控过程中,会随着造血发育正向调控因子hoxb4表达的变化而变化,在造血时程与区域位置上严格对应,且变化明显。但是由于当前缺乏针对斑马鱼cdh5蛋白的特异性抗体,仅在mRNA水平研究了hoxb4高表达时cdh5在斑马鱼胚胎定向造血阶段的变化,尚不能完全反映cdh5作为黏附分子在造血组织的变化,今后需要根据科学的发展作进一步的研究。

