S100A8/A9蛋白对人舌鳞癌SCC-25及CAL-27细胞侵袭的影响
鲍玲娜, 马洪*, 李超, 孙俊泽
(1.贵州医科大学附属口腔医院 口腔颌面外科, 贵州 贵阳 550004; 2.四川省肿瘤医院·研究所 四川省癌症防治中心 头颈外科, 四川 成都 610000)
舌癌(tongue squamous cell carcinoma,TSCC)是口腔癌中最常见的种类,预后较差,患者5年生存率较低[1]。根据Globocan及世界卫生组织(WHO)公布的最新统计数据显示,2018年在我国口腔癌新发病例达到28 730例,死亡病例13 805例[2],在科学技术日益发展的今天,仍无法有效干预TSCC的侵袭和转移,导致其复发率及病死率未得到明显改善。S100A8/A9蛋白又称钙卫蛋白(calprotectin),是由S100蛋白家族中的重要成员,S100A8和S100A9蛋白以Ca2+依赖形式形成异二聚体复合物,在中性粒细胞及单核细胞中大量表达,参与肿瘤的免疫反应[3-4]。研究显示,较高浓度的S100A8/A9蛋白可以促使肿瘤细胞凋亡,而在低浓度时可促进肿瘤细胞增殖与迁移[5-7]。基质金属蛋白酶类(matrix metalloproteinases,MMPs) 是一类蛋白质水解酶,参与细胞外基质和基底膜的降解,与肿瘤的侵袭、转移密切相关[8]。MMP-2和MMP-9能够降解基底膜最重要的成分Ⅳ型胶原,从而促进肿瘤细胞的转移,被认为是肿瘤侵袭转移过程中最直接、最重要的金属蛋白酶[9-10]。本实验通过研究5 mg/L外源性S100A8/A9蛋白对舌鳞癌细胞SCC-25及CAL-27的侵袭能力和对MMP-2及MMP-9表达的影响,为S100A8/A9蛋白在舌鳞癌细胞侵袭转移中的相关机制研究提供理论依据。
1 材料与方法
1.1 材料
人舌鳞癌细胞SCC-25及CAL-27购自美国模式菌种收集中心(ATCC,美国),DMEM/F-12培养基、胰蛋白酶及青链霉素混合液购自美国Gibco公司,细胞培养瓶、离心管、Transwell小室及Matrigel matrix购自美国BD公司,胎牛血清(BI,以色列),4%多聚甲醛溶液(Leagene,中国),0.1% 结晶紫染色液(Solaibio,中国),TriPure RNA Isolation Reagent(Roche,美国),PrimeScriptTMRT reagent Kit (TAKARA,日本)。生物安全柜(ESCO,美国),倒置显微镜(OLYMPUS,日本),实时荧光定量PCR仪(ABI,美国)。
1.2 方法
1.2.1细胞培养及分组 SCC-25及CAL-27细胞按ATCC官方说明分别培养于含10%胎牛血清和1% 青链霉素的DMEM/F-12及DMEM完全培养基中,在37 ℃、5% CO2的细胞培养箱内培养,待细胞生长至80%~90% 时进行传代。将SCC-25及CAL-27细胞分别分为实验组及对照组,实验组用5 mg/ L S100A8/A9蛋白进行干预24 h,对照组添加等量培养基。
1.2.2细胞侵袭实验 将S100A8和S100A9重组蛋白以1 ∶1的质量比均匀混合,置于4 ℃冰箱作用1 h,使之结合形成S100A8/A9复合物[7]。取对数生长期的SCC-25及CAL-27细胞进行清洗、消化、重悬,并调整细胞浓度约1×105个/ mL。用对应培养基以1 ∶5稀释Matrigel matrix并铺在Transwell小室底部,取0.2 mL细胞悬液接种于Transwell小室,在下室内添加0.5 mL完全培养基,实验组在培养基中加入5 mg/ L S100A8/A9蛋白;4 h后取出小室,于4%多聚甲醛固定30 min,0.1% 结晶紫染色15 min,清洗、风干,镜下放大400倍观察结晶紫染色情况并随机选取5个视野拍照,计数每个视野中的穿聚碳酸酯膜细胞数。
1.2.3实时定量PCR(RT-qPCR) 分别用Tripure法提取各细胞样本的总RNA,按逆转录试剂盒说明书进行cDNA制备。引物由上海生工生物工程股份有限公司设计及合成,内参基因为GAPDH,行MMP-2及MMP-9基因实时定量PCR扩增。MMP-2引物F链为 CTGATGTCCAGCGAGTGGAT、R链为CTTCACCTCATTGTATCTCCAGAA,MMP-9引物F链为 CAGTACCGAGAGAAAGCCTATT、R链为 CAGGATGTCATAGGTCACGTAG,GAPDH引物F链为GTATCGTGGAAGGACTCATGAC、R链为ACCACCTTCTTGATGTCATCAT。反应条件:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 1 min,40个循环。根据2-ΔΔCt相对定量法计算各组MMP-2及MMP-9基因的相对表达量。
1.3 统计学方法
2 结果
2.1 细胞侵袭能力
实验结果显示,与对照组比较,实验组降解人工基底膜并穿过聚碳酸酯膜的SCC-25及CAL-27细胞数目明显增加(P<0.05),说明5 mg/L S100A8/A9蛋白能提高SCC-25及CAL-27细胞的迁移及侵袭能力。见图1。
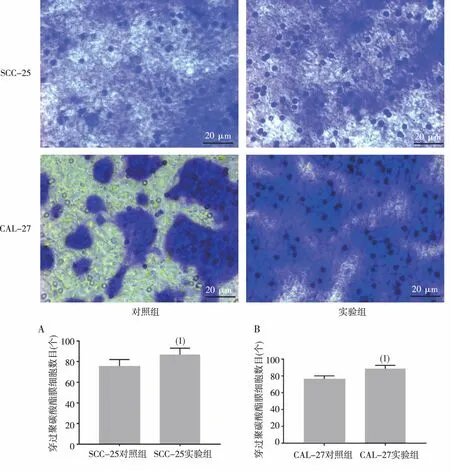
注:(1)与对照组比较,P<0.05。图1 S100A8/A9蛋白对SCC-25及CAL-27细胞侵袭能力的影响(结晶紫染色,×40)Fig.1 Effect of S100A8/A9 protein on invasion ability of SCC-25 and CAL-27 cells
2.2 MMP-2及MMP-9基因表达
实验组SCC-25及CAL-27细胞中MMP-2及MMP-9 基因表达水平均有不同程度升高,实验组SCC-25细胞中MMP-2及MMP-9 基因表达量分别是对照组的3.20及2.35倍,实验组CAL-27细胞中MMP-2及MMP-9 基因表达量分别是对照组的2.88及1.68倍,2组比较差异有统计学意义(P<0.05)。见图2。
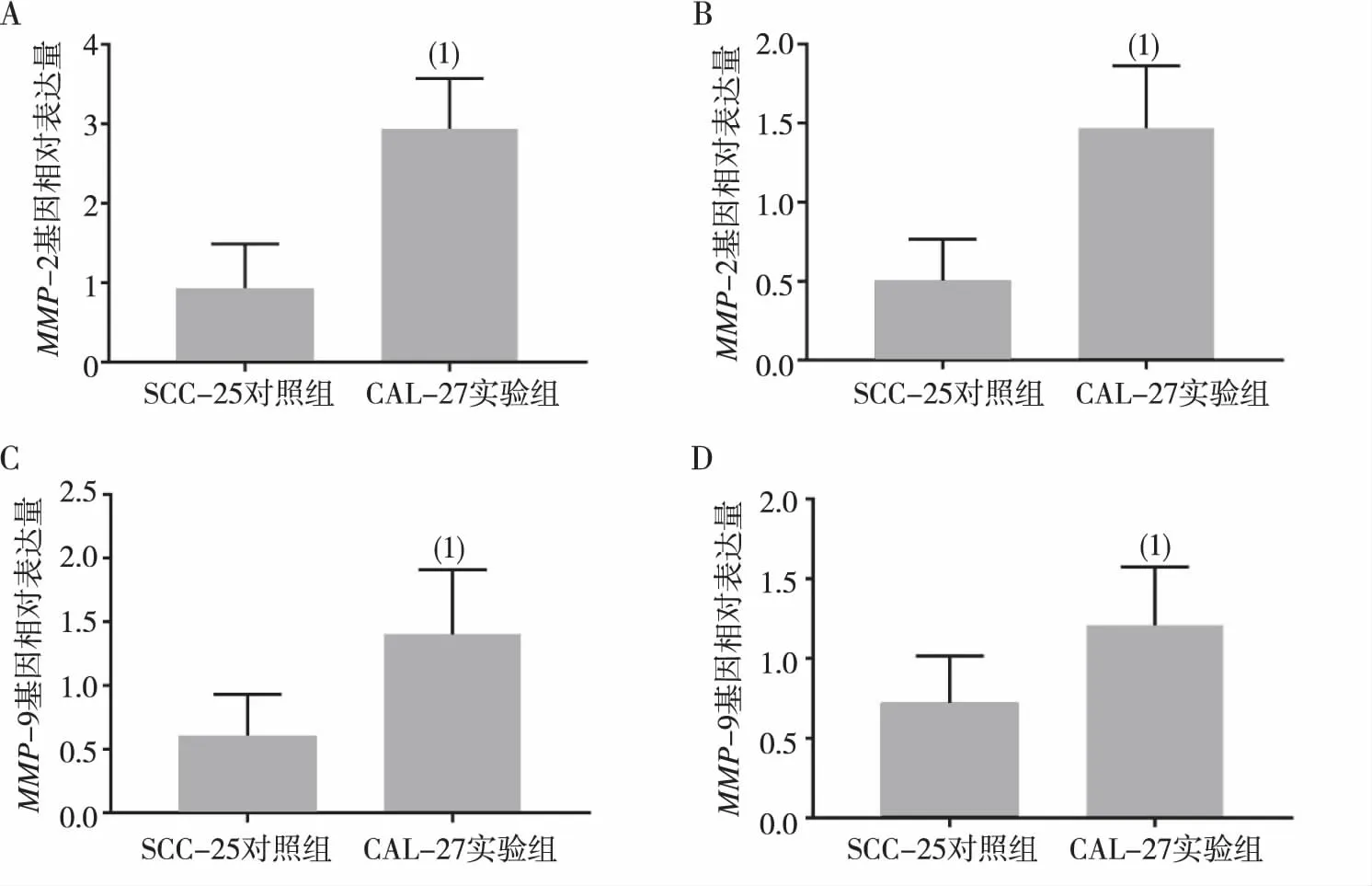
注:(1)与对照组比较,P<0.05。图2 S100A8/A9蛋白对SCC-25及CAL-27细胞中MMP-2及MMP-9基因表达的影响Fig.2 Influence of S100A8/A9 on the reIative expression amount of MMP-2 and MMP-9 genes of SCC-25 and CAL-27 cells
3 讨论
TSCC的发生发展是多因素、多阶段、多机制共同调控而成,主要危险因素包括大量持续咀嚼槟榔、吸烟、饮酒、HPV感染、锐利牙尖长期机械刺激、黏膜白斑、红斑及其他理化因素等,这些因素引起基因突变,通过复杂机制造成。S100A8蛋白和S100A9蛋白主要存在于细胞质中,在中性粒细胞(占所有胞浆蛋白的45%)、单核细胞等髓系细胞中大量表达,又称为髓系相关蛋白(myeloid related protein, MRP)8型及14型[4,11]。肿瘤细胞激活后,S100A8/A9复合体以两种不同的移位途径分泌,其一根据细胞内Ca2+浓度水平,使得S100A8/A9蛋白转移到细胞骨架和质膜;其二依赖于蛋白激酶C的激活,S100A8/A9 蛋白被特异性的分泌到细胞外环境而发挥生物学作用[12]。S100A8/A9蛋白作为MRP可与髓系抑制性细胞(myeloid-derived suppressor cells,MDSCs)相互作用,一方面MDSCs合成、分泌S100A8/A9蛋白;另一方面,S100A8/A9 蛋白可与MDSCs 表面的晚期糖基化终末产物受体(peceptor of advanced glycation end products,RAGE)上的羧酸化N聚糖结合,通过转录因子核因子-κB(nuclear factor-κ B,NF-κB)信号途径,促进MDSCs 的聚集[13]。这一过程可形成反馈环,促进MDSCs向肿瘤部位迁移,抑制宿主介导的抗肿瘤免疫应答,从而促进肿瘤的发生发展[3-4,14]。
肿瘤细胞通过其表面受体与细胞外基质(extracellular matrixc,ECM)中的某些成分结合后而激活或分泌蛋白降解酶类(主要为MMPs)来降解ECM,侵袭细胞基底膜(basement membrane,BM),使肿瘤细胞的包膜破坏形成转移通道而促进肿瘤细胞的转移[15]。另外,MMPs也可直接作用于肿瘤细胞,释放促进生长或抑制凋亡的细胞因子。MMPs在结构、分子功能和参与肿瘤进展方面的特性为更有效地靶向肿瘤治疗提供了新的途径[16]。在口腔鳞癌的研究中发现,MMP-2的过表达是肿瘤侵袭的必要条件,并且与口腔鳞癌局部复发之间存在显著的相关性,MMP-2下调可减少肿瘤血管生成[17],说明MMP-2和MMP-9的表达在口腔鳞癌的发生发展中起着重要的作用。
在本实验中,通过对Transwell小室底部铺一层基质胶来人工模拟肿瘤细胞降解基底膜而发生侵袭的过程,该基质胶是从富含胞外基质蛋白的EHS小鼠肉瘤中分离得到,其主要成分是层黏连蛋白、Ⅳ型胶原、巢蛋白、生长因子及基质金属蛋白等。在室温下,它可以聚合形成具有生物学活性的三维基质进而模拟体内细胞基底膜的结构、组成以及物理化学特性等。通过甲醛固定及结晶紫染色检测到在5 mg/L外源性S100A8/A9蛋白作用下,SCC-25及CAL-27细胞降解基质胶发生侵袭的作用明显增强,穿过小室底部的聚碳酸酯膜的细胞数明显增多。实验也通过RT-qPCR检测到经过5 mg/L外源性S100A8/A9蛋白处理后,SCC-25及CAL-27细胞中与侵袭转移密切相关蛋白酶MMP-2和MMP-9基因表达量明显增多,说明5 mg/L外源性S100A8/A9蛋白可以增强SCC-25及CAL-27细胞的侵袭转移能力,提示S100A8/A9蛋白可能在TSCC局部侵袭及转移过程中发挥重要的作用,从而与TSCC的不良预后密切相关。
随着肿瘤分子生物学的不断深入研究,对于TSCC的研究范围也得以延伸,如TSCC发生前因素口腔黏膜白斑和红斑、HPV感染、DNA甲基化等,TSCC发生中通路Wnt/β-Catenin、p38 MAPKs、SAP/JNK磷酸化、NF-κB、EMT等研究逐渐成为热点;有针对细胞周期、活性氧簇、细胞凋亡家族(Bcl-2家族、caspase家族)等的相关研究,研究技术也不断更新,有体内可视化、荧光内镜、唾液和血清检测及siRNA技术等。随着分子生物学技术水平的发展,科研的深度及广度可大大提高,探究敏感的肿瘤标志物有利于改善TSCC患者的生存率以及减少其复发率。
综上所述,5 mg/L外源性S100A8/A9蛋白能增强TSCC细胞的侵袭能力、增加MMP-2和MMP-9基因表达,S100A8/A9蛋白可能在TSCC侵袭进展中发挥重要作用,可作为潜在的TSCC标志物进行深入研究。

