术中静脉输注利多卡因优化术后疼痛管理并加速胃肠功能恢复:回顾性队列研究
卫佼佼,张越伦,卢素芳,任丽英,王英丽,申 乐,黄宇光
中国医学科学院 北京协和医学院 北京协和医院 1麻醉科 3医学科学研究中心, 北京 1007302民航总医院麻醉科, 北京 100123
自加速康复外科(enhanced recovery after surgery, ERAS)理念推出以来,多模式镇痛(multimodal analgesia, MMA)得到普及,患者自控使用静脉阿片类药物镇痛成为治疗术后中重度疼痛的策略之一[1- 3]。由于阿片类药物可引起恶心、呕吐等不良反应,长期大量使用甚至会导致成瘾,因此如何减少围手术期阿片类药物的用量成为普遍关注的问题[4- 5]。
ERAS理念提倡术后MMA,目标包括减轻疼痛、早期下地活动、促进胃肠道功能恢复、降低并发症发生率[6]。目前多部ERAS指南推荐利多卡因作为术后MMA药物[7- 9]。笔者团队既往研究发现,妇科腹腔镜手术中使用低剂量利多卡因不仅具有较好的镇痛效果,且可减少术中阿片类药物的用量,加速术后康复,这可能与利多卡因通过镇痛、抗炎、抗痛觉过敏的特性有关[10- 12]。本研究进一步观察了在腹盆部手术(开放性及腹腔镜手术)中静脉输注利多卡因对术后镇痛及康复的影响。
1 资料与方法
1.1 研究对象
回顾性收集2017年1月至2019年5月间在北京协和医院行腹盆部手术患者的临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、美国麻醉医师学会(American Society of Anesthesiologists,ASA)分级、手术种类、手术时间以及麻醉时间等。其中术中持续静脉输注利多卡因者设为试验组,未采用术中持续输注利多卡因者作为对照组。
纳入标准: (1)ASA分级为 Ⅰ~Ⅲ 级的患者;(2)择期腹盆部手术全身麻醉者;(3)术后24 h内使用舒芬太尼自控镇痛(patient-controlled analgesia, PCA)。
排除标准:(1)术前采用神经阻滞;(2)访视时已撤除镇痛泵且无数据记录或数据记录不完整者(图1)。
本研究已通过中国医学科学院北京协和医院伦理审查委员会审核(伦理审核编号:S-K918)。
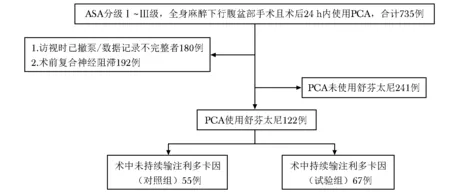
图 1两组接受腹盆部手术患者纳入流程图
PCA:患者自控镇痛
1.2 麻醉管理及分组
对照组采用静吸复合全麻或全静脉麻醉方案,静吸复合全麻诱导采用芬太尼(人福,中国宜昌)1~2 μg/kg、丙泊酚(AstraZeneca,意大利)2.0~2.5 mg/kg、罗库溴铵(Hameln Pharmaceuticcals GmbH,德国)0.6 mg/kg,术中维持采用氧气-氧化亚氮-七氟醚混合吸入,维持肺泡最低有效浓度(minimum alveolar concentration,MAC)在1.0%~1.3%,间断追加芬太尼与罗库溴铵;全静脉麻醉诱导采用静脉靶控输注丙泊酚3~6 μg/ml、芬太尼1~2 μg/kg、罗库溴铵0.6 mg/kg,术中持续靶控输注丙泊酚3~4 μg/ml并间断追加芬太尼与罗库溴铵。试验组在上述麻醉方案基础上加用静脉输注利多卡因(遂成药业,中国天津),诱导剂量1.0~1.5 mg/kg,维持剂量1.0~1.5 mg/(kg·h),直至手术结束。
1.3 术后镇痛方案及观察指标
术后均采用静脉舒芬太尼PCA,浓度0.3~0.6 μg/ml,持续输注量1~2 μg/h,单次注射剂量2~4 μg,锁定时间10~15 min。
观察术后24 h内舒芬太尼用量、PCA按压次数,静息及活动状态下的疼痛视觉模拟评分(visual analogue score,VAS)为主要结局指标,恶心呕吐情况、首次排气时间为次要结局指标。上述资料由当日麻醉科值班人员及术后疼痛治疗小组(麻醉科手术室高年资护士1名及低年资护士1~2名)至病房访视、记录,上下午各1次。
1.4 统计学处理
采用SPSS 17.0软件进行统计分析。计量资料先行正态分布检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料采用中位数 (四分位数)表示,组间比较采用秩和检验。计数资料以频数(百分数)表示,组间比较采用卡方检验。P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共纳入122例符合纳入和排除标准的患者,其中试验组67例,对照组55例,平均年龄(51±15)岁(18~83岁);男性54人,女性68人;两组基线资料匹配,性别、年龄、BMI、ASA分级、手术时间、手术种类等指标未见统计学差异(表1)。
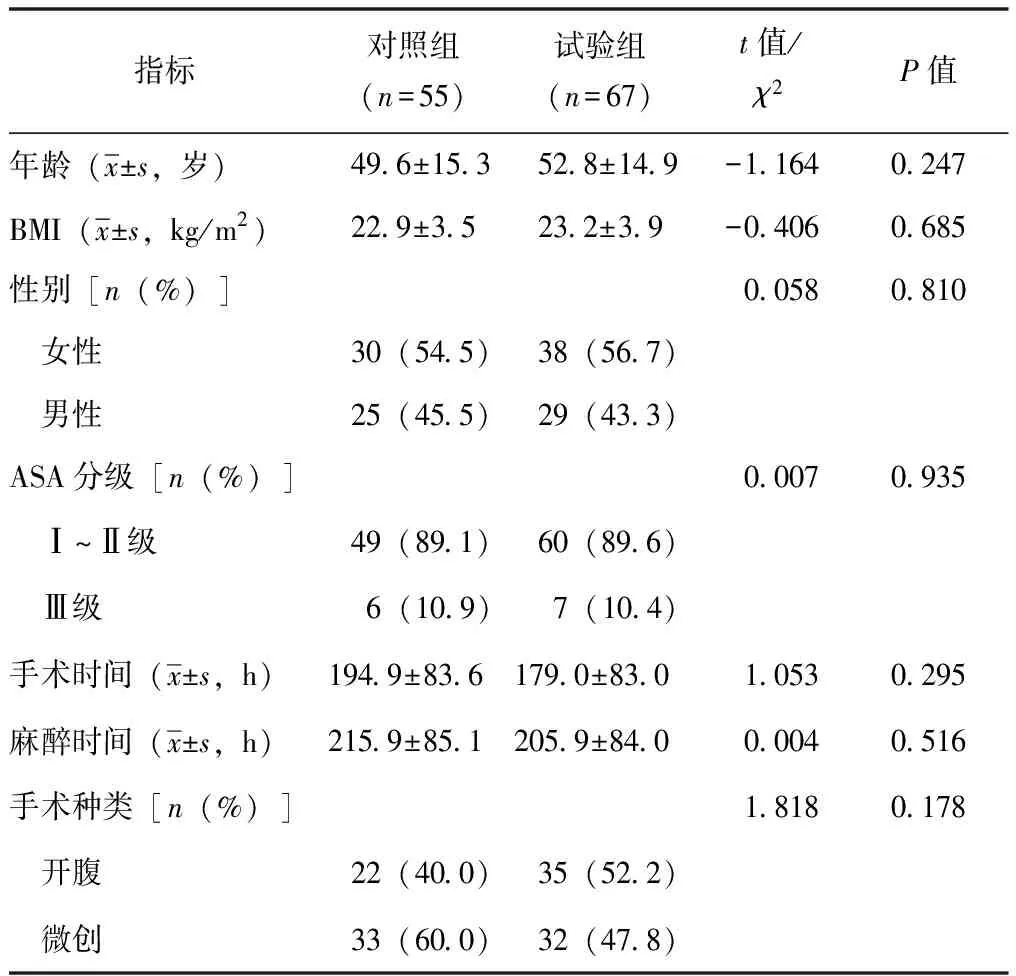
表 1 两组腹盆部手术患者一般临床资料比较
BMI:体质量指数,ASA:美国麻醉医师学会
2.2 疼痛管理相关指标比较
试验组术后24 h内舒芬太尼用量和PCA自主按压次数明显减少(P均<0.05)(表2),静息及活动状态VAS≤3分者比例均更高(97.0%比85.5%,χ2=3.938,P=0.047; 68.7%比47.3%,χ2=5.710,P=0.017)(表3)。
2.3 胃肠道功能恢复情况
试验组和对照组术后24 h内恶心呕吐发生率无统计学差异(P均>0.05),但试验组术后24 h内的排气率显著增加(26.9%比5.5%,χ2=9.717,P=0.002)(表4)。
3 讨论
本研究显示,术中静脉输注利多卡因可显著降低术后24 h内舒芬太尼用量和PCA的需求,加速术后胃肠道功能的恢复。

表 2 两组腹盆部手术患者术后24 h内舒芬太尼自控镇痛情况比较
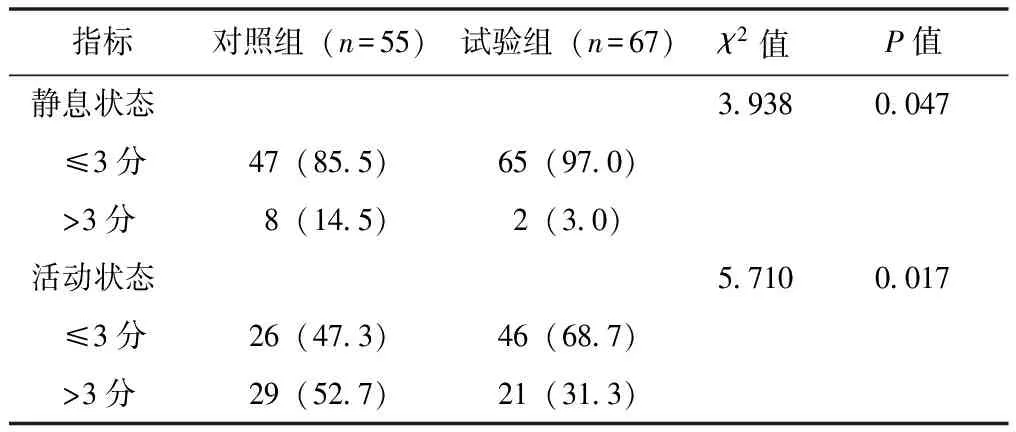
表 3 两组腹盆部手术患者术后24 h静息及活动状态 疼痛视觉模拟评分比较 [n(%)]
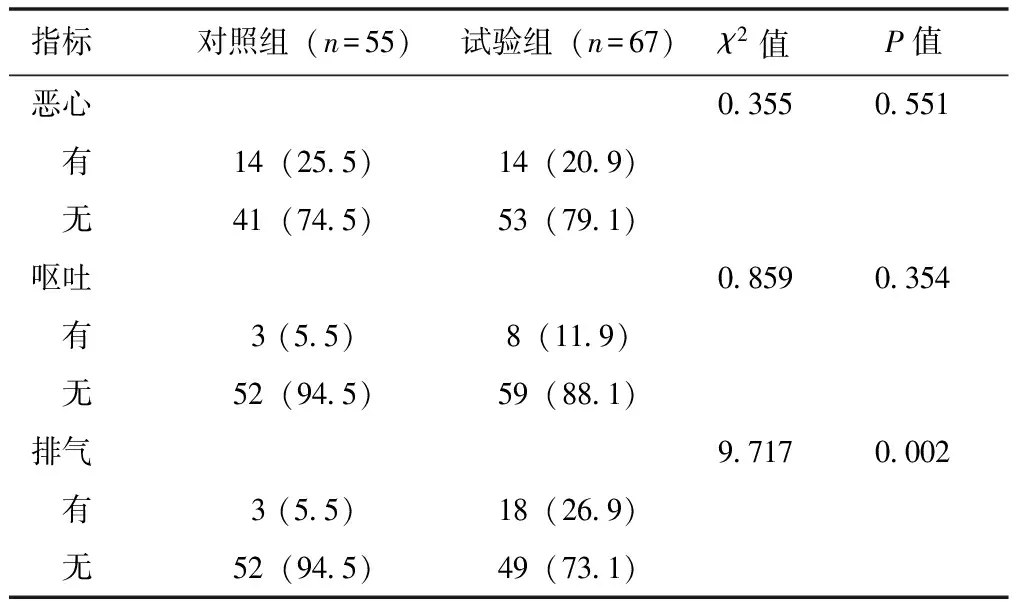
表 4 两组腹盆部手术患者术后24 h胃肠道功能 恢复情况比较 [n(%)]
多项研究显示,术中静脉输注利多卡因可减少结直肠术中阿片类药物的使用,并降低恶心的发生率[13- 16]。2016年的胃肠道手术ERAS指南建议在MMA中使用利多卡因:诱导前30 min内静脉注射负荷量利多卡因1.5 mg /kg(理想体重),术中持续输注维持量2 mg/(kg·h)(理想体重)[7]。腹盆部手术术中使用低剂量利多卡因同样可以减少术后阿片类药物用量,加速术后胃肠道功能恢复,降低局麻药中毒及心律失常等风险[17- 19]。
小剂量静脉输注利多卡因可通过抑制脑干功能及阻断气管内和咽喉部的外周反射,抑制咳嗽,减少应激反应,减少呛咳导致的切口疼痛[19]。局部注射利多卡因后可与α亚单位的特定区域结合,抑制电压门控钠离子通道[valtage-gated sodium channel(VGSC)或Nav]开放,减少钠离子内流所引起的细胞膜去极化,抑制动作电位传播和神经元兴奋,发挥镇痛作用[20];此外,利多卡因可增强阿片类药物的镇痛作用,具有抗炎、抗痛觉过敏的特性[10]。
人体内阿片受体分布广泛,故阿片类药物镇痛的同时可能对胃肠道、呼吸系统、肌肉骨骼系统和内分泌系统产生不同影响,如阿片类药物与肠道μ受体结合,导致蠕动减少、运输时间延长,使粪便吸收更多水分,形成便秘,且阿片类药物的副作用通常呈剂量依赖性[21- 22]。利多卡因可减少阿片类药物的用量,由于其对不同类型钠通道几乎无选择性,静脉注射利多卡因镇痛的潜在机制可能较局部阻断外周神经更复杂。VGSC是利多卡因的作用位点之一,是由α-亚基与调节β-亚基(β1-β4)结合形成的异聚体整合膜糖蛋白,哺乳动物有10种α-亚基,Nav1.1~Nav1.9及Nax[23]。Nav1.7、Nav1.8和Nav1.9主要位于外周神经系统(利多卡因的靶点,遗传缺陷会引起疼痛或不敏感),Nav1.5在胃肠道表达[24],或许可以解释利多卡因促进肠道快速恢复的机制。虽然炎症对组织损伤修复具有重要作用,但过度炎症刺激对围手术期的康复则有影响,如导致胃肠动力受损,静脉输注利多卡因可通过调节炎症级联反应中的不同靶点促进胃肠动力恢复[25]。利多卡因可增加大脑皮层细胞内的Ca2+浓度,而躯体感觉神经元Ca2+电流的调节是引发神经病理性疼痛的潜在机制之一[26- 27]。低压激活的T型钙通道(Cav3.1、Cav3.2和Cav3.3)参与疼痛信号传导,其中Cav3.2亚型尤其与躯体神经性疼痛(神经损伤、糖尿病、中毒性化疗)和内脏疼痛(结肠超敏反应)密切相关[28]。
本研究为回顾性队列研究,尚存在一定局限性。首先,试验组和对照组间比较恶心呕吐未见显著差异,可能与样本例数不足有关。同时,尽管两组间舒芬太尼用量存在差异,但因差异较小[加权平均差为0.01 μg/(kg·h)],此剂量是否具有临床实际价值,仍需大样本研究验证。其次,本研究未调整术中术后非甾体类药物的使用情况,结果可能会受到一定影响。此外,仅分析术后24 h内的疼痛及胃肠道功能恢复情况,并未涵盖感染、出血等并发症及其他各脏器功能的恢复情况,需进一步开展前瞻性研究,将感染、并发症、呼吸功能训练、基本生活及活动能力等指标纳入研究,延长随访时间,对长期预后作进一步分析。
综上,全身麻醉的基础上持续静脉输注利多卡因,可能会优化腹盆部手术后的疼痛管理,改善胃肠道功能,加速术后康复,在MMA中发挥一定作用。

